郑小娟 段亚男 温鸿雁 李小峰
类风湿关节炎(RA)是一种慢性自身免疫性炎症性疾病,发生率为0.5%~1.0%,女性和老年人发生率较高[1]。目前病因未明确,认为免疫失衡在其发病机制中具有重要作用。调节性T细胞(Treg)和辅助性T细胞17(Th17)是CD4+T细胞的两个重要亚群。Th17细胞分泌IL-17,在人类和小鼠中IL-17具有促炎作用,且与许多炎症相关,而Treg则具有抑制炎症的作用,并参与了维持自身环境的免疫耐受。本研究采用流式细胞术(FCM)检测RA患者外周血淋巴细胞及CD4+T细胞亚群的表达情况,并探讨其在RA发生、发展中的意义。
对象与方法
1.研究对象:137例RA患者均为2017年5月~2018年8月笔者所在科室住院患者,其中,男性34例,女性103例;患者年龄14~86岁,平均年龄51±13岁;病程0.05~38.00年,平均病程7±8年。其诊断均符合美国风湿学会1987年的RA诊断标准,排除标准:严重肾脏、血液系统、心脏、肝脏及内分泌系统疾病患者;消化道疾病患者。要求纳入观察组的患者无干燥综合征、系统性红斑狼疮、结缔组织病等免疫疾病或影响免疫的相关疾病。同时收集50例来笔者医院健康体检者为健康对照组,其中,男性8例,女性42例;年龄20~66岁,平均年龄42±14岁。病例组和对照组的年龄、性别等一般资料比较,差异无统计学意义(P>0.05)。
2.研究方法:采集137例RA患者及50例正常人外周血,并收集它们的所有临床资料,包括性别、年龄、病程,用流式细胞仪技术(FCM)检测正常人和患者外周血淋巴细胞亚群绝对数、CD4+T细胞亚群绝对数。山西医科大学第二临床医学院风湿免疫科实验室为该课题提供数据。
3.主要设备及试剂:采用美国BD公司提供的 FACS Calibur流式细胞仪。淋巴细胞检测使用试剂:单克隆抗体 CD3/CD8/CD45/CD4;CD3/CD16+56-/CD45/CD19;Trucount 管(内部含有数量可知的Beads);FACS Lysing Solution(溶血素)(10×,使用前用蒸馏水稀释成1×);CD4+T细胞亚群检测使用试剂:离子霉素、胎牛血清、1640液、高尔基阻断剂、刺激素PMA购自美国Sigma公司。单克隆抗体CD4-FITC、IL-4-PE、IFN-γ-APC、IL-17-PE、CD25-APC、FoxP3-PE购自美国BD公司。
4.淋巴细胞检测:两支Trucount管顺序分别编号A和B;将50μl尽量混匀的抗凝全血倒入到Tube中(使用的方法是反向加样法);另外再取 CD3FITC/CD8PE/CD45PercP/CD4APC抗体20μl加入到A管中;取 CD3FITC/CD16+56-PE/CD45 PercP/CD19APC抗体20μl加入到B管中。涡旋混匀,室温避光放置15~20min。将450μl 1×FACS溶血素倒入其中,均匀混合,室温避光静置15min。24h内将A、B管放入检测仪上,在MultiSET软件上抽取15000个细胞进行检测。上机前应充分混匀。
5.Th细胞亚型标记:(1)Th1细胞、Th2细胞、Th17细胞培养与标记:在刺激剂10μl PMA工作液(终浓度30ng/ml)、10μl Ionomycin工作液(终浓度750ng/ml)和1μl GolgiStop中分别加入80μl抗凝血,调整CO2培养箱温度在37℃,并刺激上述试剂5h。将细胞分成A管和B管,将抗人CD4-FITC分别倒入A管和B管,在没有光照的室温下培育30min后,将配置不久的Fixation/Permeabilization液1ml分别倒入各管涡旋搅匀,4℃避光孵育30min后,将IL-4-PE和IFN-γ-APC加入A管,将抗人IL-17-PEB倒入B管。(2)Treg细胞标记:将CD4-FITC和CD25-APC分别加入80μl抗凝血,室温避光孵育30min后,A、B管分别加入新鲜配置的Fixation/Permeabilization液1ml涡旋混匀,4℃避光孵育30min后,加入抗人FOXP3抗体,在没有光照的室温下培育30min后,PBS清洗,上机测试。(3)流式细胞仪测定:24h内上流式细胞仪(Calibur, 美国BD公司),并用流式细胞技术测定分析结果。根据对淋巴细胞设门区分淋巴细胞,该区分采用的是前向角散射光(FSC)及对侧向角散色光(SSC)的散点图,区分Th细胞(CD4+)的方法是通过CD4对SSC设门,选择门内10000个细胞,以CellQuest软件取得、分析相应百分数,并推算出绝对数量。
6.统计学方法:数据采用SPSS 20.0统计学软件对数据进行统计分析;数值变量不服从常态分布,采用中位数(四分位数)法进行统计描述;两样本比较采用Mann-WhitneyU检验;组间比较采用方差分析,以P<0.05为差异有统计学意义。
结 果
1.RA与健康人淋巴细胞绝对计数的比较:RA患者Th细胞明显高于健康对照组、NK细胞明显低于健康对照组,差异有统计学意义(P<0.05),详见表1。

表1 两组外周血淋巴细胞绝对数[个/微升,M(P25,P75)]
2.RA患者与健康组CD4+T细胞绝对计数的比较:除Th17细胞外,其Th1、Th2、Treg、Th1/Th2、Th17/Treg与健康对照组比较,差异均有统计学意义(P<0.05),详见表2。
3.早期RA与非早期RA淋巴细胞绝对计数的比较:非早期RA患者总T明显低于早期RA患者,差异有统计学意义(P<0.05),详见表3。
4.早期RA与非早期RA患者CD4+T细胞绝对计数的比较:非早期RA患者Th17细胞明显低于早期RA患者,差异有统计学意义(P<0.05),详见表4。

表2 两组外周血CD4+T细胞绝对计数[个/微升,M(P25,P75)]
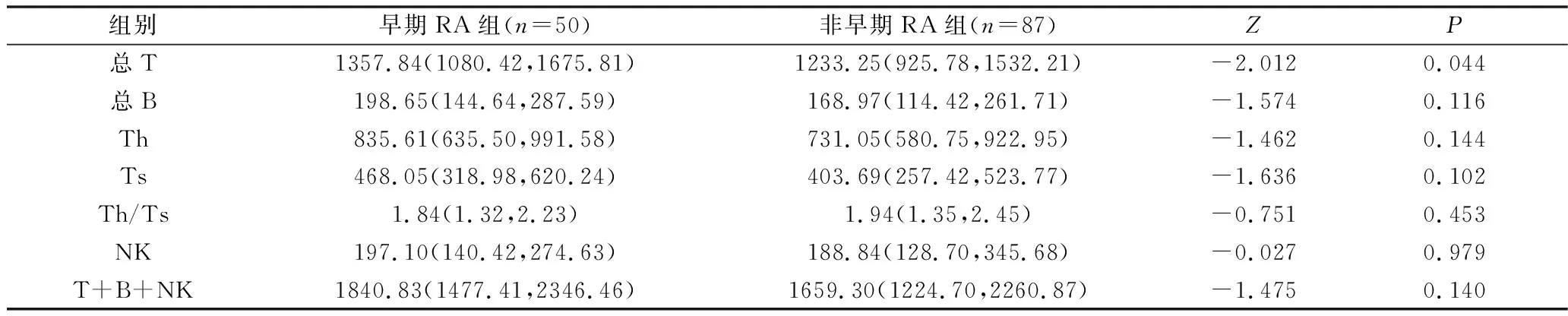
表3 两组外周血淋巴细胞绝对数[个/微升,M(P25,P75)]
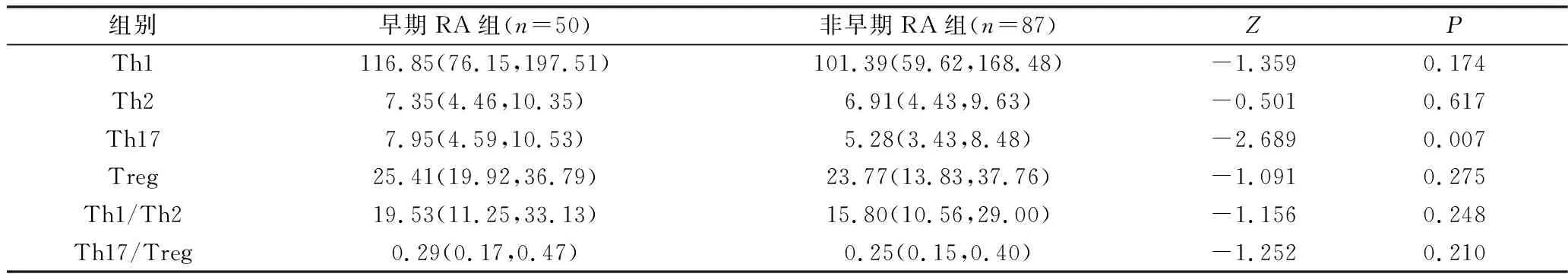
表4 两组外周血CD4+T细胞绝对数[个/微升,M(P25,P75)]
5.外周血CD4+T细胞绝对计数的比较:初治组、复治组与健康对照组CD4+T细胞亚群比较,Th1、Th2、Th1/Th2、Th17/Treg均有统计学意义(P<0.05),详见表5。
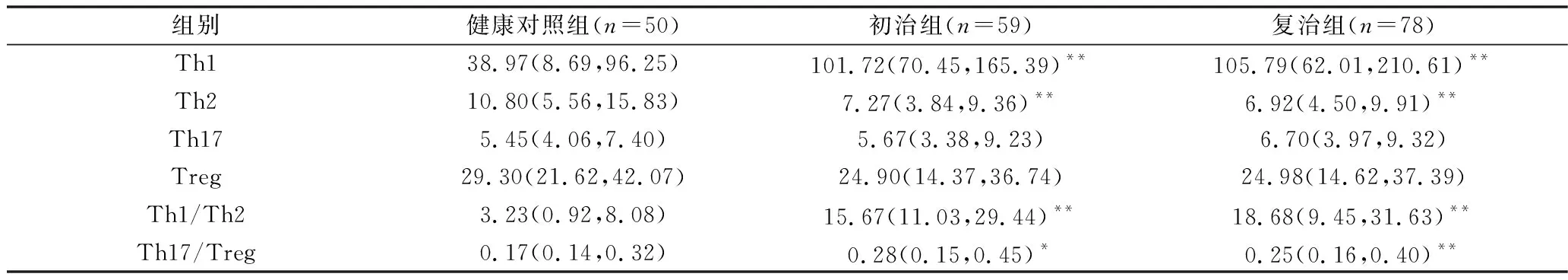
表5 3组外周血CD4+T细胞绝对数的比较[个/微升,M(P25,P75)]
6.不同疾病活动分层中,Th17、Treg、Th17/Treg细胞绝对数的变化:在低活动组和中活动组中Th17细胞绝对数高于健康对照组,其中3.2 表6 不同疾病活动分层Th17、Treg、Th17/Treg细胞绝对数的变化[个/微升,M(P25,P75)] RA是一种慢性自身免疫性疾病,尽管发病机制不明确,但已认识到RA与机体免疫功能相关。研究表明Th/Ts细胞的平衡,在自身免疫性疾病的发生、发展过程中起重要作用。此外NK细胞存在RA患者的滑膜液中,被认为在骨破坏中起重要作用[2]。本研究结果显示,RA患者Th细胞在外周血淋巴细胞中所占的绝对计数明显高于正常人,说明Th细胞参与RA疾病的发病。并且NK细胞在外周血中所占的绝对计数明显低于正常人。究其原因,有研究指出,NK细胞功能与运动之间有一定联系,包括血运、缺氧和体温调节对NK细胞功能的影响[3]。由此可知,可能是多种因素导致RA中NK细胞绝对数量及功能降低,进而影响其发挥免疫调节作用,而不完全是RA疾病本身所导致的数量减少。 另有研究表明,CD4+T细胞亚群中Th1、Th2等异常在RA的发生、发展中发挥重要作用[4]。以前多数认为RA是由Th1驱动的疾病,Th1细胞与炎症有关,而Th2细胞在一定程度上有抗炎作用。有实验对RA纵向研究发现,在RA早期的PBMCs中,Th2反应占主导地位,而长期慢性RA表现出Th1占主导反应[5]。可知Th1或Th2反应是否在RA中占主导作用可能取决于多种因素,包括患者年龄、RA分期(早期或晚期)以及病情所在位置(PBMCs或滑膜液)。本研究结果发现,RA患者Th1细胞在外周血淋巴细胞所占的绝对计数明显高于健康对照组,该结果与陈俊伟等[6]的研究结果相近,说明Th1细胞在RA疾病的发病中起到一定的作用。Th2细胞在外周血淋巴细胞所占的绝对计数明显低于健康对照组,且Th1/Th2在外周血淋巴细胞所占的比例明显高于健康对照组,两者比较差异均有统计学意义,提示Th1、Th2与RA发病均有一定的相关性,且Th1/Th2失衡在RA的发病起关键作用。 有研究认为Th17来源的细胞因子通过诱导IL-6、GM-CSF、IL-8等来吸引不同类型细胞,尤其是IL-17A和IL -17F是参与RA发病机制的关键细胞因子,此外,Th17细胞产生的IL-21促进B细胞分化为产生自身抗体的浆细胞,并以自分泌方式放大Th17细胞反应[7]。 本研究显示,RA患者Th17细胞计数比健康对照组高,两者比较差异无统计学意义,与贾瑞环等[8]的研究结果相一致。某种程度上说明Th17细胞在RA中起到的作用有限。Liu等[9]从大鼠淋巴细胞检测Th17/Treg细胞比例,与对照组比较,大鼠关节炎Treg细胞表达水平明显下降,IL-17表达水平明显升高,本研究结果与该研究结果相矛盾。尽管许多研究结果不全相同,但普遍认为Th17细胞某种程度上参与RA疾病进展。也有研究显示,STAT3 对Th17 细胞分化有着关键的作用,上调STAT3促进Th17细胞分化,下调STAT3抑制Th17细胞分化,由此可以通过影响STAT3诱导Th17细胞向有利的方向分解[10, 11]。 与Dong等[12]的研究结果一致,本研究结果也证实了RA患者外周血Treg细胞绝对数比正常人明显降低,且Th17/Treg比值比健康对照组明显升高,两者比较差异均有统计学意义。说明Treg细胞绝对数量减少及功能降低是造成RA发病的关键因素,且Th17/Treg平衡紊乱在RA的发展中发挥关键作用。在人类中,Th17细胞可以诱导IL-6、IL-1β和TNF-α,所有这些在活动性RA患者发炎的关节中都很多,并直接参与软骨和骨的破坏[13]。虽然通常认为Th1和Th17细胞在RA的进展中发挥重要作用,Evans等[14]进一步研究报道,体内自发激活了从RA患者炎症关节中提取的CD14+单核细胞,并特异性诱导Th17,而非Th1或Th2反应。可知,在RA患者中增多的Th17细胞激活同时受体内自身因素影响。 有研究显示,在体外骨髓源性抑制细胞(MDSCs)抑制小鼠CD4+T细胞IL-17表达,上调FOXP3表达[15]。体内注射MDSCs可明显改善炎症性关节炎。经MDSCs处理的小鼠脾脏Th17细胞和Th1细胞减少,Treg增加,提示MDSCs可能是治疗自身免疫性疾病的有效策略。通过不同方式调节Th17/Treg失衡将成为纠正免疫稳态的重要途径。 本研究显示,非早期RA患者外周血总T细胞绝对数明显低于早期RA患者,说明非早期RA患者免疫力更低,随着疾病进展,淋巴细胞在外周血中的绝对数明显减少,表明非早期RA患者更容易发生感染。而非早期RA患者Th17细胞绝对数明显低于早期RA患者,差异有统计学意义,其一可能与RA患者长期使用DMARDS药物治疗导致免疫抑制的结果,其二也可能与RA的分期(早期或非早期)以及病情所在的位置(PBMCs或滑膜液)相关联。同时本研究对59例初治RA患者、78例复治RA患者与50例健康人比较,发现Th17/Treg细胞比值较健康人明显升高,提示初治患者及使用DMARDS药物治疗的复治患者均存在免疫失调,间接反应出长期使用DMARDS药物治疗不能很好地控制疾病进展。 为寻找更好的治疗方案,Jhun等[16]研究显示,二甲双胍和辅酶Q10联合应用减少关节炎症、Th17分化和IgG生成,诱导Treg分化,降低破骨细胞生成,且二者的结合促进了线粒体O2的消耗,二甲双胍和辅酶Q10联合使用可降低CIA的严重程度,改善线粒体功能障碍,该研究为类风湿关节炎提供了新的治疗策略。此外,本研究将137例RA患者根据疾病活动度进行分层,分为低活动组、中活动组、高活动组,发现随着疾病活动度的增高,在低活动组和中活动组中Th17细胞绝对数明显高于健康对照组,同时Th17/Treg在DSA28≤3.2组及3.2 综上所述,Th17/Treg细胞可能在RA的发病中发挥着重要的作用,但它们之间的相互抑制、相互作用的关系,仍不明确,有待于今后进一步研究。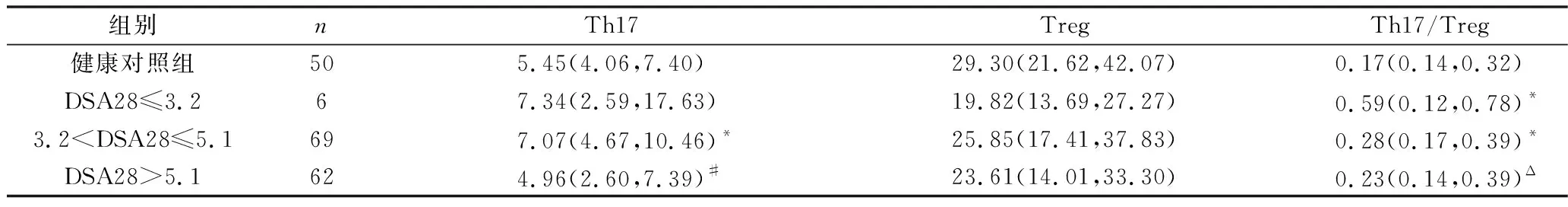
讨 论



