李雪敏 杨贵芳 田 珏 郭瑞霞 杨晓丽
卵巢多囊样改变(polycystic ovarian morphology, PCOM)指超声监测下单侧卵巢内直径2~9mm的卵泡≥12个或卵巢体积>10ml,可引起女性肥胖、月经紊乱甚至激素分泌失调,约33%的育龄女性超声显示PCOM[1, 2]。既往研究表明,PCOM是处于正常卵巢和多囊卵巢综合征(polycystic ovary syndrome, PCOS)间的独特实体,其超声表现、颗粒细胞异常程度及部分临床指标均与PCOS有所差异,且部分患者属于PCOM合并不孕症需辅助生殖技术(assisted reproductive technology, ART)助孕,故有必要将PCOM独立分组研究[3~6]。ART中卵母细胞的良好发育是获得良好妊娠结局的基础,抗苗勒管激素(anti-Müllerian hormone, AMH)是评估卵巢储备功能及卵子质量的良好生物学标志物,其与PCOS的关系报道颇多[7~11]。但不同AMH水平对PCOM患者卵母细胞发育的影响鲜见报道,且PCOM及PCOS人群中不同AMH水平与卵母细胞发育指标的关系是否相同也鲜见报道。
本研究拟通过测定PCOM及PCOS患者血清AMH水平,分析两人群中血清AMH水平与卵母细胞指标关系有无差异,探讨AMH水平对PCOM患者卵母细胞发育潜能影响,旨在预测临床不同AMH水平的PCOM患者卵母细胞发育情况,制定更具针对性的诊疗计划,减少体外受精-胚胎移植(in vitro fertilization-embryo transfer, IVF-ET)失败次数,提高临床妊娠率,对AMH进一步应用于ART领域具备一定价值。
资料与方法
1.研究对象:选取2017年8月~2022年12月在山西医科大学第九临床医学院生殖医学中心行IVF-ET的480例不孕症患者作为研究对象。
2.纳入与排除标准:纳入标准:(1)PCOM患者纳入标准:①因输卵管因素行IVF-ET助孕;②超声监测下单侧卵巢内直径2~9mm的卵泡≥12个或卵巢体积>10ml[1];③基础性激素正常;④排卵正常。(2)PCOS患者纳入符合鹿特丹标准[12]。(3)年龄20~35岁。(4)阴超证实双侧卵巢完整且无形态学异常。(5)病历信息完整。排除标准:(1)盆腔恶性肿瘤病史者。(2)有放化疗及药物服用史等损害卵巢功能者。(3)患有其他影响促性腺激素分泌疾病者。(4)合并有严重全身性疾病患者。
3.分组:①对照组(因输卵管因素行IVF-ET助孕)160例;②PCOM组(因PCOM合并输卵管因素行IVF-ET助孕)104例;③PCOS组(因PCOS因素行IVF-ET助孕)216例。一项Meta分析结果表明,AMH截止值为4.7ng/ml时诊断有症状PCOS的特异性和敏感度为79.4%和82.8%[13]。本研究将PCOS人群按血清AMH水平(≤4.7ng/ml为正常值,>4.7ng/ml为高值)分为正常AMH组(n=72)和高AMH组(n=144),PCOM人群也就此标准分为正常AMH组(n=72)和高AMH组(n=32)。本研究符合《赫尔辛基宣言》原则,患者均已签署知情同意书,本研究获得了山西医科大学第九临床医学院医学伦理学委员会批准(伦理学审批号:2021002)。
4.IVF-ET方案:480例患者采取不同促排方案,激素用量据卵泡生长情况确定,经阴道超声下有2个以上卵泡直径≥20mm当日夜间给予人绒毛膜促性腺激素10000U或8000U促进排卵。次日经阴道超声引导下取卵,术后据患者经阴道超声及激素情况决定是否进行鲜胚移植术,鲜胚移植患者术后给予黄体酮支持治疗。
5.AMH检测及基础性激素检测:使用Access 2贝克曼全自动免疫分析仪(美国Beckman-Coulter公司,规格型号:81600N)检测AMH水平及血清性激素指标。
6.观察指标:观察并比较患者的基本资料,包括年龄、不孕年限、空腹血糖浓度(fasting blood sugar, FBS)、体重指数(bady mass index, BMI)、基础促卵泡生成素(follicle stimulating hormone,FSH)、基础黄体生成素(luteinizing hormone,LH)、基础睾酮(testosterone,T)、不孕类型、促排方案。观察并比较患者的实验室指标,包括优势卵泡数、获卵数、成熟卵数、2PN卵数、受精数、D3卵裂数、优胚数、胚胎总数、可利用胚胎数;计算获卵率、成熟卵率、2PN率、受精率、D3卵裂率、优胚率。指标计算方法:获卵率(%)=获卵数/优势卵泡数×100%;成熟卵率(%)=成熟卵数/获卵数×100%;2PN率(%)=2PN数/获卵数×100%;受精率(%)=受精数/获卵数×100%;D3卵裂率(%)=D3卵裂数/受精数×100%;优胚率(%)=优胚数/2PN数×100%。

结 果
1.PCOM组与PCOS组一般资料比较:PCOM组与PCOS组在基础T方面比较,差异有统计学意义(P<0.01),其余指标比较,差异均无统计学意义(P>0.05,表1)。

表1 PCOM组和PCOS组一般资料比较
2.对照组、PCOM组与PCOS组血清AMH的比较:对照组、PCOM组、PCOS组血清AMH水平两两比较,差异有统计学意义(P<0.01,图1)。

图1 对照组、PCOM组及PCOS组血清AMH水平比较
3.PCOM组与PCOS人群血清正常AMH组与高AMH组一般资料比较:PCOM组与PCOS人群正常AMH组与高AMH组一般资料比较,差异均无统计学意义(P>0.05,表2)。

表2 PCOM与PCOS人群血清正常AMH组与高AMH组一般资料比较
4.PCOM与PCOS人群血清正常AMH组与高AMH组实验室指标比较:PCOM人群中正常AMH组与高AMH组在成熟卵数、2PN数、受精数、D3卵裂数、胚胎总数方面比较,差异均有统计学意义(P<0.05);PCOS人群中正常AMH组与高AMH组在优势卵泡数、获卵数、成熟卵数、2PN数、受精数、D3卵裂数、优胚数、胚胎总数、可利用胚胎数方面比较,差异均有统计学意义(P<0.05,表3)。

表3 PCOM与PCOS人群血清正常AMH组与高AMH组实验室指标比较
5. PCOM及PCOS人群血清AMH水平与卵母细胞指标的相关性分析:PCOM人群血清AMH水平与成熟卵数、2PN数、受精数、D3卵裂数、胚胎总数均呈正相关(P<0.05);PCOS人群血清AMH水平与优势卵泡数、获卵数、成熟卵数、2PN数、受精数、D3卵裂数、优胚数、胚胎总数、可利用胚胎数均呈正相关(P<0.05,表4)。
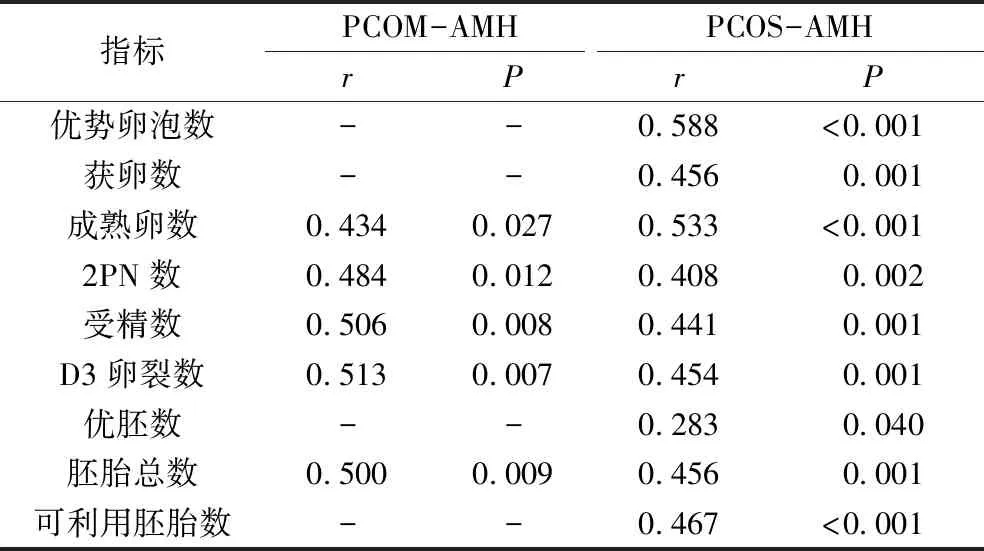
表4 PCOM及PCOS人群血清AMH水平与卵母细胞指标的相关性分析
讨 论
既往研究认为,PCOM是卵巢形态的正常变异,而近年发现PCOM不孕症患者已出现卵泡期延长、小卵泡排卵、卵泡未破裂黄素化等症状,亦有部分患者属PCOM合并不孕症[14]。诸多研究将PCOM单独分组,Emanuel等[3]研究表明,PCOM颗粒细胞存在异常,Uk等[15]研究认为PCOM是不同于PCOS的独特表型。现ART愈发应用于PCOM及PCOS不孕症患者,ART中精确评估卵巢功能与卵母细胞发育情况成为获得满意妊娠结局的关键,因此探究PCOM卵母细胞的发育情况尤为重要,可在早期对ART助孕结局发挥预测作用。AMH在月经周期中波动最小,可以更好地评估PCOM患者的临床特征,但AMH对于PCOM患者卵母细胞的影响未见报道[16,17]。本研究全面纳入卵母细胞发育相关指标,探讨了PCOM与PCOS人群中正常AMH水平与高AMH水平对卵母细胞发育的影响。
一般资料比较发现,PCOS组血清基础雄激素较PCOM组显着升高,这与Ozay等[18]的研究发现相同,原因是PCOS组存在高雄激素血症。AMH值比较发现,对照组 PCOM和PCOS人群不同AMH水平分组一般资料比较,差异无统计学意义。实验室指标显示,PCOM及PCOS人群中高AMH组较正常AMH组有更多成熟卵数、2PN数、受精数、D3卵裂数及胚胎总数,且血清AMH水平与成熟卵数、2PN数、受精数、D3卵裂数、胚胎总数均呈正相关,这与Nikbakht等[2]的研究结论不同。本研究提示,AMH水平与PCOM患者卵母细胞质量及胚胎数量密切相关,较高的AMH水平提示较好的卵巢储备功能,PCOM及PCOS人群AMH水平越高,成熟卵数及可利用卵数越多,正常受精的卵母细胞越多,胚胎数目就越多[21]。对于临床中高AMH水平的PCOM患者可减少反复移植失败后再次取卵次数,增加移植机会,节约治疗成本的同时有利于患者获得更好的生殖结局。 本研究显示,PCOS人群卵母细胞指标中优势卵泡数、获卵数、优胚数及可利用胚胎数与AMH呈正相关,但PCOM人群中未发现此现象,提示AMH对于PCOM患者卵母细胞数量及优质胚胎无明显影响。尽管PCOM人群高AMH组中优势卵泡数与获卵数较正常AMH组呈增高趋势,但差异无统计学意义,因此临床中因获卵数过多而发生卵巢过度刺激综合征的概率可能较PCOS低,这符合PCOM超声表现中卵巢体积略逊于PCOS的报道,可能与PCOS患者更为复杂的生殖内分泌紊乱及代谢异常相关[22~25]。另外本研究样本量相对较小且为单中心调查,也可能是产生差异的原因,未来有望在多中心的大样本量研究中予以进一步证实。 综上所述,PCOM患者血清AMH水平对卵母细胞质量及胚胎数量有指示作用,AMH水平较高的PCOM人群在ART过程中可能拥有质量更佳的卵母细胞,形成数量较多的胚胎。 利益冲突声明:所有作者均声明不存在利益冲突。



