王娉婷 佟雪璐 陈新梅
目前约有18种基质金属蛋白酶(matrix metalloproteinases,MMPs)家族成员可以在正常牙髓组织中检测到[1]。有研究发现,在炎症牙髓组织中,明胶酶MMP-9的水平有所增高[2],提示其作为降解细胞外基质的主要酶系,可能在牙髓炎症过程中发挥着重要作用[3]。而其产生作用的具体途径和机制目前尚不明确。由于细胞因子是MMPs酶原合成阶段最主要的调节因素,而其中的白细胞介素(interleukin,IL)-1是牙髓炎症过程中最关键的介质之一[4]。本研究利用免疫组化技术和明胶酶谱分析检测经IL-1β刺激的人牙髓成纤维细胞中MMP-9的表达和活性,初步探索在牙髓组织中IL-1β对MMP-9的合成和分泌的影响,为进一步研究MMPs在牙髓炎症中的作用机制奠定基础。
1 材料与方法
1.1 细胞培养及接种 收集2006年4月—6月在四川大学华西口腔医院因正畸原因完整拔除的健康前磨牙12颗,患者年龄18~25岁,无全身系统性疾病及关节炎病史。按以下方法培养原代牙髓成纤维细胞:75%乙醇擦拭拔除牙表面,用青、链霉素双抗液浸洗,于超净工作台(苏州净化设备有限公司)上劈开牙齿,取出牙髓,并剪掉根尖端1/3部分。将牙髓组织剪成1~2 mm3大小组织块,移入离心管中,加入3 g/LⅠ型胶原酶(Sigma-Aldrich公司,美国)约3 mL,37℃摇床消化45~50 min后,1 000 r/min离心10 min,弃上清,沉淀中加入含有20%胎牛血清(Hyclone公司,美国)的高糖DMEM培养基(Gibco公司,美国)重新悬浮沉淀,接种至培养瓶,置于37℃、5%CO2培养箱(SANYO-Mco17AIC,日本)静置培养。取12例样本源中细胞生长最为旺盛者用于传代培养,传代培养方法如下:待原代细胞贴壁后,隔日半量换液;细胞汇合后,采用胰蛋白酶消化法收集细胞,按1∶2传代。选取生长良好的4~8代细胞,胰蛋白酶消化,镜下计数,调整细胞密度为1×104/孔,接种于预先放置载玻片的6孔板中,置于培养箱中备用。
1.2 免疫组化实验 6孔板中每个孔内的牙髓成纤维细胞为一个样本,设实验组和对照组各20个样本。实验组待细胞汇合至80%后,换为无血清培养基,同时加入IL-1β(PeproTech EC公司,英国),使其终浓度为10 μg/L,继续孵育48 h后,多聚甲醛固定待检;对照组更换培养基时不加入IL-1β,其余操作同实验组。将2组样本采用链霉素抗生素蛋白-过氧化酶免疫组化法(streptavidin peroxdase conjugated method,SP)处理:固定后的样本滴加5%牛血清白蛋白(BSA)封闭液,室温静置20 min并去除多余液体后,滴加1∶150倍稀释的兔抗人MMP-9单克隆抗体(武汉博士德生物工程有限公司),4℃下反应过夜后用PBS清洗。滴加生物素化山羊抗兔IgG,37℃下反应30 min后用PBS清洗。滴加辣根过氧化物酶标记的链霉卵白素,反应30 min后用PBS清洗。3-氨基-9-乙基咔唑(AEC)显色、苏木素复染、明胶甘油封片后在倒置相差显微镜(Olympus公司,日本)下观察。用乳腺癌阳性片作阳性对照,用PBS代替第一抗体作阴性对照,MMP-9染色阳性细胞为胞质内出现红色颗粒,无着色即为阴性。每张细胞爬片显微镜下随机读取5个视野(×200),分别观察实验组和对照组中阳性细胞的比例,参考Nagel等[5]的方法进行分类:无阳性细胞为阴性,染色阳性细胞数<10%为弱阳性,10%~50%为中等阳性,>50%为强阳性。分别计数2组的分布频数。
1.3 明胶酶谱实验 与免疫组化实验相同,6孔板中每个孔内的牙髓成纤维细胞为一个样本,设实验组和对照组各20个样本,分别对实验组和对照组进行如下处理:实验组待细胞汇合至80%后,换为含10%血清的培养基同时加入终浓度为10 μg/L的IL-1β,每隔48 h更换培养基以及IL-1β,分别收集第2、4、6、8、10天的细胞培养上清液于微量离心(EP)管中,-80℃保存待检;对照组更换培养基时,不加入IL-1β,其余操作同实验组。配制8%分离胶和3.9%浓缩胶,以20 μL样品上样,以经蛋白变性后的低分子质量蛋白标准品(华美生物工程公司)为阳性对照,该标准品含兔碳酸酐酶、牛血清白蛋白、兔肌动蛋白、牛碳酸酐酶、胰蛋白酶抑制剂、鸡蛋清溶菌酶,分别表达为相对分子质量97 400,66 200,43 000,31 000,20 100,14400的6条条带;以上样缓冲液为阴性对照。在垂直电泳槽和电泳仪(Bio-Rad公司,美国)上以80 V、20 mA电泳30 min后,改为150 V,20 mA,电泳80 min。取出胶体置于2.5%Triton X-100(华美生物工程公司)洗脱液中震荡30 min,重复2次。加入明胶缓冲液,37℃孵育48 h。考马斯亮兰染色4 h,脱色,至出现明显清晰的负染酶带。用蒸馏水漂洗后观察,通过计算机扫描图像,Image-Pro Plus 6.0软件测量累积光密度值(integrated optical density,IOD)。
1.4 统计学处理 应用SPSS 12.0统计软件包进行分析。对免疫组化实验结果,采用小样本计数资料检验方法Mann-Whitney秩和检验比较实验组与对照组的差异;对正态分布的计量资料以±s表示,并对每个观测时间点的2组IOD值之间的差异采用t检验进行比较。检验水准为双侧α=0.05。
2 结果
2.1 免疫组化结果 倒置相差显微镜下可见,在对照组人牙髓成纤维细胞中,大部分样本中MMP-9的表达为阴性,见图1,或者阳性细胞数<10%,仅个别样本阳性细胞数为10%~50%。MMP-9染色阳性颗粒零散分布于细胞胞浆中,未见阳性细胞数>50%的样本。实验组的人牙髓成纤维细胞中,染色阳性颗粒主要分布于细胞胞浆中,少量分布于细胞外基质中,见图2。MMP-9阳性表达率明显高于对照组,差异有统计学意义(P<0.01),见表1。

Table 1 Results of immunohistochemistry between two groups表1 免疫组化法检测结果 (n=20,例)
2.2 明胶酶谱分析 对照组和实验组中均可检测到MMP-9的酶原形式(分子质量92 ku),而并未检测到活化形式的MMP-9(分子质量83 ku),见图3、4。上清液中MMP-9表达对照组及实验组IOD值随培养时间的推移变化均不明显,在所观测的5个时间点,实验组细胞MMP-9表达的IOD值均高于对照组,差异有统计学意义(均P<0.01)。
3 讨论
在生理状态下,牙髓中MMPs的水平较低,其与基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinases,TIMPs)的平衡维持着牙髓组织的健康,而在炎症牙髓组织中,一些MMPs的水平有所增高,其与TIMPs的平衡被打破,造成牙髓组织细胞外基质的降解,尤其是胶原的降解。MMP-9即为炎症牙髓中表达水平升高的MMPs之一,其主要定位在成牙本质细胞及牙髓成纤维细胞的胞浆中,且在某种程度上与牙髓炎患者的主观症状相关,提示MMP-9可能在牙髓炎症过程中发挥着重要作用,而目前对其作用机制和途径尚不十分清楚。
Table 2 IOD values of gelatin zymogram of MMP-9 level in human pulp fibroblasts表2 人牙髓成纤维细胞中MMP-9水平的明胶酶谱IOD值 (n=20,×103,±s)

Table 2 IOD values of gelatin zymogram of MMP-9 level in human pulp fibroblasts表2 人牙髓成纤维细胞中MMP-9水平的明胶酶谱IOD值 (n=20,×103,±s)
**P<0.01
组别对照组实验组t第2天15.42±1.63 18.26±1.80 5.230**第4天15.53±1.71 18.67±1.35 6.448**第6天15.47±1.59 22.34±1.51 14.020**第8天15.65±1.77 23.17±1.53 14.379**第10天15.63±1.34 23.88±1.62 17.553**
欲对MMP-9在牙髓炎症中的作用机制及途径进行深入探讨,则需通过体外的细胞学实验来完成。本研究即从MMPs酶原合成阶段最主要的调节因素细胞因子入手,检验牙髓炎中最重要的介质IL-1对体外培养的人牙髓成纤维细胞中MMP-9表达的影响,并对其在体外细胞系中的表达定位情况进行观察。
本研究采用SP法检测体外培养的人牙髓成纤维细胞中MMP-9的表达,结果显示对照组人牙髓成纤维细胞中,大部分样本MMP-9的表达呈阴性,仅少数样本中可见散在的免疫组化染色阳性颗粒,证实在生理状态下MMP-9的表达量极少,可能仅以酶原形式少量存在于细胞胞浆中。而经IL-1β刺激后的实验组人牙髓成纤维细胞中MMP-9的表达显着增高,染色阳性颗粒主要分布于细胞胞浆中,少量分布于细胞外基质中,这符合MMPs作为胞外酶的生物学特性,它主要在细胞内合成并分泌至细胞外发挥作用,而IL-1β能够使人牙髓成纤维细胞合成和分泌至细胞外的MMP-9的量增多,这与其他学者的研究结果相符[6]。
明胶酶谱法是测定明胶酶(MMP-2、-9)表达和活性常用的方法,其专一性强、操作简便、适用范围广,被广泛用于MMPs的活性测定。本实验中其作为免疫组化定性分析的进一步补充。结果显示,对照组人牙髓成纤维细胞中,MMP-9的表达量较低,条带模糊不清,随培养时间的变化不明显,实验组与对照组MMP-9表达水平的差异虽然具有统计学意义,但IOD值相差并不悬殊,表明MMP-9在牙髓成纤维细胞中的表达总量较低。加之MMP-9缺乏降解Ⅰ型和Ⅲ型胶原的能力,故可以认为MMP-9在牙髓炎症基质降解中可能仅起辅助作用。
明胶酶是以酶原形式分泌的,其活性中心位于催化结构域,在某些激活剂的作用下,前肽区水解或变构,使酶的活性中心暴露,从而使MMPs激活,只有活化后的MMPs才具有降解基质蛋白的功能[7]。本实验明胶酶谱分析仅检测到MMP-9酶原形式,推测其原因可能是由于样本中活性酶的含量较少,不易检测到。这提示IL-1β可能仅调节MMPs的合成和分泌,并未参与MMPs的激活,但这还缺乏有力证据。近年来的研究显示,IL-1β对MMPs的作用可能是通过刺激原癌基因产物C-Fos的表达来实现的,C-Fos作为转化激活因子与MMPs基因的启动区活化蛋白-1(Activator Protein-1,AP-1)结合位点相结合,促进其基因转录[8],进而促进人牙髓成纤维细胞中MMPs的合成和分泌。其中的具体作用机制仍有待进一步研究。
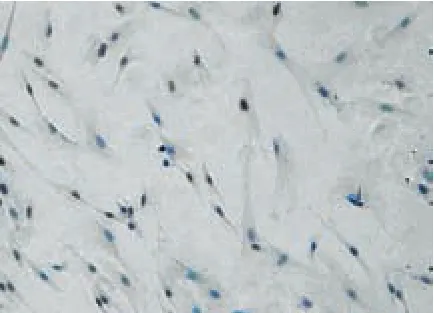
Figure 1 Expression of MMP-9 in control group(by inverted phase contrast microscope×200)图1 对照组MMP-9的表达(倒置相差显微镜×200)
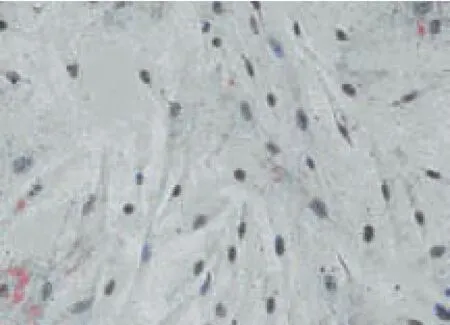
Figure 2 Expression of MMP-9 in experimental group(by inverted phase contrast microscope×200)图2 实验组MMP-9的表达(倒置相差显微镜×200)

Figure 3 Gelatin zymogram of control group图3 对照组明胶酶谱

Figure 4 Gelatin zymogram of experimental group图4 实验组明胶酶谱
[1]Palosaari H,Pennington CJ,Larmas M,et al.Expression profile of matrix metalloproteinases(MMPs)and tissue inhibitors of MMPs in mature human odontoblasts and pulp tissue[J].Eur J Oral Sci,2003,111(2):117-127.
[2]Tsai CH,Chen YJ,Huang FM,et al.The upregulation of matrix metalloproteinase-9 in inflamed human dental pulps[J].J Endod,2005,31(12):860-862.
[3]Zehnder M,Wegehaupt FJ,Attin T.A first study on the usefulness of matrix metalloproteinase 9 from dentinal fluid to indicate pulp inflammation[J].J Endod,2011,37(1):17-20.
[4]Silva AC,Faria MR,Fontes A,et al.Interleukin-1 beta and interleukin-8 in healthy and inflamed dental pulps[J].J Appl Oral Sci,2009,17(5):527-532.
[5]Nagel H,Laskawi R,Wahlers A,et al.Expression of matrix metalloproteinases MMP-2,MMP-9 and their tissue inhibitors TIMP-1,-2,and-3 in benign and malignant tumours of the salivary gland[J].Histopathology,2004,44(3):222-231.
[6]Wisithphrom K,Murray PE,Windsor LJ.Interleukin-1 alpha alters the expression of matrix metalloproteinases and collagen degradation by pulp fibroblasts[J].J Endod,2006,32(3):186-192.
[7]Hadler-olsen E,Fadnes B,Sylte I,et al.Regulation of matrix metalloproteinase activity in health and disease[J].FEBS J,2011,278(1):28-45.
[8]Lombard C,Saulnier J,Wallach J.Assays of matrix metalloproteinases(MMPs)activities:a review[J].Biochimie,2005,87(3-4):265-272.



