冯悦华 罗光华△ 陈立新
高胰岛素-正血糖钳夹技术(HEC)是评价胰岛素敏感性的金标准[1-2]。国内关于此技术应用于实验动物(大鼠)的报道目前为止大多可分两类,一类是在术后麻醉状态下进行,或者是术后第2天清醒状态下进行,但麻醉或术后造成的胰岛素抵抗影响极大[3];另一类研究的比较多,是给大鼠尾动静脉插管而行替代实验,避免大范围损伤但需长期维持局部麻醉,目前未被国际广泛认可。本研究根据国外文献报道结合实际操作方法建立了大鼠清醒状态下的HEC技术,并且通过给正常大鼠短期输注脂肪乳,初步建立脂毒性胰岛素抵抗模型,从而为研究脂毒性胰岛素抵抗提供客观依据。
1 材料与方法
1.1 实验动物准备 选用250~300 g的SPF级雄性SD大鼠10只,购置并饲养在中国科学院上海实验动物中心,条件:12 h明暗交替,室温22~25℃,湿度40%~70%。动物购入后适应性喂养1周,期间饲以基础饲料,自由摄食饮水。
在正式开始钳夹实验7 d前,10%水合氯醛麻醉大鼠,行左颈动脉-右颈静脉插管术。在无菌状态下切开颈部皮肤,钝性分离皮下组织和肌肉,暴露右侧颈静脉和左侧颈动脉。硅胶管2根(内径0.5 mm),经50 IU/mL肝素化处理,分别植入颈动、静脉。静脉导管置于右心房水平,动脉导管置于主动脉弓水平,2根导管均经皮下隧道延至颈背部引出,见图1。导管用生理盐水(含50 IU/mL的肝素)冲洗,最后用500 IU肝素和300 g/L的PVP-10聚乙烯吡咯烷黏稠溶液封管。术后单笼饲养。大鼠术后恢复1周,待体质量恢复、活动如初时进行清醒状态下脂肪乳输注和HEC实验,见图2。
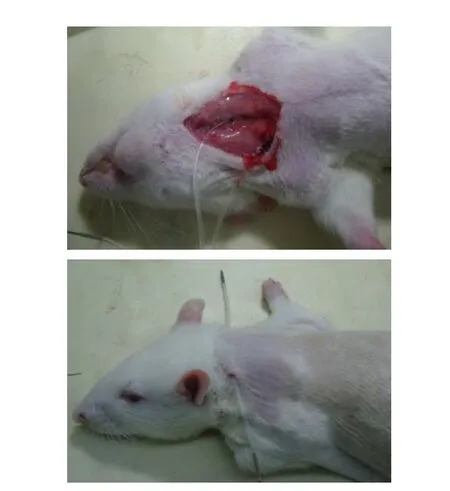
Figure 1 Rats with catheterizing in the right jugular vein and left carotid artery图1 大鼠左颈动脉及右颈静脉置管图
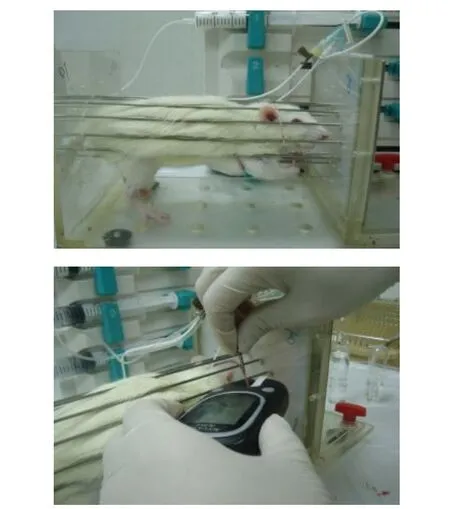
Figure 2 The experimental figure of fat emulsion infusion and hyperinsulinemic-euglycemic clamp in rats图2 大鼠脂肪乳输注和高胰岛素-正常血糖钳夹实验图
1.2 大鼠脂肪乳输注合并HEC实验 大鼠隔夜禁食12 h,以随机数字表法分为2组,每组5只。对照组颈内输注5%葡萄糖加肝素钠(葡萄糖购于华裕制药有限公司,肝素钠购于常州千红生化制药股份有限公司),脂肪乳组颈内输注20%脂肪乳加肝素钠(20%脂肪乳购于华瑞制药有限公司)。
2组大鼠分别从颈动脉抽取血液,罗氏罗康全活力血糖仪测定基础血糖(BBG)。然后分别通过颈静脉持续输注20%脂肪乳加肝素和5%葡萄糖加肝素6 h,20%脂肪乳或5%葡萄糖输注率为10 mL·kg-1·h-1,合并肝素(速率为0.097 5 IU/min),并在最后90 min引入HEC实验。HEC实验开始后,在输注原液体的同时恒定输注胰岛素10 mU·kg-1·min-1,之后每5 min测定血糖1次。当血糖值低于5.0 mmol/L时开始输注20%葡萄糖(购于Amresco公司),调整葡萄糖输注速率使血糖控制在5.0~6.0 mmol/L左右。取稳定状态及以后的血糖值的均数为稳定血糖浓度(SBG)。记录稳态下连续3~5次葡萄糖输注速率,其均值即为此大鼠的葡萄糖输注率(Glucose infusion rate,GIR)[1]。实验结束后将大鼠处死,取肝组织冻于液氮中备用。
1.3 统计学方法 采用GraphPad Prism 5.0统计软件对数据进行处理,实验数据以均数±标准差(x±s)表示,2组间的比较采用t检验,Plt;0.05为差异有统计学意义。
2 结果
2.1 各组稳定血糖浓度比较 2组间BBG和SBG波动在6.30 mmol/L和5.55 mmol/L左右,差异无统计学意义(Pgt;0.05),见表1。
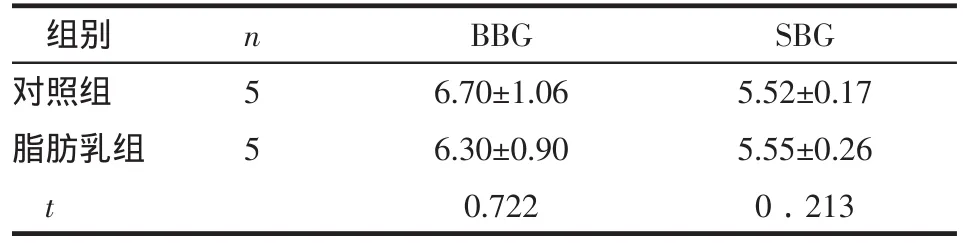
Table 1 Comparison of basal glucose and SBG data between two groups表1 2组初始血糖和稳定血糖浓度比较 (mmol/L,x±s)
2.2 脂肪乳输注对血浆FFA、GIR影响 大鼠输注20%脂肪乳6 h后,血浆FFA水平升高到对照组(输注5%葡萄糖)的17.6倍(t=11.20,Plt;0.01),见图3,GIR下降了27%(t=3.987,Plt;0.01),见图4。
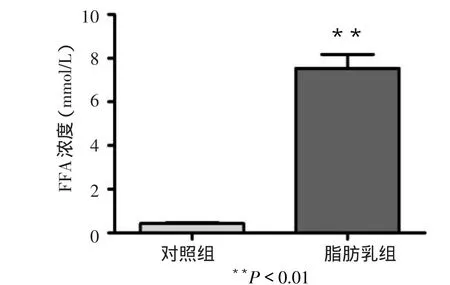
Figure 3 Effects of intralipid-infusin on plasma FFA in rats图3 脂肪乳输注对大鼠血浆FFA的影响
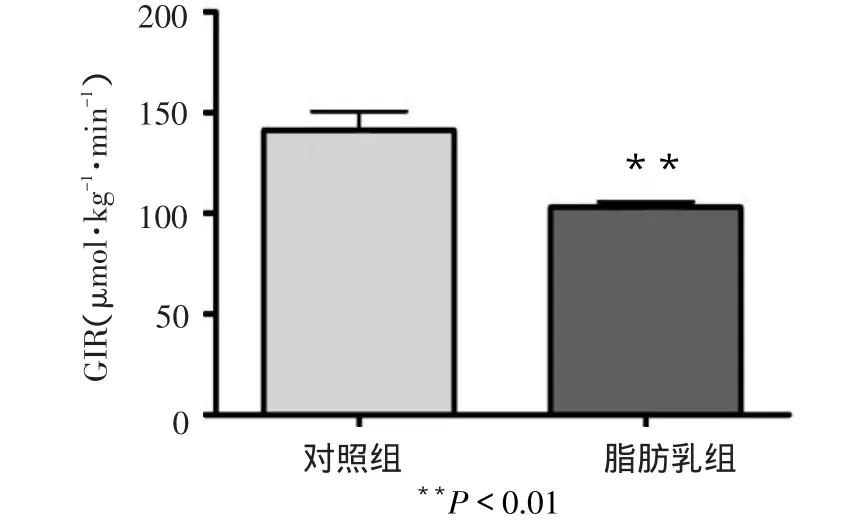
Figure 4 Effects of intralipid-infusin on GIR in rats图4 脂肪乳输注对大鼠GIR的影响
3 讨论
自1983年Kraegen等[4]建立大鼠高胰岛素-正血糖钳夹技术以来,国外已经广泛使用,成为研究胰岛素抵抗的基本技术之一。但在国内未能普遍使用,原因主要是传统的HEC技术需要在大鼠体内留置导管1周以避免术后应激,虽然结果准确可靠,但是术后感染、大鼠咬断导管,尤其是导管堵塞等问题常导致整个实验失败。也有人用麻醉状态下颈动静脉或者股动静脉插管术进行钳夹实验,但麻醉状态下血糖浓度显着升高,大脑及骨骼肌糖利用减少,胰岛素拮抗激素分泌增加,本身存在胰岛素抵抗[5],不能真实反映大鼠体内实际情况,所以必须保证大鼠在清醒状态下施行HEC技术。针对上述问题,本研究尝试将传统方法进行完善:一是手术操作中对组织的损伤尽可能减小,穿刺时尽量避开肉眼可见血管,以防颈部出血压迫窒息;二是改变封管的方法,用500 IU肝素和300 g/L的PVP-10聚乙烯吡咯烷黏稠溶液封管1周后再通的概率能提高70%~80%。两方面联合改进,降低了实验成本,增强了实验数据稳定性。因此,本改进方法具有一定可行性和可靠性。胰岛素抵抗是2型糖尿病的特征,研究表明血浆FFA浓度增加在胰岛素抵抗的发病机制中起着重要的作用[6]。国内多采用高脂喂养方式制备脂毒性大鼠胰岛素抵抗模型,但长期高脂饮食可刺激大鼠代偿性分泌一些胃肠激素激活脂蛋白酯酶(LPS),从而减轻胰岛素抵抗[7]。不同于此种方法,笔者采用短期6 h输注脂肪乳使FFA升高,直接观察高FFA对大鼠胰岛素敏感性的影响,同时采用经典的HEC技术评价胰岛素抵抗。结果发现,大鼠输注20%脂肪乳6 h后,血浆FFA水平升高17.6倍,同时GIR下降了27%,成功复制了大鼠脂毒性胰岛素抵抗模型。此实验结果与之前通过输注脂肪乳从而建立胰岛素抵抗模型的数据基本一致[8]。
[1]Gan KX,Wang C,Chen JH,et al.Mitofusin-2 ameliorates high-fat diet-induced insulin resistance in liver of rats[J].World J Gastroen⁃terol,2013,19(10):1572-1581.
[2]Camacho RC,Zafian PT,Achanfuo-Yeboah J,et al.Pegylated Fgf21 rapidly normalizes insulin-stimulated glucose utilization in diet-induced insulin resistant mice[J].Eur J Pharmacol,2013,715(1-3):41-45.
[3]李玲.大鼠清醒和麻醉状态下胰岛素钳夹实验结果的比较[J].中国糖尿病杂志,2003,11(1):51-53.
[4]Kraegen EW,James DE,Bennett SP,et al.In vivo insulin sensitivi⁃ty in the rat determined by euglycemic clamp[J].Am J Physiol,1983,245(1):E1-7.
[5]罗四川,李启富,刘红梅.清醒状态大鼠高胰岛素一正常血糖钳夹术的建立及其意义[J].重庆医科大学学报,2004,29(3):334-336.
[6]Capurso C,Capurso A.From excess adiposity to insulin resistance:the role of free fatty acids[J].Vascul Pharmacol,2012,57(2-4):91-97.
[7]Calanna S,Urbano F,Piro S,et al.Elevated plasma glucose-depen⁃dent insulinotropic polypeptide associates with hyperinsulinemia in metabolic syndrome[J].Eur J Endocrinol,2012,166(5):917-922.
[8]Griffin ME,Marcucci MJ,Cline GW,et al.Free fatty acid-induced insulin resistance is associated with activation of protein kinase C theta and alterations in the insulin signaling cascade[J].Diabetes,1999,48(6):1270-1274.



