张益,罗竺欣,王袁,段自坤,李佳
中央内侧丘脑核中NMDA受体参与丙泊酚致意识消失的作用
张益1,2,罗竺欣2,王袁2,段自坤2,李佳2
目的探讨中央内侧丘脑核(CMT)中N-甲基-D-天门冬氨酸(NMDA)受体在全身麻醉意识消失中的作用。方法60只大鼠微注射模型随机均分为4组:NMDA10 mmol/L组、NMDA20 mmol/L组、NMDA40 mmol/L组及对照组(C组),丙泊酚麻醉后分别于前3组CMT内微量泵注10、20和40 mmol/L的NMDA以及等体积生理盐水(C组)。观察微注射后自主体动反应的发生率以及翻正反射恢复时间,并通过组织学对微注射位点进行定位。结果当注射位点在CMT中时,与C组相比,各浓度NMDA组大鼠麻醉后翻正反射恢复时间均明显缩短;其中NMDA20 mmol/L与40 mmol/L组恢复时间短于NMDA10 mmol/L组,且NMDA20 mmol/L与40 mmol/L组大鼠麻醉中自主体动的发生率显着高于C组(均P<0.05)。当注射部位在CMT外时,各浓度NMDA组翻正反射恢复时间均明显长于注射部位在CMT内者(P<0.05),而各组间比较自主体动发生率与翻正反射恢复时间均无明显差异(P>0.05)。结论CMT中的NMDA受体参与了丙泊酚所导致的全身麻醉效应。
麻醉药,全身;丘脑中央核;受体;N-甲基-D-天冬氨酸;二异丙酚;中央内侧丘脑;NMDA受体;意识消失;脑区微注射
丘脑皮质环路在睡眠与觉醒过程中发挥着至关重要的作用,其中的中线核群、板内核群等均属于非特异性的觉醒系统[1]。板内核群中的中央内侧丘脑核(central medial thalamus,CMT)含有多种神经递质受体,接受来自皮质下的多条投射,并发出纤维投射至广泛的皮质和皮质下脑区,是全身麻醉药作用的关键区域之一[2]。然而,对于CMT中哪种受体在全身麻醉导致意识消失的过程中发挥主要作用,目前尚无定论。谷氨酸(glutamate,Glu)是中央神经系统中重要的兴奋性神经递质,Glu受体是其作用靶点。在众多Glu受体中,以N-甲基-D-天门冬氨酸(N-methyl-D-aspartale,NMDA)受体与全身麻醉的关系最为紧密[3]。脑内NMDA受体分布广泛,在神经系统的发育以及功能维持中均发挥着关键的作用[4]。CMT中也含有大量NMDA受体,但其是否参与了全麻药致意识消失的作用,目前鲜见相关报道。本研究于CMT内注射特异性NMDA受体激动剂,观察其对丙泊酚全身麻醉作用的影响,探讨CMT中NMDA受体在全麻药导致意识消失中的作用。
1 材料与方法
1.1实验动物及分组健康成年雄性SPF级SD大鼠60只,250~350 g,购自第三军医大学实验动物中心,动物许可证号:SCXK(渝)2007-0005。常规饲养1周后开始实验,12 h白天/夜晚轮换人工光照,自由饮水、进食。按随机数字表法随机分为生理盐水对照组(C组)、NMDA10 mmol/L组、NMDA20 mmol/L组和NMDA40 mmol/L组,每组15只。
1.2主要试剂丙泊酚(阿斯利康公司,1%,国药准字H20030427);NMDA(SIGMA公司,美国)。
1.3方法
1.3.1动物模型建立参考文献[5]中的方法建立标准CMT微注射模型,戊巴比妥50 mg/kg腹腔注射麻醉后,将大鼠头部固定于脑立体定位仪上(Stoelting公司,美国),1%利多卡因皮下注射后切开头皮,分离组织暴露颅骨,按脑立体定位图谱确定CMT的位置,坐标为:前囟后3.1 mm,中线旁开1.7 mm并倾斜13°,深度4.5 mm。用颅骨钻钻开头骨,按坐标放置微注射套管至距中央丘脑0.2 mm处,并用牙科水泥固定。术后恢复1周开始正式实验。
1.3.2脑区微注射各组大鼠均放入透明实验箱内,以2%异氟醚麻醉,翻正反射消失后用24号静脉留置针置入大鼠尾静脉,取出大鼠头部套管管芯,将一根比套管长0.2 mm的注射针插入套管,另一端以延长管连接微量注射泵(RWD202,深圳瑞沃德公司)。然后停止异氟醚麻醉,吸入空气。待大鼠自主活动恢复后20 min,于尾静脉单次注射10 mg/kg丙泊酚,待翻正反射消失后1 min开始脑区微注射。NMDA10 mmol/L组、NMDA20 mmol/L组和NMDA40 mmol/L组分别泵入0.5 μL浓度为10、20、40 mmol/L的NMDA,C组泵入相同体积的生理盐水,泵注时间1 min。记录脑区微注射后短时间内自主体动的发生率和翻正反射完全恢复的时间。
1.3.3组织染色定位实验结束后,通过微注射导管,将0.1 μL 2%滂胺天蓝溶液以0.2 μL/min速率缓慢注入CMT中,留针2 min,使溶液完全被吸收。用剪刀剪开大鼠胸腔,充分暴露心脏,将灌流针从心尖插入主动脉,同时剪开右心耳,快速注入200 mL生理盐水,再缓慢注入4%多聚甲醛300 mL,持续2~3 h。随后断头,迅速取出脑组织,将标本放入10%福尔马林溶液中固定48 h后,浸泡于4℃20%蔗糖溶液中脱水直至沉底。截取含微注射进针处的脑组织,行冠状冰冻切片,厚25 μm,收集注射部位附近的切片进行中性红染色、制片,于光学显微镜下观察。
1.4统计学方法统计学分析采用SPSS 19.0软件,计量资料以表示,组间比较采用单因素方差分析,多重比较采用LSD-t法,相同浓度组内比较采用t检验,计数资料比较行Fisher确切概率法;P<0.05为差异有统计学意义。
2 结果
2.1组织学定位结果C组、NMDA10 mmol/L组、NMDA20 mmol/L组、NMDA40 mmol/L组微注射部位在CMT范围内的例数分别为:10(66.7%)、7(46.7%)、11(73.3%)和9(60.0%)例。15例发生自主体动,其中14例的微注射点位于CMT内,1例位于CMT外,见图1。
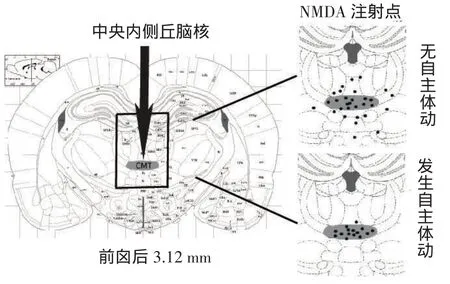
Fig.1Histological localizations of NMDA microinfusion tips图1 NMDA注射位点的组织学定位结果
2.2脑区微注射后自主体动反应的发生率与C组相比,CMT内微注射20、40 mmol/L NMDA可导致大鼠发生明显的自主体动反应(P<0.05);当药物注射于CMT外时,各浓度NMDA组的自主体动发生率与C组差异无统计学意义(P>0.05)。相同浓度组内微注射部位在CMT范围内和CMT范围外的自主体动发生率差异均无统计学意义,见表1。
2.3大鼠翻正反射恢复时间比较与C组相比,在CMT内注射NMDA后大鼠翻正反射恢复时间明显缩短(P<0.05),NMDA 20 mmol/L组与NMDA 40 mmol/L组的翻正反射恢复时间少于NMDA 10 mmol/L组,但NMDA 20 mmol/L组与NMDA 40 mmol/L组间差异无统计学意义(P>0.05);当NMDA注射在CMT外时,各组间的翻正反射恢复时间差异无统计学意义(P>0.05)。相同浓度组内比较:除C组外,各浓度NMDA组注射于CMT内的翻正反射恢复时间均短于注射于CMT外者(P<0.05),见表1。
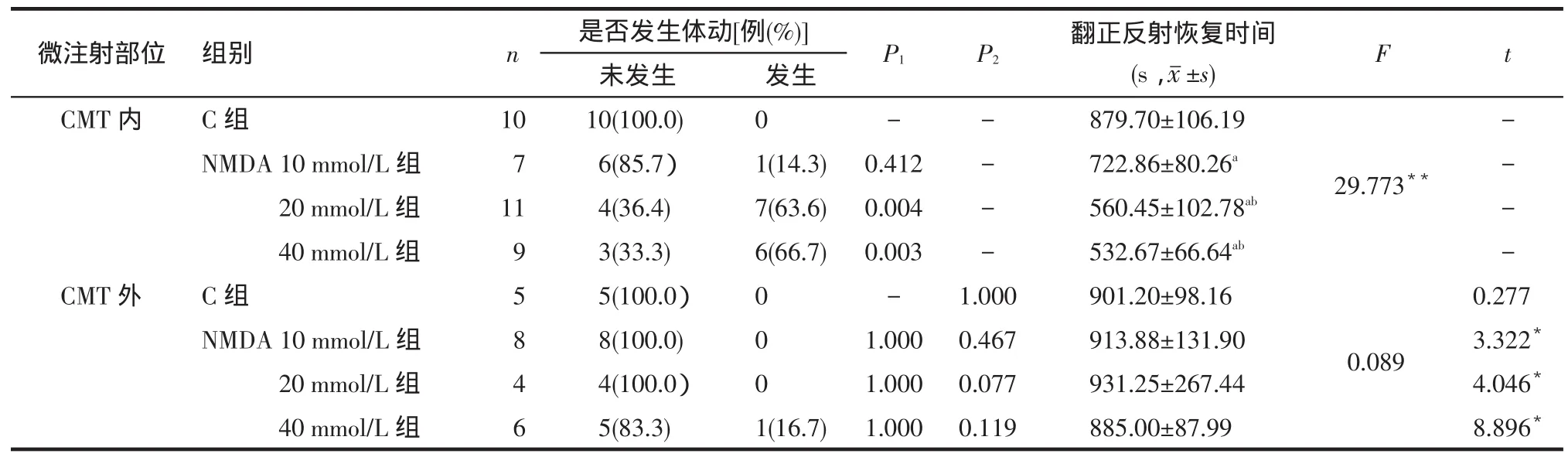
Tab.1The response time and recovery time after microinfusion in six groups表1 各组微注射后反应及翻正反射恢复时间
3 讨论
CMT属于丘脑非特异性投射系统,是中脑网状结构的延伸,在维持觉醒和全身麻醉的过程中均发挥着重要的作用[3,6]。研究显示,CMT中的N型乙酰胆碱受体[7]和Kv1家族钾通道[5]不同程度地参与了全身麻醉导致意识消失的过程。而关于CMT中NMDA受体与全身麻醉的关系,目前鲜见报道。从中脑网状结构至CMT的投射主要为谷氨酸能系统,丙泊酚可对NMDA受体激活后的电流产生可逆性的抑制,而对NMDA受体亲和力无明显影响[8];因此,在CMT中注射NMDA可在局部激活NMDA受体,逆转丙泊酚的抑制作用,从而维持觉醒系统的部分功能,而正是这部分功能在本实验中导致大鼠从全身麻醉中产生行为觉醒和自主运动。这一结果说明CMT中的NMDA受体至少参与了丙泊酚麻醉所导致的镇静和制动两个方面的麻醉效果。本研究结果还提示,20 mmol/L和40 mmol/L的NMDA对丙泊酚麻醉的催醒作用显着强于10 mmol/L的NMDA,说明其逆转效应具有一定的浓度依赖性。然而,NMDA 20 mmol/L和40 mmol/L两个浓度所产生的效应却没有明显差别,这主要是由于在20~40 mmol/L的浓度区间微注射范围内CMT的NMDA受体已经饱和,增加NMDA的量不会再引起效应的增强。
另一方面,NMDA的注射部位与其作用之间存在着密切的关系。本研究中15例发生自主体动大鼠的微注射位点有14例位于CMT内,而NMDA注射部位在CMT外时,大鼠发生自主体动的例数减少(差异无统计学意义可能主要是由于样本量少所致),同时对翻正反射恢复时间的缩短作用消失,进一步说明了CMT在全身麻醉作用中发挥效应部位的特异性。
综上所述,CMT中NMDA受体参与了丙泊酚所导致的全身麻醉效应。
[1]Van der Werf YD,Witter MP,Groenewegen HJ.The intralaminar and midline nuclei of the thalamus.Anatomical and functional evi⁃dence for participation in processes of arousal and awareness[J]. Brain Res Brain Res Rev,2002,39(2-3):107-140.
[2]Baker R,Gent TC,Yang Q,et al.Altered activity in the central me⁃dial thalamus precedes changes in the neocortex during transitions into both sleep and propofol anesthesia[J].J Neurosci,2014,34(40): 13326-13335.doi:10.1523/JNEUROSCI.1519-14.2014.
[3]Petrenko AB,Yamakura T,Sakimura K,et al.Defining the role of NMDA receptors in anesthesia:are we there yet[J]?Eur J Pharma⁃col,2014,723:29-37.doi:10.1016/j.ejphar.2013.11.039.
[4]Chen XJ,Li X.Anti⁃N⁃methyl⁃D⁃aspartate receptor encephalitis:a new autoimmune encephalitis[J].Chin J Contemp Neurol Neurosurg,2013,13(1):12-15.[陈向军,李翔.抗N⁃甲基⁃D⁃天冬氨酸受体脑炎:一种新型自身免疫性脑炎[J].中国现代神经疾病杂志,2013,13(1):12-15].
[5]Lioudyno MI,Birch AM,Tanaka BS,et al.Shaker-related potassi⁃um channels in the central medial nucleus of the thalamus are im⁃portant molecular targets for arousal suppression by volatile general anesthetics[J].J Neurosci,2013,33(41):16310-16322.doi:10.1523/ JNEUROSCI.0344-13.2013.
[6]Saper CB,Scammell TE,Lu J.Hypothalamic regulation of sleep and circadian rhythms[J].Nature,2005,437(7063):1257-1263.
[7]Alkire MT,McReynolds JR,Hahn EL,et al.Thalamic microinjec⁃tion of nicotine reverses sevoflurane-induced loss of righting reflex in the rat[J].Anesthesiology,2007,107(2):264-272.
[8]Zhou C,Liu J,Chen XD.General anesthesia mediated by effects on ion channels[J].World J Crit Care Med,2012,1(3):80-93.doi: 10.5492/wjccm.v1.i3.80.
(2015-02-02收稿 2015-03-10修回)
(本文编辑 闫娟)
NMDA receptors in central medial thalamus participate in propofol-induced unconsciousness
ZHANG Yi1,2,LUO Zhuxin2,WANG Yuan2,DUAN Zikun2,LI Jia2
1 Department of Anesthesiology,Affiliated Hospital of Zunyi Medical University,Guizhou 563000,China;2 Guizhou Key Laboratory of Anesthesia and Organ Protection,Zunyi Medical University
ObjectiveTo investigate the role of NMDA receptors in central medial thalamus(CMT)in the unconscious⁃ness induced by general anesthesia.MethodsA total of 60 rat models for microinfusion were assigned into 4 groups(n=15 for each group).After induction with propofol,10 mmol/L(NMDA10 group),20 mmol/L(NMDA 20 group)and 40 mmol/L(NMDA40 group)of NMDA and normal saline(group C)with equal volume were microinfused into CMT.The incidence of purposeful movement and recovery time of righting reflex were observed in each group respectively.Infusion sites were local⁃ized by histological method.ResultsWhen the microinfusion site localized within CMT,comparing with group C,the recov⁃ery time of righting reflex reduced notably in three NMDA groups(P<0.05).The recovery time was significantly shorter in NMDA20 group and NMDA40 group than that of NMDA10 group.The incidence of purposeful movement during propofol an⁃esthesia was higher in NMDA20 group and NMDA40 group than that of group C(P<0.05).When the microinfusion site lo⁃calized out of CMT,the recovery time of righting reflex was remarkably longer than that within CMT in three NMDA groups(P<0.05),and there was no significant difference in the incidence of purposeful movement and recovery time between four group(P>0.05).ConclusionMicroinfusion of NMDA agonist into CMT reverses propofol anesthesia,indicating that NMDA receptor in CMT may contribute to the propofol-induced unconsciousness.
anesthetics,general;midline thalamic nuclei;receptors;N-methyl-D-aspartate;propofol;central thala⁃mus;NMDA receptor;loss of consciousness;intracranial microinjection
R614.2
A
10.11958/j.issn.0253-9896.2015.07.010
贵州省教育厅项目(黔科合J字LKZ[2011]06号)
1贵州省遵义医学院附属医院麻醉科(邮编563000);2遵义医学院麻醉与器官保护基础研究重点实验室
张益(1983),男,主治医师,博士在读,主要从事全身麻醉机制研究



