朱辉,何明,陈新,李宝重,徐新建,李飞
PI-88对TE-13细胞及裸鼠移植瘤中乙酰肝素酶表达的影响
朱辉△,何明,陈新,李宝重,徐新建,李飞
目的探讨硫酸化寡聚多糖(PI-88)对食管鳞癌细胞株TE-13乙酰肝素酶(Hpa)表达的影响,以及对裸鼠人食管癌移植瘤生长、血管生成及Hpa蛋白表达的影响。方法体外培养TE-13细胞,实验分为A组(对照组)、B组(15 mg/L PI-88干预组)和C组(30 mg/L PI-88干预组)。培养36 h后Western blot检测各组细胞Hpa蛋白表达。选取10只BALB/c/nu裸鼠,皮下接种TE-13细胞建立食管癌裸鼠移植瘤模型,建模成功后随机均分为观察组及对照组。观察组腹腔注射PI-88 40 mg/(kg·d),对照组给予等剂量生理盐水,连续注射14 d。每2 d测量移植瘤体积,注射第14天处死动物,剥除移植瘤行CD34染色,检测微血管密度(MVD)。Western blot及免疫组化染色检测Hpa蛋白表达。结果与A组相比,B、C组细胞Hpa蛋白表达量明显降低(P<0.001),且存在药物浓度依赖性。观察组裸鼠移植瘤体积、MVD值、Hpa蛋白表达水平及阳性细胞数均低于对照组(均P<0.05)。结论PI-88可抑制TE-13细胞及食管癌裸鼠皮下移植瘤中Hpa表达,并抑制肿瘤生长和血管生成。
食管肿瘤;硫酸化寡聚多糖;TE-13细胞;乙酰肝素酶;印迹法,蛋白质;裸鼠;移植瘤;微血管密度;免疫组织化学
乙酰肝素酶(Heparanase,Hpa)是人体内唯一特异性降解细胞外基质中硫酸乙酰肝素多糖(HSPGs)的内糖苷酶,硫酸化寡聚糖混合物PI-88是Hpa的特异性靶向抑制剂。研究显示PI-88单独或联合化疗应用对晚期肝癌、前列腺癌等恶性肿瘤具有良好的治疗效果[1-3]。但关于PI-88在食管癌方面的研究尚鲜见报道。本研究拟应用不同浓度PI-88干预食管癌低分化鳞癌细胞TE-13,观察PI-88对食管癌细胞Hpa蛋白表达情况的影响。同时建立食管癌裸鼠皮下移植瘤模型,观察PI-88对肿瘤生长、血管新生及移植瘤中Hpa表达的影响。
1 材料与方法
1.1细胞及动物人低分化食管鳞癌细胞株TE-13由河北医科大学第四医院科研中心提供,用含10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的RPMI 1640培养基,5% CO2、37℃恒温培养。BALB/c/nu裸鼠10只,4~5周龄,体质量15~18 g,由中国医学科学院实验动物繁殖场提供,于SPF层流环境饲养。
1.2主要试剂PI-88由澳大利亚Progen制药有限公司惠赠(批号:P88RD0100)。RPMI1640细胞培养液购自Life Technologies公司,PVDF膜购自华美生物公司,CytoBuster蛋白裂解提取剂购自Novagen公司。Hpa、CD34等抗体均购自Santa Cruz公司,SP试剂盒购自北京中杉金桥生物技术公司。
1.3细胞培养及分组TE-13细胞常规培养于50 mL培养瓶中,接种浓度为1×106个/瓶。待细胞培养至贴壁后,分为A组(对照组),B组(15 mg/L PI-88干预组)和C组(30 mg/L PI-88干预组),每组设5个平行样本。PI-88以无菌生理盐水溶解至所需浓度,对照组加入等量生理盐水。
1.4Western blot检测细胞Hpa蛋白表达各组细胞分组处理后继续培养36 h,弃去培养液,以预冷的PBS漂洗2次,细胞刮集器收集细胞。加入600 μL CytoBuster蛋白裂解提取液,静置5 min,4℃、13 000 r/min离心10 min,取上清。BCA法测定蛋白浓度后每孔加40 μg蛋白行SDS-PAGE。电泳后湿转法4℃、90 V电泳3 h 50 min,将目的蛋白转移至PVDF膜上。5%脱脂奶粉室温封闭2 h,加入Hpa一抗(1∶100),4℃过夜,次日TBS-T洗膜3次;加入辣根过氧化物酶(HRP)标记的二抗(1∶1 000),37℃摇床作用1 h,加入化学发光底物,感光胶片显影,经凝胶成像分析系统扫描、成像。以β-actin为内参,结果以目的条带灰度值/内参条带灰度值表示,重复3次。
1.5裸鼠皮下移植瘤模型的建立取对数期TE-13细胞,0.25%胰蛋白酶消化后PBS调整浓度至5×107个/mL,于裸鼠左侧背部皮下接种0.2 mL,建立食管癌裸鼠皮下移植瘤模型。接种后第6天,所有裸鼠在接种部位长出肿瘤。模型建立后,10只裸鼠按随机数字表分为观察组和对照组,每组5只。观察组根据裸鼠体质量按照40 mg/kg自建模成功第1天起腹腔注射PI-88溶液(生理盐水溶解),每日1次。对照组给予等剂量生理盐水。于第1、3、5、7、9、11、13天用电子游标卡尺测量肿瘤的最长径与最短径,计算肿瘤体积V= 0.4 ab2,其中a为肿瘤最长径,b为与最长径相对垂直的肿瘤最短径,重复3次。于第14天统一处死裸鼠,剥离移植瘤用于后续检测。
1.6免疫组化法检测移植瘤微血管密度(MVD)及Hpa表达剥除的移植瘤于4%多聚甲醛固定12 h,常规石蜡包埋、切片,免疫组化染色步骤按照SP试剂盒说明书进行。一抗采用兔抗人CD34多克隆抗体(1∶200),二甲基联苯胺(DAB)显色,梯度乙醇脱水,二甲苯透明,中性树胶封片。先用100倍光镜扫视整个切片,寻找高血管密度区,然后在此区域内以400倍光镜随机取5个视野,计数棕黄色的微血管数目。Hpa免疫组化染色方法同上,阳性对照为试剂公司提供的强阳性标本切片,细胞胞浆或胞核出现棕黄色染色颗粒定为阳性,阴性对照采用PBS代替一抗,400倍光镜随机读取5个视野计数染色阳性细胞数目列入分析。
1.7Western blot检测裸鼠移植瘤Hpa表达取150 mg移植瘤组织,加入1 mL裂解液提取蛋白,BCA法测定蛋白浓度后,每孔80 μg蛋白用于Western blot检测。具体方法及结果判定同1.4。
1.8统计学方法采用SPSS 19.0统计软件进行分析,符合正态分布的计量资料数据以表示,2组均数比较采用t检验,多组间均数比较采用单因素方差分析,组间多重比较使用LSD-t法。不符合正态分布的数据以M(P25,P75)表示,组间比较Mann-Whitney U检验。检验水准α=0.05。
2 结果
2.13组细胞Hpa表达水平比较3组间Hpa蛋白表达水平比较差异有统计学意义(F=54.525,P<0.01)。与A组相比,B组、C组Hpa蛋白表达量均明显减少且存在剂量依赖性,见图1。
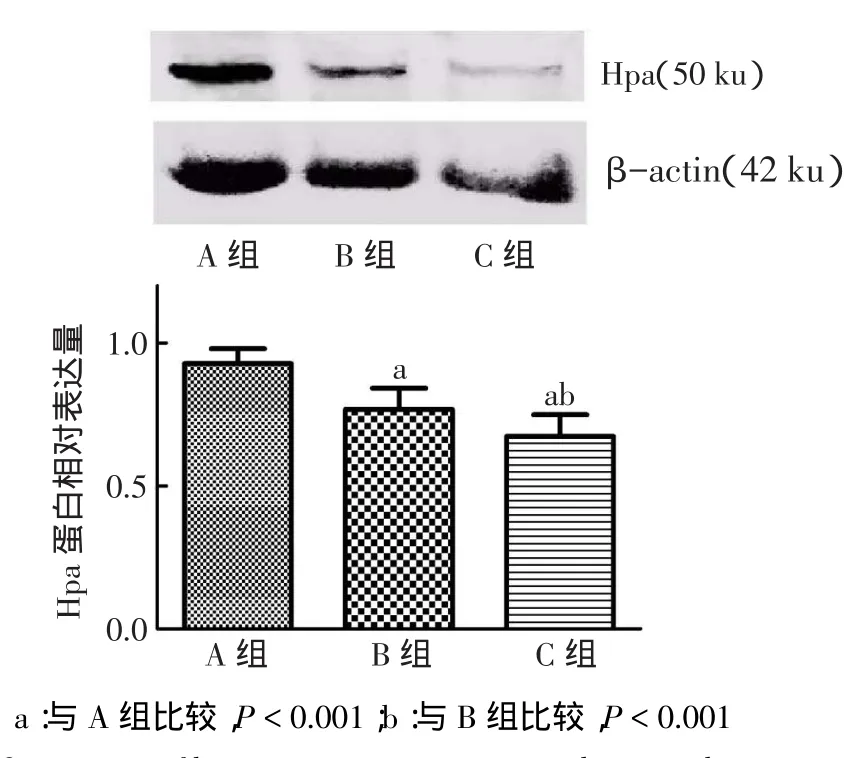
Fig.1Comparison of heparanse protein expression between three groups图1 3组细胞Hpa蛋白表达水平比较
2.22组裸鼠移植瘤体积及MVD比较注射PI-88第1天,2组移植瘤体积无明显差异。注射PI-88第13天,观察组移植瘤体积明显低于对照组(P<0.01),见表1。观察组移植瘤MVD[13.00(11.50,15.00)]低于对照组[17.00(15.00,18.50),Z=4.475,P<0.01]。
Tab.1Comparison of xenograft volume between control and observation groups表1 2组移植瘤体积变化比较(n=5,mm3,)
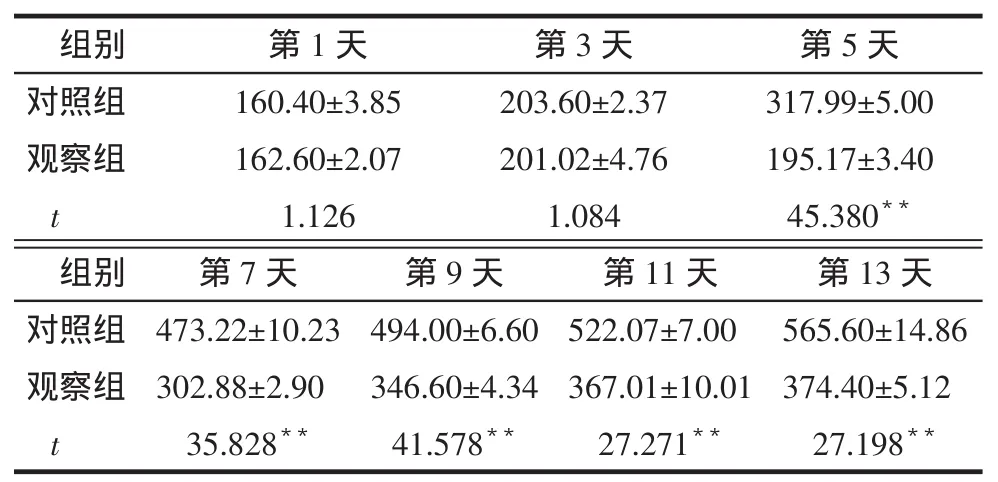
Tab.1Comparison of xenograft volume between control and observation groups表1 2组移植瘤体积变化比较(n=5,mm3,)
**P<0.01
组别对照组观察组t第1天160.40±3.85 162.60±2.07 1.126第3天203.60±2.37 201.02±4.76 1.084第5天317.99±5.00 195.17±3.40 45.380**第13天565.60±14.86 374.40±5.12 27.198**组别对照组观察组t第7天473.22±10.23 302.88±2.90 35.828**第9天494.00±6.60 346.60±4.34 41.578**第11天522.07±7.00 367.01±10.01 27.271**
2.3移植瘤Hpa蛋白表达及免疫组化结果与对照组相比,观察组Hpa蛋白表达量及Hpa阳性染色细胞数均降低,见表2,图2、3。

Tab.2Comparison of heparanse protein and positive cells between two groups表2 2组Hpa蛋白相对表达量及阳性细胞数比较
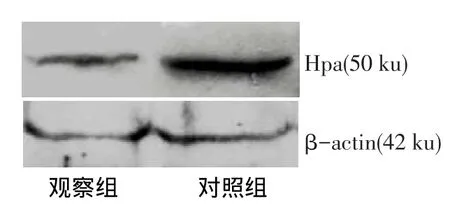
Fig.2The expression of heparanse protein in xenografts measured by Western blot assay图2 Western blot检测裸鼠移植瘤中Hpa蛋白表达
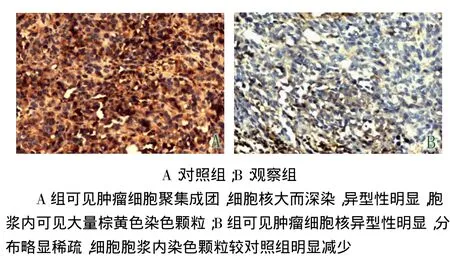
Fig.3The expression of heparanse protein in xenografts measured by immunohistochemical staining(SP,×200)图3 免疫组化染色检测移植瘤中Hpa表达(SP,×200)
3 讨论
Hpa的主要作用是特异性识别并降解细胞外基质中的HSPGs,HSPGs不仅是细胞外基质的重要组成成分,也是细胞外血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)等多种促血管生成因子的“存储仓库”。Hpa在细胞内以分子质量65 ku的酶前体形式存在,经修饰后转化为具有高度生物学活性的成熟酶,分子质量约为50 ku。研究证实,Hpa在子宫颈癌[4]、胃癌[5]、肝癌[6]、恶性黑色素瘤[7]以及乳腺癌[8]等多种恶性肿瘤中均呈高表达。Hpa在降解细胞外基质中的HSPGs的同时,释放了结合在HSPGs上的多种促血管生成因子,而这两个步骤为肿瘤外侵周围组织和远处转移所必须,可以认为,Hpa在肿瘤的外侵和转移过程中起到了关键的作用[9]。
目前,针对Hpa的抑制剂有硫酸化寡聚糖混合物、肝素及类肝素制剂、抗Hpa抗体及沉默Hpa RNA的基因制剂等。其中研究时间较早、临床较为成熟的是硫酸化寡聚糖混合物PI-88,其化学结构与HSPGs类似,可抑制Hpa对HSPGs的降解,降低Hpa的活性[10]。唐维强等[11]发现,PI-88可抑制视网膜色素上皮细胞内乙酰肝素酶的表达,并呈现剂量和时间依赖性。另有研究显示,在B16黑色素瘤小鼠模型中,PI-88及其类似物可明显降低肿瘤的生长速度[12]。Hu等[13]发现PI-88能明显抑制缺氧诱导的视网膜病变小鼠模型的血管生成,降低其VEGF和Hpa蛋白的表达。本研究显示,不同浓度的PI-88均明显抑制了食管癌细胞株TE-13的Hpa蛋白表达,并且随PI-88浓度的增高Hpa蛋白表达量明显下降。进一步动物实验发现,PI-88可抑制移植瘤中Hpa蛋白的表达,并且抑制移植瘤生长及瘤内微血管生成。部分结果与本课题组早期研究结果不同[14],考虑可能与所购抗体纯度、不同的蛋白检测方法、不同的给药途径和更高剂量的PI-88等因素有关。
肿瘤的发生发展高度依赖新生血管的形成,而且在多种肿瘤中存在VEGF、bFGF等促血管生长因子的高表达[15-17]。本研究发现观察组移植瘤MVD显着低于对照组,提示PI-88对食管癌裸鼠皮下移植瘤的血管新生具有一定的抑制作用。推测PI-88通过抑制Hpa蛋白表达,减少促血管生成因子的释放,造成移植瘤内血管化程度减低,从而使移植瘤的生长和外侵能力明显下降。
综上所述,PI-88对食管癌细胞中Hpa的表达存在一定的抑制作用,并且随剂量加大抑制作用增强,PI-88对人食管癌裸鼠移植瘤生长和血管新生存在一定程度的抑制作用。
[1]Liu CJ,Chang J,Lee PH,et al.Adjuvant heparanase inhibitor PI-88 therapy for hepatocellular carcinoma recurrence[J].World J Gas⁃troenterol,2014,20(32):11384-11393.doi:10.3748/wjg.v20. i32.11384.
[2]Huang TS,Shyu YC,Chen HY,et al.A systematic review and metaanalysis of adjuvant interferon therapy after curative treatment for patients with viral hepatitis-related hepatocellular carcinoma[J].J Viral Hepat,2013,20(10):729-743.doi:10.1111/jvh.12096.
[3]Khasraw M,Pavlakis N,McCowatt S,et al.Multicentre phase I/II study of PI-88,a heparanase inhibitor in combination with docetax⁃el in patients with metastatic castrate-resistant prostate cancer[J]. Ann Oncol,2010,21(6):1302-1307.doi:10.1093/annonc/mdp524.
[4]Zeng C,Chen L,Yang Z,et al.The close correlation between hepa⁃ranase and COX-2 expression in lymphangiogenesis of cervical can⁃cer[J].Med Oncol,2014,31(12):314.doi:10.1007/s12032-014-0314-z.
[5]Zhang X,Xu S,Tan Q,et al.High expression of heparanase-2 is an independent prognostic parameter for favorable survival in gastric cancer patients[J].Cancer Epidemiol,2013,37(6):1010-1013.doi: 10.1016/j.canep.2013.09.012.
[6]Wang Q,Shen Y,Wang P,et al.The expression of Heparan⁃ase mRNA and its clinical significance in Hepatocellular carcinoma[J].J Cancer Res Ther,2013,9(2):250-252.doi:10.4103/0973-1482.113377.
[7]Chen Y,Chen Y,Huang L,et al.Evaluation of heparanase and ma⁃trixmetalloproteinase-9 in patients with cutaneous malignant mela⁃noma[J].J Dermatol,2012,39(4):339-343.doi:10.1111/j.1346-8138.2011.01441.x.
[8]Zhang L,Ngo JA,Wetzel MD,et al.Heparanase mediates a novel mechanism in lapatinib-resistant brain metastatic breast cancer[J]. Neoplasia,2015,17(1):101-113.doi:10.1016/j.neo.2014.11.007.
[9]Vlodavsky I,Beckhove P,Lerner I,et al.Significance of Heparan⁃ase in Cancer and Inflammation[J].Cancer Microenviron,2012,5(2): 115-132.doi:10.1007/s12307-011-0082-7.
[10]Luo YY,Tian SJ.Research progress in heparanase inhibitors[J]. Morden Oncology,2014,22(11):2767-2770.[罗雅玥,田素娟.乙酰肝素酶抑制剂的研究进展[J].现代肿瘤医学,2014,22(11):2767-2770].doi:10.3969/j.issn.1672-4992.2014.11.79.
[11]Tang WQ,He SZ,Liang XM,et al.The preliminary study of Phos⁃phomannopentaose sulfate(PI-88)on the experimental choroidal neovascularization[J].Zhonghua Yan Ke Za Zhi,2008,44(9):813-819.[唐维强,何守志,梁晓明,等.硫代磷酸甘露醇戊糖防治实验性脉络膜新生血管的初步研究[J].中华眼科杂志,2008,44(9):813-819].doi:10.3321/j.issn:0412-4081.2008.09.010.
[12]Johnstone KD,Karoli T,Liu L,et al.Synthesis and biological evalu⁃ation of polysulfated oligosaccharide glycosides as inhibitors of an⁃giogenesis and tumor growth[J].J Med Chem,2010,53(4):1686-1699.doi:10.1021/jm901449m.
[13]Hu J,Song X,He YQ,et al.Heparanase and vascular endothelial growth factor expression is increased in hypoxia-induced retinal neovascularization[J].Invest Ophthalmol Vis Sci,2012,53(11): 6810-6817.doi:10.1167/iovs.11-9144.
[14]Zhu H,Wang SJ,Shan BE,et al.Inhibitory Effect of Heparanase In⁃hibitor on Growth and Angiogenesis of Xenograft Esophageal Squa⁃mous Cell Carcinoma in Nude Mice[J].Carcinogenesis,Terato gene⁃sis&Mutagenesis,2008,20(4):249-253.[朱辉,王士杰,单保恩,等.乙酰肝素酶抑制剂对裸鼠人食管鳞癌移植瘤的抑制作用[J].癌变·畸变·突变,2008,20(4):249-253].doi:10.3969/j.issn.1004-616X.2008.04.001.
[15]Zhang ZH,Liu P,Wang LH,et al.Effects of bFGF expression on the angiogenesis of a leukemia cell line transplanted in nude mice[J].Chin J Clin Oncol,2013,40(14):821-823.[张志华,刘鹏,王丽红,等.bFGF表达对裸鼠白血病移植瘤血管新生影响的研究[J].中国肿瘤临床,2013,40(14):821-823].doi:10.3969/j.issn.1000-8179.2013.14.002.
[16]Wróbel T,Mazur G,Dzietczenia J,et al.VEGF and bFGF gene poly⁃morphisms in Polish patients with B-CLL[J].Med Oncol,2013,30(1):456-460.doi:10.1007/s12032-013-0456-4.
[17]Du H,Shi H,Chen D,et al.Cross-talk between endothelial and tumor cells via basic fibroblast growth factor and vascular endothelial growth factor signaling promotes lung cancer growth and angiogenesis[J]. Oncol Lett,2015,9(3):1089-1094.doi:10.3892/ol.2015.2881.
(2015-01-29收稿 2015-03-23修回)
(本文编辑 胡小宁)
The influence of PI-88 on heparanase protein expression of human esophageal cancer cell and xenograft of nude mice
ZHU Hui△,HE Ming,CHEN Xin,LI Baozhong,XU Xinjian,LI Fei
Department of Thoracic Surgery,Fourth Hospital of Hebei Medical University,Shijiazhuang 050011,China△
ObjectiveTo explore the inhibitory effects of sulfated oligosaccharides PI-88 on the heparanase protein expression of human esophageal squamous cancer cell(ESCC)line TE-13,and to explore the effects of growth,angiogenesis and heparanase protein expression on ESCC xenografts of nude mice.MethodsTE-13 cells were cultured and divided into three groups:group A(control group),group B(15 mg/L PI-88)and group C(30 mg/L PI-88).Heparanase protein expression of TE-13 cells was measured by Western blot assay after being cultured for 36 h.The ESCC suspension was injected subcutaneously in 10 BALB/c/nu mice to build up ESCC xenograft model.The model mice were divided randomly into observation group and control group(5 mice per group).The mice in observation group received 40 mg/(kg·d)PI-88.The mice in control group only received the same volume of saline at the same time.Both PI-88 and saline were daily administrated for 14 days.Every 2 days,the volume of xeongrafts were measured and the mice were executed at the 14th day.CD34 immunohistochemical staining was used to detect the micro vessel density(MVD)of xenografts.Western blot assay and immunohistochemical staining were used to detect the heparanase protein expression of xenografts.ResultsThe heparanase protein expressions of TE-13 cells were significantly decreased in group B and group C than those of group A(P<0.001),with a kind of PI-88 dose-dependent manner. The volume,MVD and heparanase protein expression of xenografts were significantly lower in observation group than those of control group(P<0.05).ConclusionThe heparanase protein expression in TE-13 cells can be inhibited by PI-88 in vitro and vivo.Furthermore,the growth and angiogenesis of ESCC xenografts were also inhibited by PI-88.
esophageal neoplasms;PI-88;TE-13 cell;heparanase;blotting,western;mice,nude;heterografts;mi⁃crovessel density;immunohistochemistry
R735.1
A
10.11958/j.issn.0253-9896.2015.07.012
河北省卫生厅重点科研基金项目(20120130)
河北医科大学第四医院胸外科(邮编050011)
朱辉(1977),男,副教授,博士,主要从事胸部恶性肿瘤基础与临床研究
△通讯作者E-mail:zhdzuj@sina.com



