贾林,林智峰,马莉,唐玉玲,杨锐,杨晓萍
P38MAPK抑制剂SB203580对高糖诱导HK-2细胞转分化的影响
贾林,林智峰,马莉,唐玉玲,杨锐,杨晓萍
摘要:目的探讨不同浓度P38丝裂原活化蛋白激酶(P38MAPK)抑制剂SB203580在高糖诱导肾小管上皮细胞-肌成纤维细胞转分化(TEMT)过程中的机制及其较佳作用浓度。方法体外培养人近端肾小管上皮细胞(HK-2)并分为对照组(5.5 mmol/L GS)、DMSO组(5.5 mmol/L GS+30 μmol/L SB203580等体积的DMSO)、高糖组(30 mmol/L GS),以及30 mmol/L GS+5、10、20、30 μmol/LSB203580处理的S5、S10、S20及S30组,干预48 h。四甲基偶氮唑蓝(MTT)法检测细胞增殖情况,计算半数抑制浓度(IC50);选取对照组、高糖组、S30组,Western blot法检测P38MAPK、P-P38MAPK及α-平滑肌肌动蛋白(SMA)的表达、免疫荧光法检测α-SMA的表达。结果 (1)与对照组相比,DMSO对HK-2细胞增殖无显着抑制作用(P>0.05);高糖组、S5组HK-2细胞增殖增多(P<0.05);S20、S30 组HK-2细胞增殖减少(P<0.05)。与高糖组相比,S5、S10、S20、S30组细胞增殖均受到抑制(P<0.05)。(2)与对照组相比,高糖组、S30组P-P38MAPK表达量增高(P<0.05)。与高糖组相比,S30组P-P38MAPK的表达量降低(P<0.05)。3组P38MAPK表达量无显着差异(P>0.05)。(3)与对照组相比,高糖组、S30组α-SMA表达量增高(P<0.05)。与高糖组相比,S30组α-SMA表达量降低(P<0.05)。结论30 mmol/L GS可以诱导HK-2细胞TEMT;30 μmol/L SB203580是抑制HK-2细胞TEMT的较佳抑制浓度,SB203580可能通过下调P-P38MAPK表达,从而抑制HK-2细胞增殖及胞浆中α-SMA的表达,延缓TEMT进程。
关键词:糖尿病肾病;肾小管;上皮细胞;上皮间质转分化;P38丝裂原活化蛋白激酶;SB203580
糖尿病肾病(diabetic nephropathy,DN)是糖尿病引发的微血管病变之一,与氧化应激、细胞因子表达异常等多种因素有关,可表现为炎症介质浸润、肾小球硬化和肾间质纤维化[1-2]。其中,肾间质纤维化的主要病理特点是成纤维细胞及肌成纤维细胞(myofibroblast,MyoF)异常增生,细胞外基质(extracellular matrix,ECM)分泌过多,超过自身清除能力,导致ECM在肾间质内过度沉积。α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)是MyoF出现及肾小管上皮细胞-肌成纤维细胞转分化(TEMT)开始的标志。新生MyoF 30%以上来源于TEMT[3]。因此,TEMT在DN病程发展中可能起着重要的作用。研究发现,P38丝裂原活化蛋白激酶(P38MAPK)信号通路活化可加速TEMT的进程[4]。SB203580是P38MAPK的抑制剂,已广泛应用于TEMT的研究中,但它的作用浓度及抑制效果尚少见相关报道。本研究旨在探讨SB203580在30 mmol/L葡萄糖(Glucose,GS)诱导TEMT过程中的较佳作用浓度及其可能的作用机制。
1 材料与方法
1.1主要仪器和试剂xMark酶联免疫检测仪、XR+凝胶成像仪(BIO-RAD公司)、显微镜(OLYMPUS公司)、LSM 510 META共聚焦显微镜(ZEISS公司)。人近端肾小管上皮(HK-2)细胞(上海通派公司)、胎牛血清(FBS,BI公司)、DMEM(无糖)/F12培养基(Gibicol公司)、0.25%胰蛋白酶+ EDTA(Heclon公司)、SB203580(Calbiochem公司)、MTT(Solarbio公司)、二甲基亚砜(DMSO,上海前尘生物科技有限公司)、鼠抗人α-SMA抗体(博士德公司/abcam公司)、兔抗人P38MAPK抗体、兔抗人P-P38MAPK抗体(Cell Signaling公司)、多聚甲醛(博士德生物公司)、山羊血清(中杉金桥公司)。
1.2方法
1.2.1细胞培养及分组体外培养HK-2细胞,复苏后用含10%FBS的DMEM(无糖)/F12培养液于5%CO2、37℃培养箱中培养,当细胞融合度达75%~80%时,用0.25%胰蛋白酶+ EDTA消化,传代培养,取第2~7代细胞用于实验。HK-2依处理方式的不同分为7组:对照组(5.5 mmol/L GS)、DMSO组(5.5 mmol/L GS+30 μmol/L SB203580等体积的DMSO)、高糖组(30 mmol/L GS)、S5组(30 mmol/L GS+5 μmol/L SB203580)、S10组(30 mmol/L GS+10 μmol/L SB203580)、S20组(30 mmol/L GS+20 μmol/L SB203580)、S30组(30 mmol/L GS+30 μmol/L SB203580),干预48 h。倒置相差显微镜下观察各组细胞形态。
1.2.2MTT法检测HK-2细胞增殖收集对数生长期HK-2细胞并接种于96孔板内,每孔加入100 μL细胞悬液,将待测细胞密度调至2 000个/孔,边缘孔用无菌PBS填充;次日,待细胞贴壁后吸出培养基,PBS洗1次后,加入DMEM/F12同步化12 h,按1.2.1分组并加入不同浓度SB203580,每组9个复孔;48 h后PBS洗1次,每孔加入100 μL完全培养基及20 μL 5 g/L MTT溶液,设置空白调零孔(只加完全培养基及MTT),避光孵育4 h后,小心吸去孔内培养液;每孔加入150 μL二甲基亚砜,酶标仪中低速振荡3次,每次3 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔光密度(OD)值;实验重复3次,计算抑制率(IR)=[OD高糖组-ODSB203580组]/ OD高糖组×100%,计算半数抑制浓度(IC50)[5]。
1.2.3Western blot检测 HK-2细胞中 P38MAPK、PP38MAPK、α-SMA的表达设对照组、高糖组及S30组。取对数期细胞种板,按上述分组加药,干预48 h后冰上裂解并收集细胞,4℃12 000 r/min离心25 min,提取蛋白,BCA试剂盒测蛋白浓度,配平后加入 5×loading buffer,混匀后100℃8 min煮沸,使蛋白变性,上样电泳,聚偏二氟乙烯(PVDF)膜转膜,5%脱脂奶粉或BSA室温封闭2 h,兔抗人单克隆P38MAPK、P-P38MAPK抗体(1∶1 000)或鼠抗人单克隆α-SMA抗体(1∶500)、β-actin抗体(1∶1 000)4℃孵育过夜,二抗(1∶20 000)室温孵育2 h,暗室曝光,凝胶成像和Gel-Pro analyzer分析系统进行灰度分析。
1.2.4免疫荧光法检测HK-2细胞中α-SMA的表达设置对照组、高糖组及S30组。取对数期细胞,每孔加入100 μL细胞悬液,接种于置有无菌玻片的6孔板中爬片,细胞数约8 000个/张,按上述分组加药干预48 h。PBS洗3次后用4%多聚甲醛固定15 min,10%山羊血清室温封闭30 min,滴加鼠抗人单克隆α-SMA抗体(1∶50),4℃孵育过夜,FITC标记抗小鼠IgG(1∶100)室温孵育1.5 h,于蓝色激发光(绿光)下观察荧光强度。
1.3统计学方法采用SPSS 17.0统计软件处理。符合正态分布的计量资料以x±s表示,多组间比较用单因素方差分析,组间多重比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1HK-2细胞形态学观察对照组HK-2细胞呈鹅卵石状,细胞呈现卵圆形、多边形,胞核居中,呈岛屿状、簇状生长,细胞间连接紧密;DMSO组较对照组无显着差异;高糖组细胞逐渐向长椭圆形、长梭形转变,生长较前松散;加入SB203580处理48 h后,细胞生长较前缓慢,胞体略增大,胞浆中可见凋亡小体,且随着SB203580浓度上升,胞浆中凋亡小体数量呈现递增趋势,见图1。
2.2HK-2细胞增殖结果比较与对照组相比,DMSO组、S10组HK-2细胞增殖不明显(P>0.05);高糖组、S5组HK-2细胞增殖明显(P<0.05);S20、S30组HK-2细胞增殖显着被抑制(P<0.05)。与高糖组相比,S5、S10、S20、S30组OD值均下降(P<0.05),细胞数目明显减少,见表1。SB203580 IC50为29~36 μmol/L。
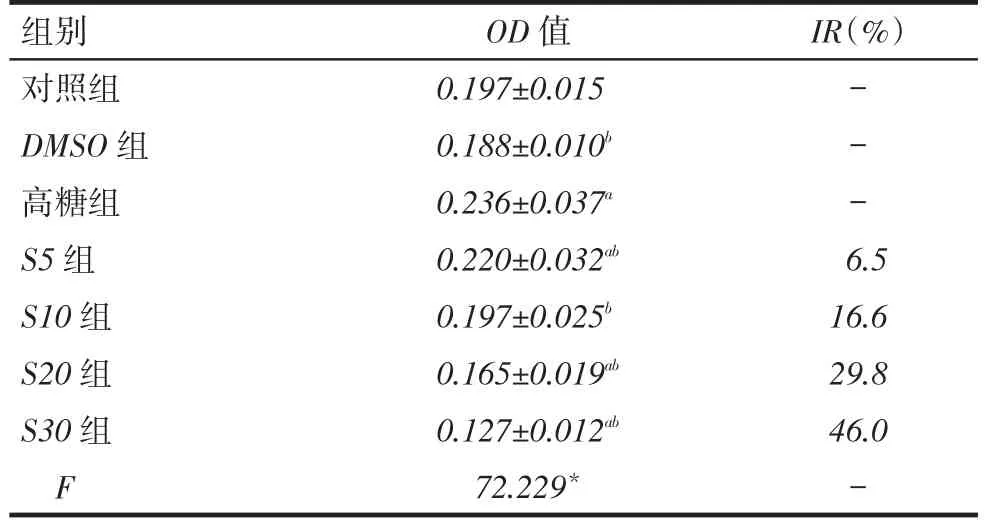
Tab.1 Comparison of OD value and inhibitory rate of HK-2 cells between seven groups表1 各组HK-2细胞OD值及抑制率比较 (n=9,x±s)
2.3HK-2细胞中P38MAPK、P-P38MAPK表达对照组、高糖组、S30组P38MAPK/β-actin灰度值比值分别为0.900±0.182、0.909±0.121及0.921±0.173(F=1.638,P>0.05)。P-P38MAPK/β-actin分别为0.123±0.066、0.629±0.193及0.235±0.095(F=1 057.744,P<0.05),其中,与对照组相比,高糖组、S30组P-P38MAPK条带变粗变深,P-P38MAPK蛋白表达增多;与高糖组相比,S30组P-P38MAPK蛋白表达量降低,见图2。

Fig.2 Expressions of P38MAPK and P-P38MAPK of HK-2 cells detected by Western blot assay图2 Western blot法检测各组HK-2中细胞P38MAPK、P-P38MAPK的表达
2.4HK-2细胞α-SMA表达结果比较对照组、高糖组、S30组α-SMA荧光强度分别为11.314±0.732、63.914±3.691及 23.082±2.123(F=612.424,P<0.05),其中高糖组、S30组较对照组增强;与高糖组相比,S30组荧光强度减弱(P<0.05)。Western blot结果示α-SMA表达量分别为0.091±0.013、0.334± 0.033及0.167±0.078(F=106.718,P<0.05),其趋势与免疫荧光法结果基本一致,见图3、4。
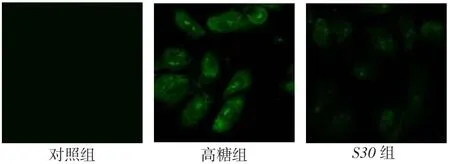
Fig.3 The expression of α-SMA of HK-2 cells in three groups图3 SB203580干预48 h后各组HK-2细胞中α-SMA的表达(×630)

Fig.4 The expression of α-SMA of HK-2 cells detected by Western blot assay图4 Western blot法检测各组HK-2细胞α-SMA的表达
3 讨论
肾小管上皮细胞是一种稳定细胞,生理情况下增殖不明显,只有在受到损伤等刺激时,才表现出较强的再生能力。在DN病程发展过程中,肾小管上皮细胞在高糖刺激下出现TEMT,其特征为肾小管上皮细胞原有表型特征丧失,出现MyoF表型[4]。同时,研究还发现,α-SMA表达量与TEMT严重程度密切相关[6]。本研究MTT结果显示,高糖组HK-2细胞增殖率高于对照组;同时高糖组α-SMA表达量较对照组显着升高,证实了30 mmol/L GS作用48 h可以使HK-2细胞TEMT,此结果与Lyu等[7]研究一致。因此,有效抑制HK-2细胞增殖对于有效减少HK-2细胞中α-SMA的表达及TEMT至关重要。
P38MAPK是MAPKs家族成员之一,主要存在于真核细胞中,是一种高度保守的信号转导模块,具有调节细胞生长、分化、迁移及炎症等作用[8]。Huang等[9]研究表明,通过调节P38MAPK信号通路中的P-P38MAPK、转化生长因子(TGF)-β等重要信号分子,抑制P38MAPK的活化,可改善DN病程中肾脏的炎性病变。因此,P38MAPK信号通路在DN过程中发挥着重要的作用,有效抑制P38MAPK可能延缓TEMT的进程。SB203580是一类吡啶咪唑类化合物,为 P38MAPK的特异性抑制剂。SB203580可以通透细胞并抑制P38MAPK,从而抑制后续MAP激酶活化蛋白激酶(MAPKAPK)-2和MAPKAPK-3的活化,发挥生物学效应[10]。本实验结果显示,与高糖组相比,加入5、10、20、30 μmol/L 的SB203580,HK-2细胞增殖抑制率分别为6.5%、16.6%、29.8%、46.0%,证实在TEMT过程中,随着SB203580浓度逐渐增加,细胞增殖抑制率逐渐升高;而DMSO是SB203580的溶剂,具有细胞毒性,对照组和DMSO组细胞增殖差异无统计学意义,提示与30 μmol/L SB203580溶液等体积的DMSO对HK-2细胞增殖无显着抑制作用,该抑制效果与DMSO无关。同时,与高糖组相比,S30组P38MAPK表达无显着变化,P-P38MAPK表达量下降,证实SB203580可以抑制P38MAPK磷酸化,并且不改变P38MAPK总蛋白表达量,与Shi等[11]研究结果相近。
IC50常用于衡量药物诱导细胞凋亡的能力。在不同细胞种属间或同种细胞不同信号通路中,SB203580的IC50不尽相同,该差异可能与细胞种类、培养环境、细胞生长状态及药物生产厂家不同直接相关[5,12]。外源性的MTT可以使活细胞中的琥珀酸脱氢酶还原为可溶于DMSO的紫色结晶甲瓉(formazan),并沉积在细胞中,因此,可以通过测量OD值评估细胞增殖情况。本实验结果示30 μmol/L SB203580干预48 h,HK-2细胞增殖抑制率约为50%,S30组较高糖组荧光强度减弱,α-SMA表达量降低,提示30 μmol/L SB203580不仅可以有效抑制TEMT过程中P-P38MAPK的表达,同时也可使α-SMA的蛋白表达量降低,证实30 mmol/L SB203580可以抑制TEMT过程中α-SMA的表达,延缓TEMT进程。然而S30组中α-SMA表达量仍高于对照组,提示除P38MAPK信号通路外,可能尚有多条信号通路参与TEMT过程;亦可能与30 μmol/L SB203580尚不能完全阻断P38MAPK信号通路有关。
综上所述,30 mmol/L GS可以诱导HK-2细胞TEMT;30 μmol/L SB203580可以使TEMT过程中约50%HK-2细胞增殖受到抑制,是TEMT过程中的较佳抑制浓度;30 μmol/L SB203580可能通过部分下调P-P38MAPK表达,继而抑制HK-2细胞增殖及胞浆中α-SMA的表达,延缓HK-2细胞TEMT的进程。
(图1见插页)
参考文献
[1]Huang WJ,Liu QX,Liao YK,et al.Clinic significance of neutrophil-iymphocyte ratio in the early-stage diabetic nephropathy[J]. Tianjin Med J,2015,43(2):214-216.[黄婉静,刘清杏,廖永康,等.中性粒细胞与淋巴细胞的比值在早期糖尿病肾病患者中的变化及意义[J].天津医药,2015,43(2):214-216].doi:10.11958/j.issn.0253-9896.2015.02.027.
[2]Ivonne L,Gunter W.Epithelial-to-mesenchymal transition in diabetic nephropathy:fact or fiction[J].Cells,2015,4(4):631-652. doi:10.3390/cells4040631.
[3]Zhao JR,Xu SS.The role of the ERK signaling pathway in high glucose-induced epithelial-mesenchymal transition of cultured human renal tubular epithelial cells[J].Chinese Journal of Clinicians,2013,7(18):8294-8298.[赵建荣,许珊珊.ERK1/2信号通路在高糖诱导的HK-2上皮间质转分化中的作用[J].中华临床医师杂志(电子版),2013,7(18):8294-8298].doi:10.3877/CMA.J. ISSN.16740-0785.2013.18.047.
[4]Liu CH,Chen FZ,Han XC,et al.Role of TGF-β1/p38 MAPK pathway in hepatitis B virus-induced tubular epithelial-myofibroblast transdifferentiation[J].Int JClin Exp Pathol,2014,7(11):7923-7930.doi:10.2337/db09-1631.
[5]Zhao B,Ge JF,Zhu JJ,et al.The discussion the method to calculate IC50proliferation in the inhibition rate measured by MTT[J].Anhui Medical and Pharmaceutical Journal,2007,11(9):834-836.[赵斌,葛金芳,朱娟娟,等.小议在MTT法测细胞增殖抑制率中IC50的计算方法[J].安徽医药,2007,11(9):834-836].
[6]Jia L,Ma XT,Gui BS,et al.Sorafenib ameliorates renal fibrosis through inhibition of TGF-β-induced epithelial-mesenchymal transition[J].PLoS One,2015,10(2):e0117757.doi:10.1371/journal.pone.0117757.eCollection 2015.
[7]Lyu ZM,Wang Q,Wan Q,et al.The role of the p38 MAPK signaling pathway in high glucose-induced epithelial-mesenchymal transition of cultured human renal tubular epithelial cells[J].PLoS One,2011,6(7):e22806.doi:10.1371/journal.pone.0022806.
[8]Guo CC,Deng Y,Ye H,et al.Role of MAPK signaling pathways in inflammatory bowel disesse[J].World Chinese Journal of Digestology,2015,23(2):229-235.[郭灿璨,邓颖,叶华,等.MAPK信号通路在炎症性肠病中的研究进展[J].世界华人消化杂志,2015,23(2):229-235].
[9]Huang YR,Wan YG,Sun W,et al.Effects and mechanisms of multi-glycoside of Tripterygium wilfordii improving glomerular inflammatory injury by regulating p38MAPK signaling activation in diabetic nephropathy rats[J].Zhongguo Zhong Yao Za Zhi,2014,39 (21):4102-4109.
[10]Yang XJ,Qi CH,Zheng Y,et al.SB203580 decreases collagenⅠand collagenⅡexpression in the liver of rats with experimental hepatic fibrosis[J].World Chinese Journal of Digestology,2014,22 (3):310-318.[杨新疆,齐翠花,郑勇,等.SB203580对肝纤维化大鼠肝脏Ⅰ、Ⅲ型胶原蛋白表达的影响[J].世界华人消化杂志,2014,22(3):310-318].
[11]Shi JR,Guan J,Jiang BB,et al.Amyloidogenic light chains induce cardiomyocyte contractile dysfunction and apoptosis via a non-canonical p38α MAPK pathway[J].PNAS,2010,107(9):4188-4193.doi:10.1073/pnas.0912263107.
[12]Birkenkamp KU,Tuyt LM,Lummen C,et al.The p38 MAP kinase inhibitor SB203580 enhances nuclear factor-kappa B transcriptional activity by a non-specific effect upon the ERK pathway[J].Br J Pharmacol,2000,131(1):99-107.
(2015-07-07收稿2015-10-16修回)
(本文编辑陆荣展)
The effects of P38MAPK inhibitor SB203580 on TEMT of HK-2 cells
JIA Lin,LIN Zhifeng,MA Li,TANG Yuling,YANG Rui,YANG Xiaoping
Division of Nephrology,the First Affiliated Hospital,College of Medicine,Shihezi University,Shihezi 832008,China;Corresponding AuthorE-mail:sbkyxp@163.com
Abstract:ObjectiveTo observe the effects of different concentrations of SB203580,the inhibitor of P38MAPK,in process of high glucose(GS)-induced renal tubular epithelial-myofibroblast transdifferentiation(TEMT).MethodsThe cultured human renal tubular epithelial cells(HK-2)were divided into control group(5.5 mmol/L GS),GS(30 mmol/L GS)group and different concentrations of SB203580(30 mmol/L GS+5,10,20 and 30 μmol/L SB203580)groups.The treatments were for 48 hours.MTT assay was used to observe cell proliferation.The median inhibitingconcentration(IC50)was calculated.Western blot assay was used to detect the expressions of P38MAPK,P-P38MAPK and α-smooth muscle actin(α-SMA)in control group,high-glucose group and S30 group.The expression of α-SMA was also detected by the method of immunofluorescence.Results1.Compared with control group,there was no significant inhitory effect on proliferation rate in DMSO group(P>0.05).There were increased HK-2 cells in high glucose group and S5group(P<0.05).Proliferation rates were significantly decreased in S20 and S30 groups(P<0.05).Compared with high glucose group,the proliferation rates of HK-2 cells were inhibited in S5,S10,S20 and S30 groups(P<0.05).2.The expression of P-P38MAPK was significantly higher in high glucose group and S30 group than that of control group(P<0.05).Compared with high glucose group,the expression of P-P38MAPK was significantly decreased in S30 group(P<0.05),whereas no significant difference in the expression of P38MAPK between the two groups(P>0.05).3.Compared with control group,the expression of α-SMA was significantly increased in high glucose group and S30 group(P<0.05).Compared with high glucose group,the expression of α-SMA was significantly decreased in S30 group(P<0.05).ConclusionThe 30 mmol/L GS can lead to TEMT in HK-2 cells.The more suitable inhibitory concentration of SB203580 in the process of TEMT is 30μmol/L.SB203580 can slowdown the process of TEMT by inhibiting P38MAPK activation and inhibiting proliferation and the expression of α-SAM s of HK-2 cells.
Key words:diabetic nephropathy;kidney tubules;epithelial cells;epithelial-mesenchymaltransition;P38MAPK;SB203580
中图分类号:R692
文献标志码:A
DOI:10.11958/20150004
基金项目:石河子大学科学技术研究发展计划基金资助项目(2013ZRKXYQ-YD16)
作者单位:石河子大学第一附属医院肾病科(邮编832008)
作者简介:贾林(1989),女,硕士在读,主要从事肾小管疾病研究
通讯作者E-mail:sbkyxp@163.com



