嵇继宇,司慧丽,王宏
CXCL16、CD36与颈动脉易损斑块并发脑梗死的关系
嵇继宇,司慧丽,王宏△
目的探讨血清巨噬细胞趋化因子配体16(CXCL16)及CD36水平与颈动脉粥样硬化易损斑块并发大动脉粥样硬化(LAA)性脑梗死的关系。方法选取颈动脉粥样硬化易损斑块合并LAA性脑梗死的患者(脑梗组)50例、有颈动脉粥样硬化易损斑块者(斑块组)50例;同期健康体检者(对照组)50例。各组均接受颈动脉彩超检查。计算各组体质指数(BMI),同时检测各组三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖(FBG),应用酶联免疫吸附试验(ELISA)测定各组血清CXCL16及CD36水平。Logistic回归分析颈动脉粥样硬化易损斑块发生LAA性脑梗死的影响因素。结果斑块组和脑梗组BMI、TG、TC、LDL-C、FBG水平高于对照组,HDL-C水平低于对照组;脑梗组TG、TC、LDL-C、FBG水平高于斑块组,BMI、HDL-C水平低于斑块组(P<0.05)。对照组、斑块组及脑梗组的CXCL16和CD36水平均呈依次升高趋势(P<0.05)。多因素Logistic回归分析显示,高TG、LDL-C、FBG、CXCL16及CD36是颈动脉粥样硬化易损斑块合并LAA性脑梗死的危险因素。结论血清CXCL16、CD36水平可作为颈动脉易损斑块的生物标志物;联合检测血清CXCL16、CD36水平有助于预测LAA性脑梗死。
趋化因子,CXC;抗原,CD36;动脉粥样硬化;脑梗死;趋化因子配体16;易损斑块
动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)本质上是以脂质代谢异常、炎症反应为特征的一种炎性疾病[1]。氧化的低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)和巨噬细胞可通过促进细胞内脂质蓄积和泡沫细胞形成对动脉粥样硬化的发生和进展产生影响。研究显示,CD36是人类巨噬细胞摄取ox-LDL的清道夫受体[2]。巨噬细胞趋化因子配体16(CXC chemokine ligand16,CXCL16)是炎症性趋化因子超家族成员,可趋化白细胞迁移,同时也是ox-LDL的清道夫受体[3]。研究认为,CXCL16可促进斑块的易损性[4],但CXCL16、CD36和颈动脉粥样硬化易损斑块合并大动脉粥样硬化(LAA)性脑梗死的关系尚少见报道。本研究旨在通过分析CXCL16和CD36在ASCVD中的不同作用,了解CXCL16和CD36能否成为反映斑块易损性及患者进展为脑梗死的生物标志物,探讨CXCL16和CD36与LAA性脑梗死的关系。
1 对象与方法
1.1 研究对象选取2015年11月—2016年6月就诊于石河子大学医学院第一附属医院神经内科具有颈动脉粥样硬化易损斑块合并LAA性脑梗死的患者(脑梗组)50例,均于发病72 h内入院,符合2014年中国急性缺血性脑卒中诊治指南动脉粥样硬化性脑梗死的诊断标准;根据TOAST(the trial of org10172 in acute stroke treatment)病因分型确定为LAA性脑梗死。另取同期健康体检并经颈动脉彩超确诊为有颈动脉粥样硬化性易损斑块者(斑块组)50例,既往均无脑血管病病史。同期健康体检正常者(对照组)50例。排除标准:(1)出血性卒中、心源性脑梗死。(2)有急性冠脉综合征、心衰及其他周围血管病。(3)有自身免疫性疾病及其他炎性疾病。(4)有肿瘤、严重肝肾功能损害等疾病。(5)3个月内有手术及外伤史。各组性别、年龄、吸烟史构成差异均无统计学意义,具有可比性,见表1。
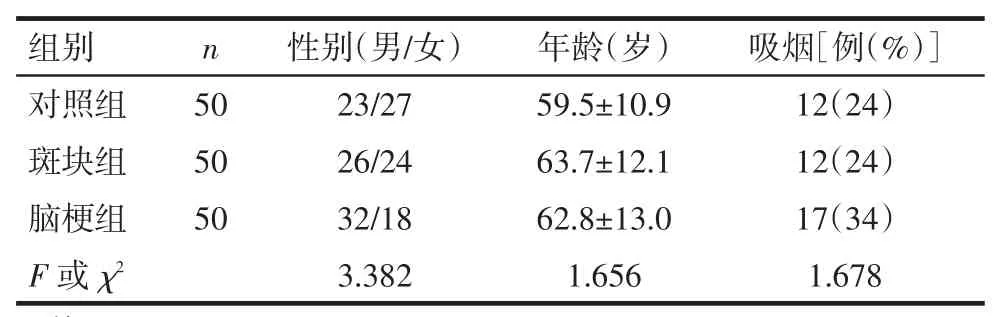
Tab.1Comparison of general clinical data between three groups表1 各组基本资料比较
1.2 方法所有受试者于清晨空腹收集静脉血3~5 mL,置于EDTA管中,室温下自然凝固30 min后以3 000 r/min离心15 min,收集血清置于冻存管中,以-80℃保存。使用罗氏DPP-H7600全自动生化分析仪及配套的试剂盒测定三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FBG)。采用双抗体夹心法测定血清CXCL16及CD36水平,按照酶联免疫吸附试验(ELISA)试剂盒(上海西唐公司)说明书进行操作。
颈动脉彩色多普勒超声检查:采用飞利浦IE33型彩色多普勒超声诊断仪,探头频率7~11 MHz,患者取平卧位,头偏向一侧,沿颈动脉走向,将探头自上而下进行连续的纵横切面扫描双侧颈总、颈内、颈外动脉,观察斑块形态及回声特点。颈动脉粥样硬化斑块定义为内膜中层不连续性、不均匀性增厚并凸入管腔,边界光滑,病变厚度是邻近部位内-中层厚度的1.5倍或彩色多普勒显示血管腔某处彩色血流缺损,缺损处面积≥10 mm2。斑块分型方法:(1)内膜不光滑,回声增强、增厚,局部轻微隆起为扁平斑。(2)斑块凸出管腔,回声强弱不均,表面光滑连续为软斑。(3)斑块较大,基底较宽,表面出现凹凸,边缘回声较低为溃疡斑。(4)斑块高低不平,强回声,后伴声影为硬斑。将扁平斑、硬斑归为稳定斑块,软斑、溃疡斑归为易损斑块。
1.3 统计学方法采用SPSS 17.0统计软件进行数据处理。符合正态分布的计量资料以均数±标准差表示,多组间均数比较采用方差分析,组间多重比较用Bonferroni法;非正态分布的计量资料组间比较采用非参数检验。计数资料采用例(%)表示,组间比较用χ2检验。脑梗死相关影响因素分析用Logistic回归分析。检验水准为α=0.05。
2 结果
2.1 各组一般生化指标比较对照组、斑块组和脑梗组的糖尿病和高血压比例呈逐渐增加趋势;斑块组和脑梗组体质指数(BMI)、TG、TC、LDL-C、FBG水平高于对照组,HDL-C水平低于对照组;脑梗组TG、TC、LDL-C、FBG水平高于斑块组,BMI、HDL-C水平低于斑块组(均P<0.05),见表2。
Tab.2Comparison of BMI and other clinical data between three groups表2 各组糖尿病、高血压、BMI及生化指标比较(n=50,)
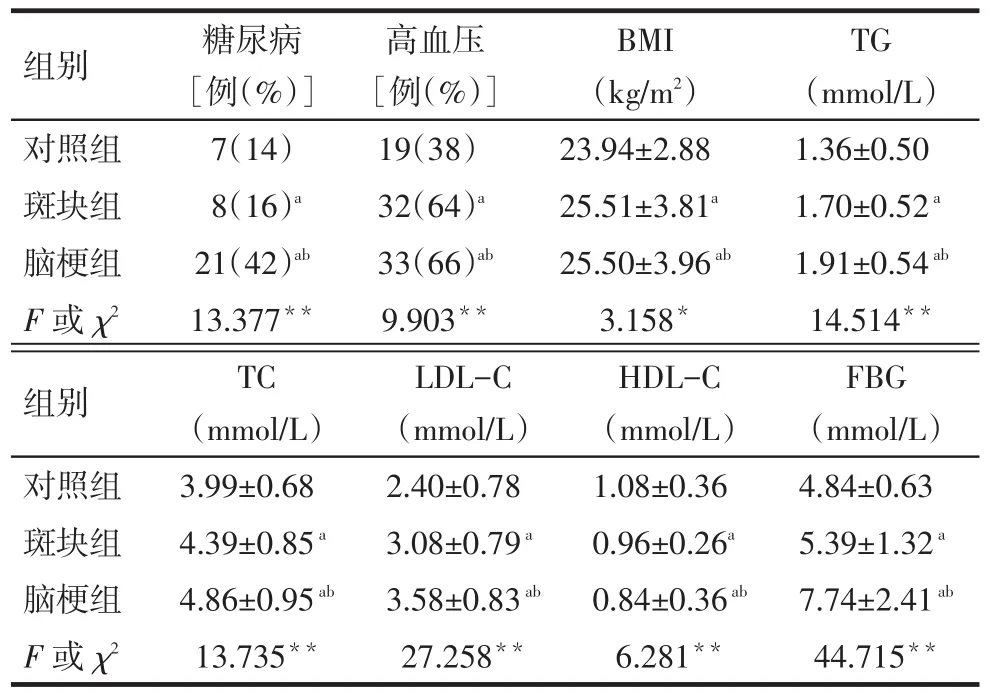
Tab.2Comparison of BMI and other clinical data between three groups表2 各组糖尿病、高血压、BMI及生化指标比较(n=50,)
*P<0.05,**P<0.01;a与对照组比较,b与斑块组比较,P<0.05;表3同
组别对照组斑块组脑梗组F或χ2糖尿病[例(%)]7(14)8(16)a 21(42)ab 13.377**高血压[例(%)]19(38)32(64)a 33(66)ab 9.903**BMI(kg/m2)23.94±2.88 25.51±3.81a 25.50±3.96ab 3.158*TG(mmol/L)1.36±0.50 1.70±0.52a 1.91±0.54ab 14.514**组别对照组斑块组脑梗组F或χ2 TC(mmol/L)3.99±0.68 4.39±0.85a 4.86±0.95ab 13.735**LDL-C(mmol/L)2.40±0.78 3.08±0.79a 3.58±0.83ab 27.258**HDL-C(mmol/L)1.08±0.36 0.96±0.26a 0.84±0.36ab 6.281**FBG(mmol/L)4.84±0.63 5.39±1.32a 7.74±2.41ab 44.715**
2.2 各组CD36、CXCL16水平比较对照组、斑块组及脑梗组的CXCL16和CD36水平均呈依次升高趋势(P<0.05),见表3。
Tab.3Comparison of serum CXCL16 and CD36 concentrations between three groups表3 各组血清CD36与CXCL16水平比较(μg/L,)

Tab.3Comparison of serum CXCL16 and CD36 concentrations between three groups表3 各组血清CD36与CXCL16水平比较(μg/L,)
组别对照组斑块组脑梗组F n 50 50 50 CD36 3.62±0.91 4.49±0.88a5.40±0.96ab47.611**CXCL16 1.85±0.40 2.30±0.45a2.84±0.65ab45.782**
2.3 脑梗死影响因素分析以斑块组是否发生脑梗死(是=1,否=0)为因变量,以BMI、TG、TC、LDL-C、HDL-C、FBG、CXCL16、CD36为自变量,进行多因素Logistic回归分析。结果显示,高TG、LDL-C、FBG、CXCL16及CD36是颈动脉粥样硬化易损斑块合并LAA性脑梗死发生的危险因素,见表4。
3 讨论
炎症反应可致不稳定斑块破裂并诱发血栓形成,导致急性缺血事件的发生[5]。易损斑块的重要特征便是具有炎症特性[6]。病理学研究显示,在破裂的斑块内存在大量的炎症细胞[7]。单核、巨噬细胞是在动脉粥样硬化病变中被确认的最早期的炎性细胞之一,同时也是巨噬细胞在脂质条纹病变当中的主要细胞类型。趋化因子、清道夫受体和黏附分子长久以来被认为在动脉粥样硬化发病机制中起到了重要作用,并且与巨噬细胞有密切的关系[8]。
CD36是一个表达于单核巨噬细胞、微血管内皮细胞、脂肪细胞等多种细胞表面的跨膜糖蛋白,属于B族清道夫受体家族[9]。CD36在致动脉粥样硬化过程即泡沫细胞形成、炎症介质的释放、巨噬细胞的俘获和血栓形成中起到了重要的作用。“eat me signal”正反馈机制、CD36和ox-LDL相互作用以及泡沫细胞引起的炎症等均会诱导动脉狭窄,最终导致ASCVD[10]。研究已经证实,CD36以伴随血小板、单核巨噬细胞、脂肪细胞上脱落的微小颗粒的形式存在于循环血液中;通常情况下,CD36水平降低是内源性过氧化物酶体增殖物激活受体γ(PPAR-γ)低活性的结果,血清CD36在细胞凋亡时可被释放进入循环血液中;并且血清CD36水平与胰岛素抵抗呈正相关,因此,CD36可能是巨噬细胞激活、炎症导致动脉粥样硬化的一个标志物[11]。Handberg等[12]研究显示,血清CD36水平在颈动脉粥样硬化患者中升高,并且其水平与斑块易损性有关。本研究结果亦显示,脑梗组及斑块组血清CD36水平均较对照组升高,脑梗组血清CD36水平较斑块组升高,表明在脑梗死患者循环血液中CD36释放增加。Littlewood等[13]认为泡沫细胞凋亡与斑块易损、血栓形成以及继而发展为急性缺血性事件有关,并推测满载脂质的巨噬细胞的凋亡可能是血清CD36释放增加的原因。因此,结合本研究,笔者认为,CD36有可能作为预测脑梗死的一个血清学指标。
CXCL16是在2000年由Shimaoka等[14-15]发现的一种新型趋化因子。CXCL16也是在动脉粥样硬化损伤部位由干扰素(interferon,IFN)-γ调控并介导ox-LDL吞噬的清道夫受体[3]。研究认为,CXCL16参与动脉粥样硬化的病理基础主要为:(1)CXCL16在促炎性刺激物和脂质摄取之间作为趋化因子及清道夫受体起到了桥梁作用。(2)CXCL16在血管的细胞黏附、增殖和迁移中作为黏附分子起到了重要作用[8]。另外,该研究认为,细胞黏附和迁移是血管源性细胞最初渗透入损伤处的需要,细胞增殖对于决定动脉粥样硬化斑块稳定性也起到了重要的作用[8]。因此,CXCL16可能参与了动脉粥样硬化的发生和发展。本研究结果显示,脑梗组与斑块组的血清CXCL16水平均高于对照组,并且脑梗组血清CXCL16水平高于斑块组,与相关研究结果相近[16];而Izquierdo等[4]认为CXCL16在ASCVD的作用是有争议的,CXCL16可能有抗动脉粥样硬化作用,但是也可能会导致斑块不稳定,原因可能与CXCL16多向性功能有关。因此,CXCL16有促斑块易损性的作用,但其在ASCVD中的作用仍需验证。Wong等[17]认为,趋化因子可通过激活整合素增强CD36聚集,结合本研究中对照组、斑块组及脑梗组CXCL16和CD36水平均呈依次升高趋势,笔者认为尽管CXCL16在结构上与其他清道夫受体没有同源性[3],但CXCL16和CD36在动脉粥样硬化发生发展中可能存在共同通路。
目前,以CD36为靶点的抗动脉粥样硬化治疗药物主要有匹伐他汀、阿托伐他汀等[18],但同时以CD36和CXCL16为靶点的药物尚未上市。笔者认为,若有药物在下调CD36表达的同时,能够下调CXCL16的表达,清道夫受体表达就有可能明显下调,从而降低巨噬细胞摄取ox-LDL水平,继而对控制动脉粥样硬化可能更加有效。另外,本研究多因素Logistic回归分析显示,除TG、LDL-C、FBG传统影响因素外,高CXCL16及CD36水平也是颈动脉粥样硬化易损斑块合并LAA性脑梗死的独立危险因素,提示CXCL16及CD36水平升高可作为颈动脉粥样硬化斑块易损性及脑梗死的发生、发展密切相关的一个炎性标志。
综上所述,CD36和CXCL16水平的升高,可能加重动脉粥样硬化斑块的易损性,继而使患者发生血管终点事件。临床在常规检测患者血脂谱的同时,进行CXCL16和CD36水平的检测有助于了解高危人群动脉粥样硬化易损斑块的易损性。
[1]Viola J,Soehnlein O.Atherosclerosis-A matter of unresolved inflammation[J].Semin Immunol,2015,27(3):184-193.doi: 10.1016/j.smim.2015.03.013.
[2]Zheng H,Cui D,Quan X,et al.Lp-PLA2 silencing protects against ox-LDL-induced oxidative stress and cell apoptosis via Akt/mTOR signaling pathway in human THP1 macrophages[J].Biochem Biophys Res Commun,2016,477(4):1017-1023.doi:10.1016/j. bbrc.2016.07.022.
[3]Laugsand LE,Åsvold BO,Vatten LJ,et al.Soluble CXCL16 and risk of myocardial infarction::The HUNT study in Norway[J].Atherosclerosis,2016,244:188-194.doi:10.1016/j.atherosclerosis.2015.11.022.
[4]Izquierdo MC,Martin-Cleary C,Fernandez-Fernandez B,et al. CXCL16 in kidney and cardiovascular injury[J].Cytokine Growth Factor Rev,2014,25(3):317-325.doi:10.1016/j.cytogfr. 2014.04.002.
[5]Meng XJ,Xu J,Cheng AJ,et al.The expression of high mobility group box-1 in patients with acute coronary syndrome and the treatment of atorvastatin[J].Tianjin Med J,2016,44(4):497-500.[孟祥娟,许静,程爱娟,等.急性冠脉综合征患者血清高迁移率族蛋白B1的表达及阿托伐他汀干预治疗的影响[J].天津医药,2016,44(4):497-500].doi:10.11958/20150127.
[6]Aluganti Narasimhulu C,Fernandez-Ruiz I,Selvarajan K,et al. Atherosclerosis-do we know enough already to prevent it?[J].Curr OpinPharmacol,2016,27:92-102.doi:10.1016/j.coph. 2016.02.006.
[7]Duivenvoorden R,Mani V,Woodward M,et al.Relationship of serum inflammatory biomarkers with plaque inflammation assessed by FDG PET/CT:the dal-PLAQUE study[J].JACC Cardiovasc Imaging,2013,6(10):1087-1094.doi:10.1016/j.jcmg. 2013.03.009.
[8]Sheikine Y,Sirsjo A.CXCL16/SR-PSOX-A friend or a foe in atherosclerosis?[J].Atherosclerosis,2008,197(2):487-495.doi:10.1016/j.atherosclerosis.2007.11.034.
[9]Febbraio M,Hajjar DP,Silverstein RL.CD36:a class B scavenger receptor involved in angiogenesis,atherosclerosis,inflammation and lipid metabolism[J].J Clin Invest,2001,108:785-791.doi:10.1172/JCI14006.
[10]Park YM.CD36,a scavenger receptor implicated in atherosclerosis[J].Exp Mol Med,2014,46:e99.doi:10.1038/emm.2014.38.
[11]Rać M,Krzystolik A,Rać M,et al.Is plasma-soluble CD36 associated with density of atheromatous plaque and ankle-brachial index in early-onset coronary artery disease patients?[J].Kardiol Pol,2016,74(6):570-575.doi:10.5603/KP.a2015.0238.
[12]Handberg A,Skjelland M,Michelsen AE,et al.Soluble CD36 in plasma is increased in patients with symptomatic atherosclerotic carotid plaques and is related to plaque instability[J].Stroke,2008,39(11):3092-3095.doi:10.1161/STROKEAHA.108. 517128.
[13]Littlewood TD,Bennett MR.Apoptotic cell death in atherosclerosis[J].Curr Opin Lipidol,2003,14:469-475.doi:10.1097/01. mol.0000092618.86399.71.
[14]Shimaoka T,Kume N,Minami M,et al.Molecular cloning of a novel scavenger receptor for oxidized low density lipoprotein,SRPSOX,on macrophages[J].J Biol Chem,2000,275(52):40663-40666.doi:10.1074/jbc.C000761200.
[15]Matloubian M,David A,Engel S,et al.A transmembrane CXC chemokine is a ligand for HIV-coreceptor Bonzo[J].Nat Immun,2000,1(4):298-304.doi:10.1038/79738.
[16]Ma A,Pan X,Xing Y,et al.Elevation of serum CXCL16 level correlates well with atherosclerotic ischemic stroke[J].Arch Med Sci,2014,10(1):47-52.doi:10.5114/aoms.2013.39200.
[17]Wong HS,Jaumouillé V,Freeman SA,et al.Chemokine signaling enhancesCD36responsivenesstowardoxidizedlow-density lipoproteins and accelerates foam cell formation[J].Cell Rep,2016,14(12):2859-2871.doi:10.1016/j.celrep.2016.02.071.
[18]Jin WY,Cheng H.CD36 and Atherosclerosis[J].Chinese Journal of Arteriosclerosis,2010,18(7):582-585.[靳文英,陈红.CD36与动脉粥样硬化[J].中国动脉硬化杂志,2010,18(7):582-585].
(2016-07-27收稿2016-09-13修回)
(本文编辑陆荣展)
Correlation between serum chemokine CXCL16,CD36 and vulnerable carotid plaques with cerebral infarction
JI Jiyu,SI Huili,WANG Hong△
Department of Neurology,the First Affiliated Hospital,Shihezi University School of Medicine,Shihezi 832000,China△
ObjectiveTo investigate the relationship between serum chemokine CXCL16 and CD36 in vulnerable carotid atherosclerosis plaques with large artery atherosclerosis(LAA)-stoke.MethodsFifty patients with LAA-cerebral infarction and carotid vulnerable plaque(infarction group),50 patients with carotid vulnerable plaque(plaque group)and 50 healthy subjects in the same period(control group)were included in this study.The cervical vascular color ultrasonic inspection was performed in three groups.Data of body mass index(BMI)were calculated in three groups.Levels of triglyceride(TG),total cholesterol(TC),low density lipoprotein cholesterol(LDL-C),high density lipoprotein cholesterol (HDL-C)and fasting blood glucose(FBG)were also detected in three groups.The enzyme linked immunosorbent assay (ELISA)was used to detect the serum levels of CXCL16 and CD36 in three groups.Logistic regression analysis was used to analyse the influence factors of LAA-cerebral infarction.ResultsLevels of BMI,TG,TC,LDL-C and FBG were higher, and the level of HDL-C was lower in infarction group and plaque group than those in control group.Levels of TG,TC,LDLC and FBG were significantly higher in infarction group than those of plaque group,and levels of BMI and HDL-C were significantly lower in infarction group than those in plaque group(P<0.05).Both serum levels of CXCL16 and CD36 showed significantly increased trend in control group,plaque group and infarction group.Multivariate Logistic regression analysis showed that the higher levels of TG,LDL-C,FBG,CXCL16 and CD36 were the independent risk factors for large artery atherosclerotic cerebral infarction.ConclusionSerum chemokine CXCL16 and CD36 can be used as a clinical marker of vulnerable carotid plaques.Joint detection of CXCL16 and CD36 can predict the occurrence of LAA-cerebral infarction.
chemokines,CXC;antigens,CD36;atherosclerosis;brain infarction;CXC chemokine ligand16;vulnerable plaque
R543.4
A
10.11958/20160745
新疆石河子,石河子大学医学院第一附属医院神经内科(邮编832000)
嵇继宇(1990),男,硕士在读,主要从事脑血管病的基础研究
△通讯作者E-mail:wang832000@sina.com



