安文峰,翟鲁辉,马玉朝,高朋飞
丁苯酞对急性脑梗死患者血清炎症因子及氧化应激水平的影响
安文峰,翟鲁辉△,马玉朝,高朋飞
目的探讨丁苯酞对急性脑梗死患者血清炎症因子与氧化应激水平的影响。方法选取2014年3月—2016年9月我院神经内科收治的急性脑梗死患者120例,根据治疗方法的不同分为常规治疗组(56例)和丁苯酞组(64例)。常规治疗组给予抗血小板聚集、改善微循环等常规治疗,丁苯酞组在常规治疗的基础上加用丁苯酞注射液治疗(100 mL静脉滴注,每日2次)。分别检测患者入院时,治疗7 d、14 d的血清肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-17、IL-23和氧化应激产物丙二醛(MDA)的水平,并评价其临床疗效。结果治疗后第7天及第14天,2组患者血清TNF-α、IL-6、IL-17、IL-23,MDA水平均较治疗前下降,差异均有统计学意义(P<0.05),同时丁苯酞组上述指标均较常规治疗组下降(P<0.05)。2组均未出现明显的不良反应。结论丁苯酞可通过抑制炎症反应和对抗氧化应激等方面来改善急性脑梗死患者的临床症状,改善预后。
脑梗死;炎症;肿瘤坏死因子α;白细胞介素6;白细胞介素17;丙二醛;氧化性应激;丁苯酞
急性脑梗死(acute cerebral infarction,ACI)是神经内科的常见病和多发病,主要表现为脑组织缺血、缺氧性坏死,具有高病死率和致残率的特点。近年来,炎症因子与ACI发病的关系逐渐引起关注。已有研究证实,ACI患者中存在炎症因子的高表达[1-2]。与此同时,ACI发生后会导致钙离子大量内流,继而产生大量的氧自由基和活性氧,加重脑组织的损伤程度[3]。丁苯酞是从芹菜籽中提取的药物,其主要活性成分是dl-3-正丁基苯酞。作为我国自主研发的新型药物,既往研究[4]和笔者前期的临床观察[5]已经证实,丁苯酞可明显改善ACI患者的脑缺血程度,修复损伤的血管内皮细胞,改善患者预后。目前丁苯酞的作用机制尚不完全清楚,本研究旨在观察丁苯酞对ACI患者血清炎症因子及氧化应激水平的影响,探讨其治疗ACI的相关作用机制。
1 对象与方法
1.1 研究对象 选取我院2014年3月—2016年9月神经内科收治的ACI患者120例,其中男66例,女54例,年龄46~77岁,平均(58.4±3.2)岁。所有患者均于发病1周内入院。纳入标准:(1)符合2010年中国急性缺血性脑卒中诊治指南制定的ACI诊断标准[6]。(2)梗死部位经头部CT或MRI证实。(3)无丁苯酞过敏史。排除标准:(1)年龄>80 岁。(2)合并其他颅内病变。(3)伴有恶性肿瘤、免疫系统疾病、严重肝肾功能异常者。(4)孕妇及哺乳期妇女。所有入选对象对本研究的目的和意义均知情同意并签署了知情同意书。
1.2 分组及治疗 所有对象根据治疗方法的不同分为常规治疗组(56例)和丁苯酞组(64例)。常规治疗组入院后给予抗血小板聚集(阿司匹林肠溶片300 mg/d,硫酸氢氯吡格雷片75 mg/d)、改善微循环、营养脑神经(胞二磷胆碱注射液0.5 g/d,静脉滴注)治疗。盐酸二甲双胍控制血糖,硝苯地平缓释片控制血压,阿托伐他汀钙片控制血脂,并维持患者的水、电解质平衡。丁苯酞组在常规治疗基础上给予丁苯酞氯化钠注射液(恩必普,100 mL,石药集团恩必普药业有限公司)100 mL静脉滴注,每日2次,治疗半个月。
1.3 指标检测 分别于患者入院次日、治疗第7天、第14天抽取空腹静脉血5 mL,1 500×g离心10 min后分离血清。采用ELISA法检测血清肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-17、IL-23水平(试剂盒购自南京建成生物工程研究所)。应用硫代巴比妥酸法测定氧化应激产物血清丙二醛(MDA)的水平(试剂盒购自杭州碧云天生物科技有限公司)。
1.4 统计学方法 采用统计软件SPSS 19.0进行数据分析。符合正态分布的计量资料统一采用均数±标准差(±s)表示,2组组内不同时间点均数比较采用重复测量资料的方差分析,时点间多重比较采用LSD-t法。相同时间点2组间比较采用t检验;计数资料以例(%)表示,组间比较采用χ2检验,检验水准α=0.05。
2 结果
2.1 2组一般资料比较 常规治疗组和丁苯酞组患者的年龄、性别、糖尿病、高血压患病比例及血脂水平差异均无统计学意义(均P>0.05),见表1。2组间患者的基线资料均衡可比。
2.2 2组治疗前后各指标变化 治疗前,2组间除TNF-α、IL-23外各项指标差异无统计学意义。治疗第 7 天,2组 TNF-α、IL-6、IL-17、IL-23 及 MDA水平均较治疗前降低,差异有统计学意义(P<0.05)。治疗第14天,2组炎症因子水平进一步下降。治疗第7天和第14天时丁苯酞组各炎症因子水平均较常规治疗组降低,差异有统计学意义(均P < 0.05),见表 2。
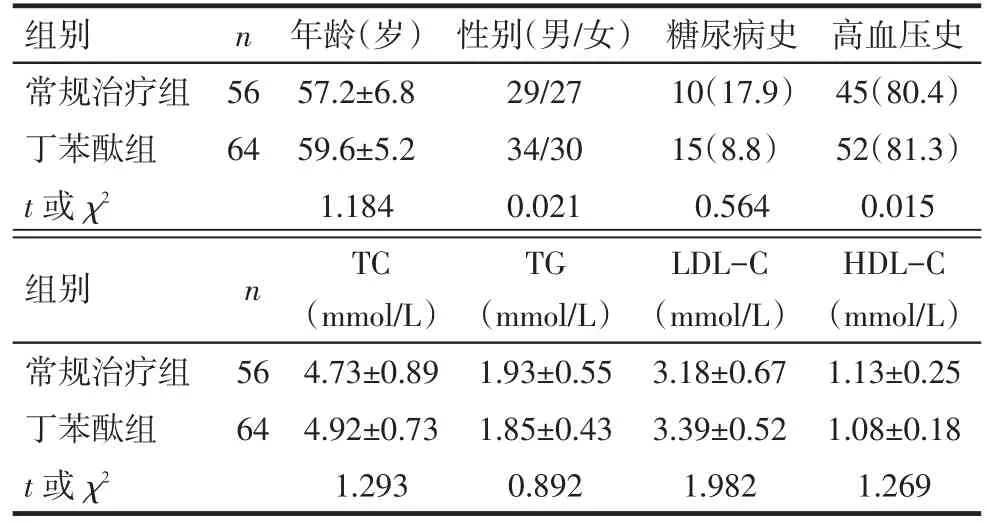
Tab.1 Comparison of the baseline data between two groups表1 2组基线资料比较
Tab.2 Comparison of the inflammatory cytokines and MDA levels between two groups表2 治疗前后2组炎症因子及MDA水平比较 (±s)
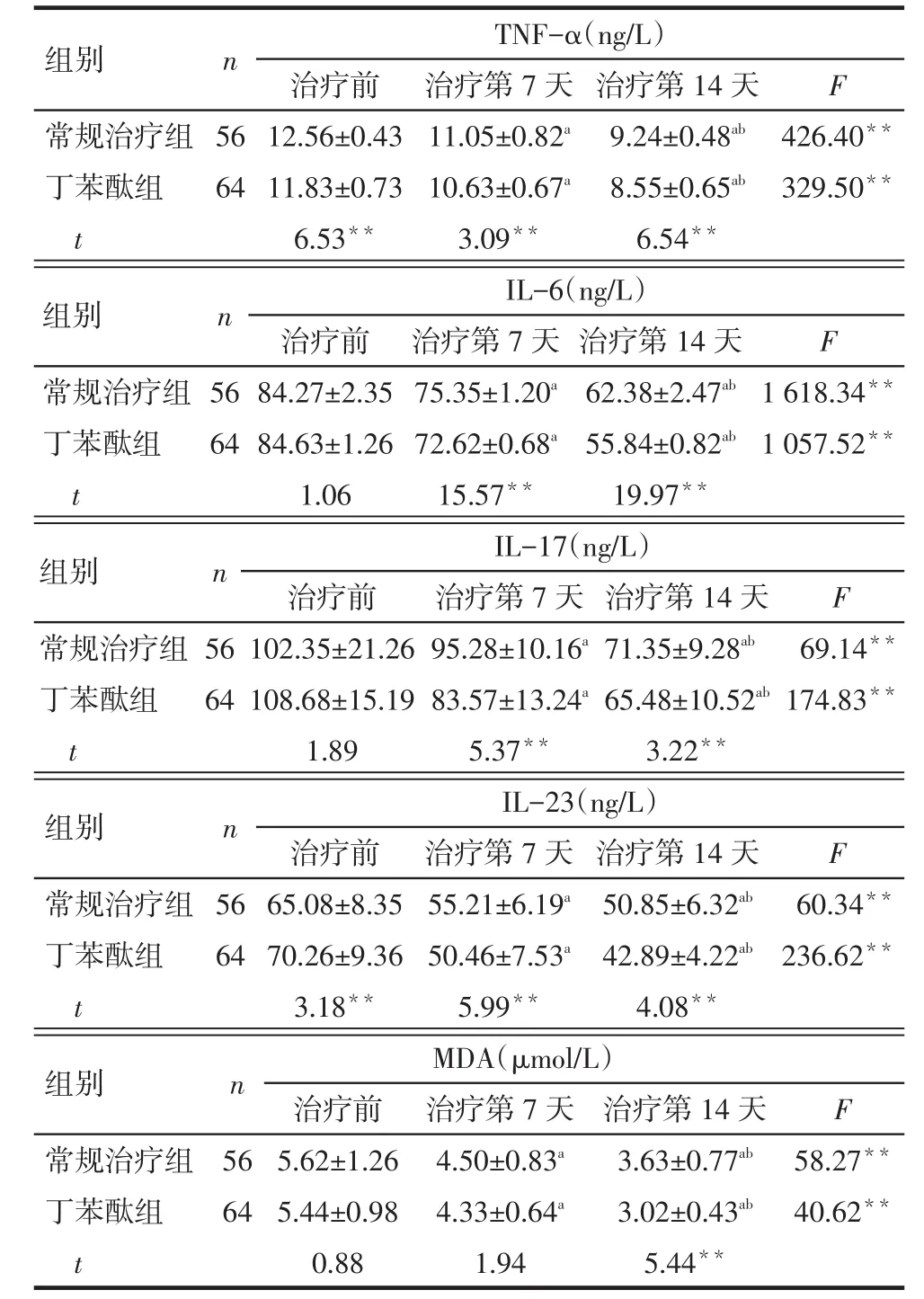
Tab.2 Comparison of the inflammatory cytokines and MDA levels between two groups表2 治疗前后2组炎症因子及MDA水平比较 (±s)
**P<0.01;a与治疗前比较,b与治疗第 7 天比较,P < 0.05
组别常规治疗组丁苯酞组t n TNF-α(ng/L)F 56 64治疗前12.56±0.43 11.83±0.73 6.53**治疗第7天11.05±0.82a10.63±0.67a3.09**治疗第14天9.24±0.48ab8.55±0.65ab6.54**426.40**329.50**F n组别常规治疗组丁苯酞组t IL-6(ng/L)56 64治疗前84.27±2.35 84.63±1.26 1.06治疗第7天75.35±1.20a72.62±0.68a15.57**治疗第14天62.38±2.47ab55.84±0.82ab19.97**1 618.34**1 057.52**组别n IL-17(ng/L)F治疗前 治疗第7天 治疗第14天常规治疗组丁苯酞组t 56 64 102.35±21.26 108.68±15.19 1.89 95.28±10.16a83.57±13.24a5.37**71.35±9.28ab65.48±10.52ab3.22**69.14**174.83**组别常规治疗组丁苯酞组t n IL-23(ng/L)F 56 64治疗前65.08±8.35 70.26±9.36 3.18**治疗第7天55.21±6.19a50.46±7.53a5.99**治疗第14天50.85±6.32ab42.89±4.22ab4.08**60.34**236.62**组别常规治疗组丁苯酞组t n MDA(μmol/L)F 56 64治疗前5.62±1.26 5.44±0.98 0.88治疗第7天4.50±0.83a4.33±0.64a1.94治疗第14天3.63±0.77ab3.02±0.43ab5.44**58.27**40.62**
3 讨论
人体脑组织代谢旺盛,对缺血、缺氧等条件极其敏感,长时间的脑缺血会产生大量的氧自由基,加重组织的氧化损伤,极易引发患者神经功能障碍,甚至死亡。目前普遍认为,动脉粥样硬化是发生脑梗死的致病基础,而机体炎症反应在动脉粥样硬化形成过程中起着重要作用。脑缺血时,脑组织炎症因子的水平急剧升高,从而诱发炎症级联反应,加重大脑的神经损伤[5]。Lambertsen 等[7]发现脑梗死患者血管内皮细胞损伤后,炎症细胞可聚集在损伤的血管壁并分泌大量的炎症因子。Boehme等[8]通过检测1 244例腔隙性脑梗死患者的血清标本发现,IL-6和TNF-α的表达明显升高,并且炎症因子水平与抗血小板聚集治疗的效果密切相关。Gu等[9]研究发现我国南部汉族脑梗死患者中血清IL-8、IL-6、IL-12和TNF-α的水平明显升高。TNF-α、IL-6主要由淋巴细胞、单核巨噬细胞分泌,前者可促进脑缺血区域的细胞凋亡,后者可促进血管内皮细胞分泌多种黏附因子和炎症介质,导致斑块破裂和血栓形成[10]。因此,机体的炎症因子水平在一定程度上反映了ACI的严重程度。
脑缺血时大量的炎性细胞浸润,氧化中间产物大量堆积,进而发生氧化应激。过度的炎性反应可以减少局部脑组织的血流量、增加血脑屏障的通透性,引起大脑的继发性损伤。Jena等[11]发现脑梗死患者血清缺血修饰白蛋白(IMA)和MDA的水平明显升高,且两者存在明显的相关性。MDA是脂质过氧化的终产物,可影响线粒体内关键酶的活性,而线粒体功能的破坏与ACI的发生密切相关。
丁苯酞是从芹菜籽中提取的药物,能够穿过人体血脑屏障发挥药效。既往研究发现,丁苯酞可通过清除脂质过氧化自由基、抑制血小板聚集和减弱神经胶质的激活等方面来保护血管内皮细胞,改善缺血区微循环及血流灌注,缩小脑梗死面积,发挥神经保护作用[3]。曹姗等[12]研究显示,丁苯酞可改善急性脑梗死患者超敏C反应蛋白的水平,抑制炎性反应,促进神经细胞功能的恢复。刘悦等[13]发现脑梗死患者经丁苯酞治疗14 d后,血清神经元特异烯醇化酶(NSE)、IL-6和TNF-α的水平较常规治疗组明显下降。目前,有关丁苯酞对脑梗死患者氧化应激水平影响的研究较少。Zhao等[14]发现丁苯酞可改善脑缺血模型大鼠大脑皮质和海马神经元形态,增加胆碱乙酰转移酶的活性,降低MDA和β淀粉样蛋白的水平,提高大鼠认知能力。Sun等[15]通过大鼠骨髓干细胞(rBMSCs)的氧化应激损伤,建立体外脑缺血模型,经丁苯酞干预后细胞凋亡及氧化应激水平明显下降。郑小影等[16]通过建立大鼠脑缺血再灌注模型,经丁苯酞干预后,神经功能缺损评分和梗死体积均减少、超氧化物歧化酶(SOD)活性升高、MDA含量下降。本研究中,笔者发现2组经过治疗后,血清 IL-6、IL-17、IL-23、MDA 的水平均出现一定下降,且同一时间点丁苯酞组较常规治疗组下降更加明显。结合笔者以往的临床经验,ACI患者在使用丁苯酞一个疗程以后,脑卒中评分(NIHHS)下降明显,且无明显的不良反应[5]。最近Abdoulaye等[3]总结并提出丁苯酞主要通过抗血小板聚集和血栓形成、维持线粒体正常功能、抑制神经细胞凋亡、减少氧化应激产物的生成等方面来延缓ACI患者的疾病进展。结合本研究结果,笔者认为丁苯酞可通过抑制炎症因子的表达,降低大脑的氧化应激水平来改善脑梗死患者的临床症状。但是本研究的样本量有限,另外抗血小板聚集及降脂药物也有一定的抗炎作用,也可能会影响本研究的结果,加之丁苯酞的价格较贵,临床应用还需考虑患者的经济条件。
[1]Anolescu BN,Beneanu M,DumitruL,et al.Dynamics of inflammatory markers in post-acute stroke patients undergoing rehabilitation[J].Inflammation,2011,34(6):551-558.doi:10.1007/s10753-010-9262-8.
[2]Gelderblom M,Daehn T,Schatfling B,et al.Plasma levels of neuron specific enolase quantify the extent of neuronal injury in routine models of ischemic stroke and multiple sclerosis[J].Neurobiol Dis,2013,59:177-182.doi:10.1016/j.nbd.2013.07.017.
[3]AbdoulayeIA,Guo YJ.A review ofrecentadvancesin neuroprotective potential of 3-N-Butylphthalide and its derivatives[J].Biomed Res Int,2016,2016:5012341.doi:10.1155/2016/5012341.
[4]王以翠,常焕显,孔令胜,等.阿加曲班对急性脑梗死患者血管内皮功能及炎症因子的影响[J].中山大学学报(医学科学版),2015,36(6):870-876.Wang YC,Chang HX,Kong LS,et al.Effectofargatroban on vascularendothelialfunction and inflammatory factors in patients with acute cerebral infarction[J].Journal of Sun Yat-sen University(Medical Sciences),2015,36(6):870-876.
[5]安文峰.丁苯酞氯化钠注射液治疗急性缺血性脑卒中临床疗效观察[J].中国实用神经疾病杂志,2016,19(10):121.An WF.Clinical observation of Butylphthalide phthalein sodium chloride in treatment of acute ishemic stroke[J].Chinese Journal of Practical Nervous Diseases,2016,19(10):121.doi:10.3969/j.issn.1673-5110.2016.10.081.
[6]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中华神经科杂志,2010,43(2):146-153.Guidelines for diagnosis and treatment of acute ischemic stroke writing group of cerebralvascular disease study group of neurology branch of Chinese Medical Association.Guidelines for diagnosis and treatment of acute ischemic stroke in 2010[J].Chin J Neurol,2010,43(2):146-153.
[7]Lambertsen KL,Biber K,Finsen B.Inflammatory cytokines in experimental and human stroke[J].J Cereb Blood Flow Metab,2012,32(9):1677-1698.doi:10.1038/jcbfm.2012.88.
[8]Boehme AK,McClure LA,Zhang Y,et al.Inflammatory markers and outcomes after lacunar stroke:levels of inflammatory markers in treatment of stroke study[J].Stroke,2016,47(3):659-667.doi:10.1161/STROKEAHA.115.012166.
[9]Gu L,Wu Y,Hu S,et al.Analysis of association between MAP2K4 gene polymorphism rs3826392 and IL-1b serum level in southern Chinese Han ischemic stroke patients[J].J Stroke Cerebrovasc Dis,2016,25(5):1096-1101.doi:10.1016/j.jstrokecerebrovasdis.2015.12.035.
[10]Jiang C,Kong W,Wang Y,et al.Changes in the cellular immune system and circulating inflammatory markers of stroke patients[J].Oncotarget,2017,8(2):3553-3567.doi:10.18632/oncotarget.12201.
[11]Jena I,Nayak SR,Behera S,et al.Evaluation of ischemia-modified albumin,oxidative stress,and antioxidant status in acute ischemic stroke patients[J].J Nat Sci Biol Med,2017,8(1):110-113.doi:10.4103/0976-9668.198346.
[12]曹姗,董辉.丁苯酞注射液对急性脑梗死疗效及超敏C反应蛋白的影响[J].中国药业,2016,25(2):30-32.Cao S,Dong H.Efficacy of butylphthalide injection in treating acute cerebral infarction and its influence on high sensitivity reactive C protein[J].China Pharmaceuticals,2016,25(2):30-32.
[13]刘悦,毕齐.丁苯酞对急性脑梗死患者NSE、IL-6、TNF-α表达水平的影响[J].实用药物与临床,2015,18(12):1436-1438.Liu Y,Bi Q.Effects of butylphthalide on NSE,IL-6 and TNF-α in acute cerebral infarction patients[J].Practical Pharmacy and Clinical Remedies,2015,18(12):1436-1438.doi:10.14053/j.cnki.ppcr.201512009.
[14]Zhao W,Luo C,Wang J,et al.3-N-butylphthalide improves neuronal morphology after chronic cerebral ischemia[J].Neural RegenRes,2014,9(7):719-726.doi:10.4103/1673-5374.131576.
[15]Sun B,Feng M,Tian X,et al.DL-3-n-Butylphthalide protects rat bone marrow stem cells against hydrogen peroxide-induced cell death through antioxidation and activation of PI3K-Akt pathway[J].Neurosci Lett,2012,516(2):247-252.
[16]郑小影,孔维,赵淑敏,等.丁苯酞预处理对脑缺血再灌注大鼠海马微血管构筑和自由基代谢的影响[J].天津医药,2015,43(8):867-870.Zheng XY,Kong W,Zhao SM,et al.Effects of 3-nbutylphthalide pretreatment on microvascular architecture and free radical metabolism in hippocampus induced by cerebral ischemia/reperfusion[J].Tianjin Med J,2015,43(8):867-870.doi:10.11958/j.issn.0253-9896.2015.08.010.
(2017-03-08收稿 2017-04-20修回)
(本文编辑 胡小宁)
Effects of butylphthalide on serum inflammatory cytokines and oxidative stress products in patients with acute cerebral infarction
AN Wen-feng,ZHAI Lu-hui△,MA Yu-chao,GAO Peng-fei
Department of Neurology,Xuchang Central Hospital,Xuchang 461000,China△
E-mail:zhailuhui@sohu.com
ObjectiveTo investigate the effects of butylphthalide injection on serum levels of inflammatory factors and oxidative stress products in patients with acute cerebral infarction.MethodsA total of 120 patients with acute cerebral infarction were selected in our hospital from March 2014 to September 2016.Patients were divided into conventional treatment group(n=56)and butylphthalide group(n=64)according the therapeutic methods.The conventional treatment group was treated with improving microcirculation and resisting blood platelet aggregation,while the butylphthalide group was injected with butylphthalide(100 mL intravenous drip,twice a day)on the basis of conventional treatment.The levels of tumor necrosis factor(TNF)-α,interleukin(IL)-6,IL-17,IL-23 and methane dicarboxylic aldehyde(MDA)were detected before the treatment and 7 days,14 days after the treatment.The clinical efficacy was also accessed.ResultsThe TNF-α,IL-6,IL-17,IL-23 and MDA levels were significantly decreased 7 days and 14 days after the treatment than those before the treatment in two groups of patients(P<0.05).And the above indexes were also decreased in butylphthalide group than those of conventional treatment group(P<0.05).No obvious adverse reactions were observed in two groups.ConclusionButylphthalide can improve the clinical symptoms through the inhibition of inflammation and oxidative stress in patients with acute cerebral infarction.
brain infarction;inflammation;tumor necrosis factor-alpha;interleukin-6;interleukin-17;malondialdehyde;oxidative stress;butylphthalide
R743.33
:A
10.11958/20170308
河南省许昌市中心医院神经内科(邮编461000)
安文峰(1976),男,本科,副主任医师,主要从事脑血管疾病的预防与治疗方面研究
△通讯作者 E-mail:zhailuhui@sohu.com



