杨丽军,禇丽萍,王婧,任春华,王中强,黄帆
据美国抗癌协会统计显示,癌症已成为人类最为致命的疾病[1],而癌症治疗一直以来都是一个巨大的挑战。近年来,随着纳米技术的发展,纳米药物引起了研究者越来越多的关注。通过物理包裹或化学键合的方式将传统化疗药[阿霉素(DOX)、紫杉醇、喜树碱等][2]负载到纳米粒上,即可方便地制得纳米抗癌药,不仅提高了疏水性化疗药在体内的溶解度和稳定性[3],而且能利用纳米材料独有的血液长循环能力和增强渗透滞留(EPR)效应在肿瘤组织高效富集[4],从而提高了化疗药的生物利用度,同时降低了其对正常组织的毒副作用。最近,研究者发现广谱抗菌剂纳米银(Ag NPs)具有良好的抗肿瘤效果[5-6]。尽管其抗肿瘤机制尚不明确,但一般认为Ag NPs能够很容易地进入肿瘤细胞,促进细胞内活性氧(ROS)的产生,从而不可逆地诱导细胞凋亡和坏死[7]。基于DOX和Ag NPs的抗肿瘤活性,Badiger课题组[8]及Mamdouh课题组[9]均通过静电吸附作用将DOX负载到Ag NPs表面,制备出联合抗肿瘤药物。然而,该药物存在生理稳定性较差及难以在肿瘤组织特异性释放DOX的缺点,大大限制了其应用前景。鉴于硫辛酰肼(LA-NHNH2)的酰肼基团能够与DOX的羰基形成具有酸敏感的腙键,且其硫原子(S)能够与银(Ag)形成稳定的Ag-S键,因此,本实验拟在LA-NHNH2的两端分别以化学键连接Ag NPs和DOX,制备一种生理稳定性好且具有pH响应性的阿霉素-纳米银(DOX-Ag NPs)联合抗肿瘤药物,通过噻唑蓝比色法比较该纳米抗癌药与单一的Ag NPs及DOX的抗肿瘤活性,从而为临床肿瘤治疗提供新的研究思路和方法。
1 材料与方法
1.1 材料
1.1.1 试剂 DOX·HCl、硝酸银(AgNO3)、柠檬酸钠(Na3C6H5O7·2H2O)、硼氢化钠(NaBH4)、硫辛酸(LA)、N,N’-二环己基碳酰亚胺(DCC)、4-二甲氨基吡啶(DMAP)购自于百灵威科技有限公司;巯基聚乙二醇(PEG-SH,相对分子质量为2 000)购自于上海炎怡生物科技有限公司;水合肼(NH2NH2·H2O)、无水甲醇(MeOH)、无水乙醇(EtOH)、三氟乙酸(TFA)等其他化学试剂均购自于天津江天化工技术有限公司;磷酸盐缓冲液(PBS)、噻唑蓝(MTT)购自于北京索莱宝科技有限公司;人肝癌HepG2细胞为实验室自有。
1.1.2 仪器 超纯水仪(Merck Instrument,德国);300 MHz核磁共振波谱仪(Bruker Instrument,德国);液质联用仪(AB Sciex Instrument,美国);动态光散射粒度仪(Malvern Instrument,英国);紫外-可见分光光度计(Shimadzu Instrument,日本);荧光分光光度计(Shimadzu Instrument,日本);电感耦合等离子体发射光谱仪(PerkinElmer Instrument,美国);透射电子显微镜(TEM,FEIInstrument,美国);全波长多功能酶标仪(Thermo Scientific Instrument,美国)。
1.2 方法
1.2.1 硫辛酰肼-阿霉素(LA-NHN=DOX)的合成及表征 LA-NHN=DOX的合成路线见图1[10]。首先,称取LA(3.09 g,15 mmol)、EtOH(10.4 g,225 mmol)及 DMAP(0.92 g,7.5 mmol)溶于120 mL二氯甲烷(CH2Cl2)中,0℃下滴加含DCC(4.63 g,23 mmol)的CH2Cl2(30 mL)溶液,0℃下搅拌反应1 h后室温下继续反应24 h,过滤除去反应沉淀,滤液经过旋蒸脱除溶剂以及硅胶柱层析纯化(淋洗液为体积比15∶1的石油醚和乙酸乙酯)得到黄色油状产物硫辛酸乙酯(LACOOEt),产率为81%。然后,将LACOOEt(2.96 g,12.7 mmol)溶于 MeOH(50 mL)中,加入 NH2NH2·H2O(4.3 mL),40℃下搅拌反应过夜,加入水淬灭反应并用乙酸乙酯萃取3次,收集的有机相用饱和氯化钠溶液洗涤2次,经无水硫酸镁干燥、旋蒸脱除溶剂以及硅胶柱层析纯化(淋洗液为体积比15∶1的CH2Cl2和MeOH为淋洗液)得到黄色固体产物LANHNH2,产 率 为 83%。 最 后 ,将 LA-NHNH2(132 mg,0.6 mmol)和DOX·HCl(116 mg,0.2 mmol)溶于MeOH(30 mL)中,加入TFA(50µL),室温下避光反应24 h。反应液浓缩至1 mL并逐滴加入到乙腈(25 mL)中,得到的悬浮液在4℃冰箱中静置过夜,离心获得的红色固体用乙腈多次洗涤便可得到最终的目标产物LA-NHN=DOX,产率为72%。通过核磁氢谱(1H NMR)和高分辨质谱(HRMS)对终产物LA-NHN=DOX进行化学结构确证。
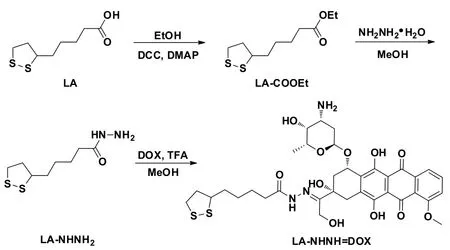
Fig.1 Thesynthetic routeof LA-NHN=DOX[10]图1 LA-NHN=DOX的合成路线[10]
1.2.2 Ag NPs的制备及表征 首先,以超纯水为溶剂,分别配置AgNO3溶液(0.25 mmol/L)、Na3C6H5O7·2H2O溶液(0.31 mmol/L)及NaBH4溶液(0.25 mmol/L),4℃下避光静置1 h。然后,将AgNO3溶液(100 mL)和Na3C6H5O7溶液(100 mL)加入到500 mL圆底烧瓶中,剧烈搅拌下快速加入NaBH4溶液(6 mL),室温下搅拌反应10 min后加热至沸腾,继续搅拌反应1.5 h,随后冷却至4℃,避光静置过夜便可得到以Na3C6H5O7为稳定剂的Ag NPs溶液。最后,剧烈搅拌下向上述Ag NPs溶液中滴加4 mL PEG2000-SH(2.8 mg,1.4 µmol)水溶液,室温下反应12 h,采用截留相对分子质量为3 500的透析袋对上述混合溶液进行透析,除去游离化合物,便可制得最终以PEG为稳定剂的Ag NPs溶液[11-12]。通过动态光散射(DLS)和TEM分析Ag NPs的粒径和形貌;通过电感耦合等离子体质谱(ICP-MS)测定Ag NPs溶液中的Ag含量;通过电位仪测定Ag NPs的ζ-电位;通过紫外-可见吸收光谱表征Ag NPs的光学性质。
1.2.3 DOX-Ag NPs的制备及表征 剧烈搅拌下向Ag NPs溶液(10 mL)中滴加2 mL LA-NHN=DOX(746 µg,1 µmol)MeOH溶液,室温下反应12 h,采用截留相对分子质量为3 500的透析袋对上述混合溶液进行透析,除去游离的LANHN=DOX分子,便可得到DOX-Ag NPs溶液。通过DLS和TEM分析DOX-Ag NPs的粒径和形貌;通过ICP-MS测定DOX-Ag NPs溶液中的Ag含量;通过电位仪测定DOX-Ag NPs的ζ-电位;通过紫外-可见吸收光谱和荧光光谱表征DOX-Ag NPs的光学性质。
1.2.4 体外药物释放实验 取6份DOX-Ag NPs溶液(3 mL)装入截留相对分子质量为3 500的透析袋中,将其中3份分别置于装有50 mLPBS(pH 7.4)的烧杯中,另外3份分别置于装有50 mL PBS(pH 5.5)的烧杯中,37℃恒温震荡,于不同时间点取出定量释放液,同时向烧杯中补充等体积的相应PBS缓冲液。利用荧光分光光度计测定释放液中游离DOX的荧光强度,并结合标准曲线(DOX荧光强度-DOX浓度),检测不同时间DOX的释放量并绘制释放曲线。
1.2.5 体外抗肿瘤实验 取人肝癌HepG2细胞,用含10%胎牛血清、100 U/mL青霉素和100 mg/L链霉素的DMEM培养细胞,置于37℃、5%CO2、饱和湿度的CO2培养箱中培养。取对数生长期细胞以每孔5×103个接种于96孔板内,培养24 h后,向孔内分别加入一系列浓度梯度(按照DOX的浓度为0、0.1、0.5、1、2、5、10、20 mg/L)的DOX、Ag NPs(Ag NPs量取决于加入的DOX-Ag NPs量,两者的Ag浓度保持一致)和DOX-Ag NPs,培养箱内孵育24 h后,每孔加入20µL MTT溶液(5 g/L)继续培养4 h,弃去上清液后每孔加入150µL二甲基亚砜(DMSO),充分震荡后用酶标仪检测570 nm下各孔的吸光度(A)值。每个浓度设置6个复孔,根据公式计算每个浓度下的细胞生存率并绘制生存率曲线。细胞生存率=实验组A平均值/对照组A平均值×100%。
1.3 统计学方法 采用SPSS 19.0软件处理数据,并进行统计学分析。实验数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 LA-NHN=DOX的合成及结构表征 LANHN=DOX的1H NMR谱见图2,具体数据为:1H NMR(300 MHz,DMSO)δ14.11(d,J=1.6 Hz,1H),13.32(s,1H),10.33(s,1H),8.02~7.93(m,3H),7.91~7.87(m,2H),7.67~7.61(m,1H),5.82(t,J=4.6 Hz,1H),5.57(s,1H),5.49(d,J=5.7 Hz,1H),5.33~5.27(m,1H),4.97~4.88(m,1H),4.46~4.33(m,2H),4.08~4.00(m,1H),3.96(s,3H),3.61~3.57(m,1H),3.29(d,J=18.1 Hz,1H),3.12~3.02(m,2H),2.73(d,J=17.3 Hz,1H),2.30~2.21(m,2H),2.19~2.07(m,2H),1.95~1.80(m,2H),1.76~1.66(m,2H),1.57~1.50(m,1H),1.45~1.39(m,1H),1.37~1.26(m,3H),1.21~1.09(m,5H);通过HRMS在746.275 6处检测到分子离子峰,与[LA-NHN=DOX+H+]理论相对分子质量746.241 2相一致;1H NMR和HRMS均证明了LA-NHN=DOX的成功合成。
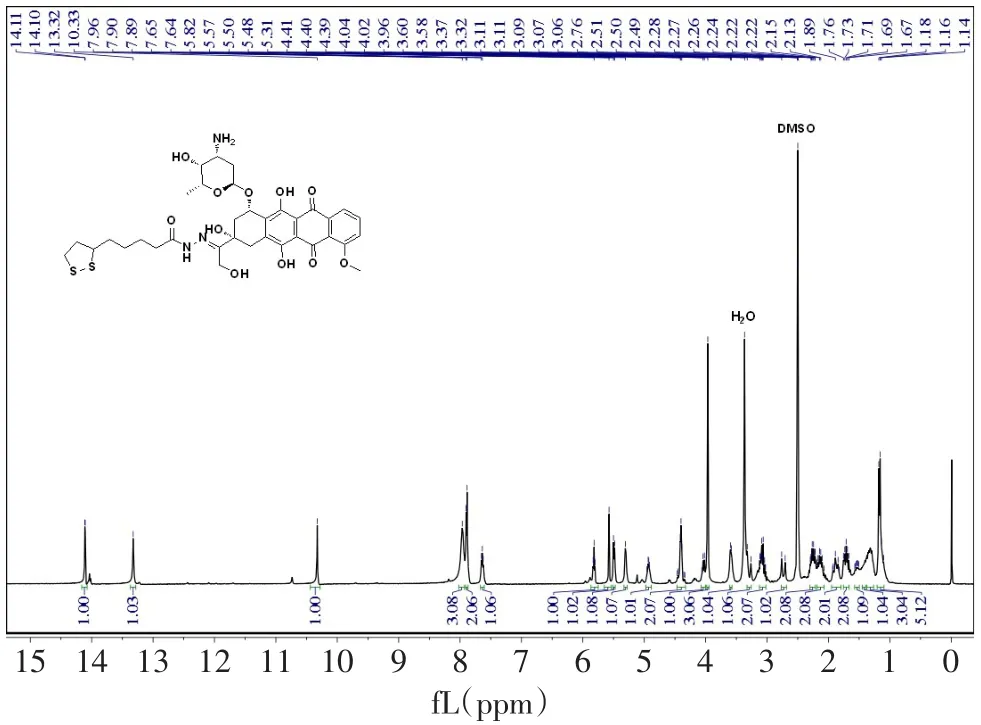
Fig.2 1H NMRspectraof compound LA-NHN=DOX图2 化合物LA-NHN=DOX的核磁共振氢谱
2.2 Ag NPs及DOX-Ag NPs的表征 通过DLS表征Ag NPs的粒径为(32.3±2.5)nm,分布指数(PDI)为0.29,DOX-Ag NPs的粒径为(40.4±3.8)nm,PDI为0.54,DOX-Ag NPs的粒径较Ag NPs增大(t=3.084,n=3,P<0.05),见图3。TEM镜下可见两种纳米粒均为球形结构,且分布均匀无聚集现象,测得的Ag NPs的粒径为(19.3±2.1)nm,DOX-Ag NPs的粒径为(20.1±1.8)nm,见图4。Ag NPs及DOX-Ag NPs的表面电荷分布存在明显不同,通过电位仪测得两者的ζ-电位分别为(-1.2±0.7)mV和(15.8±0.9)mV。从紫外-可见吸收光谱可知,Ag NPs的最大吸收波长为403 nm,而DOX-Ag NPs的最大吸收波长稍有红移,为416 nm,且在480 nm处DOX-Ag NPs的吸光度(0.254)明显大于Ag NPs的吸光度(0.151),见图5。两者的荧光发射光谱见图6,在484 nm波长激发下,游离DOX分子在590 nm处出现最大荧光发射峰,而DOX-Ag NPs上的DOX荧光强度明显降低(由9 888降为1 633)。此外,通过ICP-MS测得Ag NPs和DOX-Ag NPs的银浓度分别为18 mg/L和13 mg/L。
2.3 体外药物释放实验 通过透析法结合荧光光谱检测DOX-Ag NPs在不同pH下的DOX累积释放率,结果见图7。37℃下,在不同pH的PBS中,随着时间的延长,DOX的累积释放率均不断升高,但pH5.5下DOX的释放速度明显快于pH 7.4下DOX的释放速度。48 h后,pH 7.4下DOX累积释放率为(33.0±3.0)%,而在pH 5.5下DOX累积释放率可达(65.0±2.8)%。
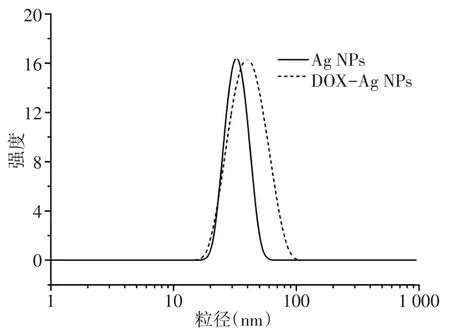
Fig.3 Hydrodynamic sizedistributionsof Ag NPs and DOX-Ag NPs图3 Ag NPs及DOX-Ag NPs的粒径分布
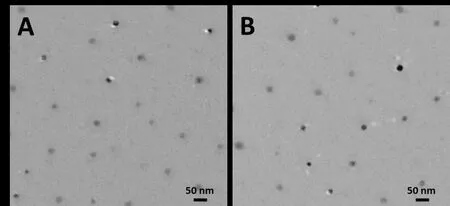
Fig.4 TEM imagesof Ag NPs(A)and DOX-Ag NPs(B)图4 Ag NPs(A)及DOX-Ag NPs(B)的TEM照片
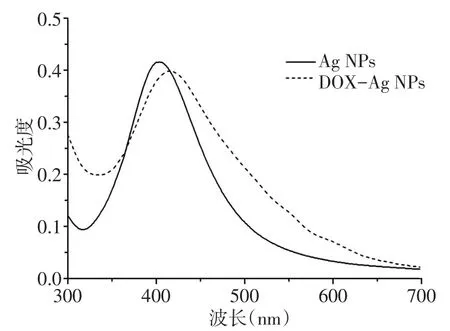
Fig.5 UV-vis absorption spectraof Ag NPsand DOX-Ag NPs图5 Ag NPs及DOX-Ag NPs的紫外-可见吸收光谱
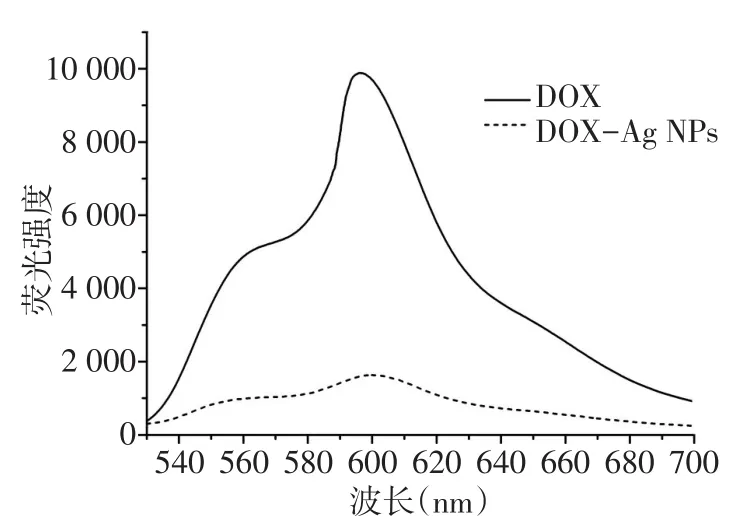
Fig.6 Fluorescencespectraof DOX and DOX-Ag NPs图6 DOX及DOX-Ag NPs的荧光光谱
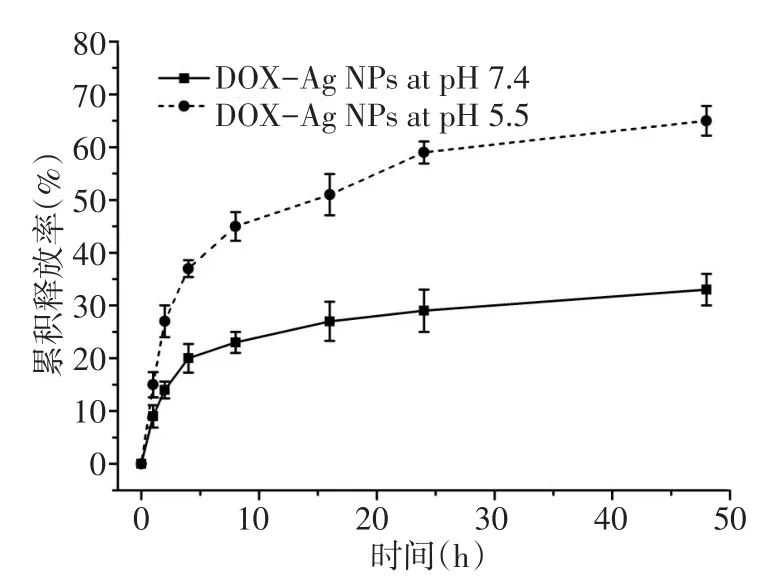
Fig.7 DOX releaseprofiles of DOX-Ag NPsat pH 7.4 or pH 5.5图7 DOX-Ag NPs中DOX在pH 7.4及pH 5.5下的释放曲线
2.4 体外抗肿瘤实验 DOX、Ag NPs和DOX-Ag NPs对HepG2细胞的增殖抑制均呈现明显的浓度依赖性,DOX及Ag的浓度越高,细胞生存率越低。当DOX浓度为0 mg/L时,3组间细胞生存率差异无统计学意义;当DOX浓度为0.1 mg/L(Ag浓度为0.09 mg/L)时,Ag NPs组细胞生存率高于DOX组,DOXAg NPs组细胞生存率低于Ag NPs组(P<0.05),与DOX组差异无统计学意义;在其他浓度下,Ag NPs组细胞生存率均高于DOX组,DOX-Ag NPs组均低于DOX组和Ag NPs组(均P<0.05)。见图8。
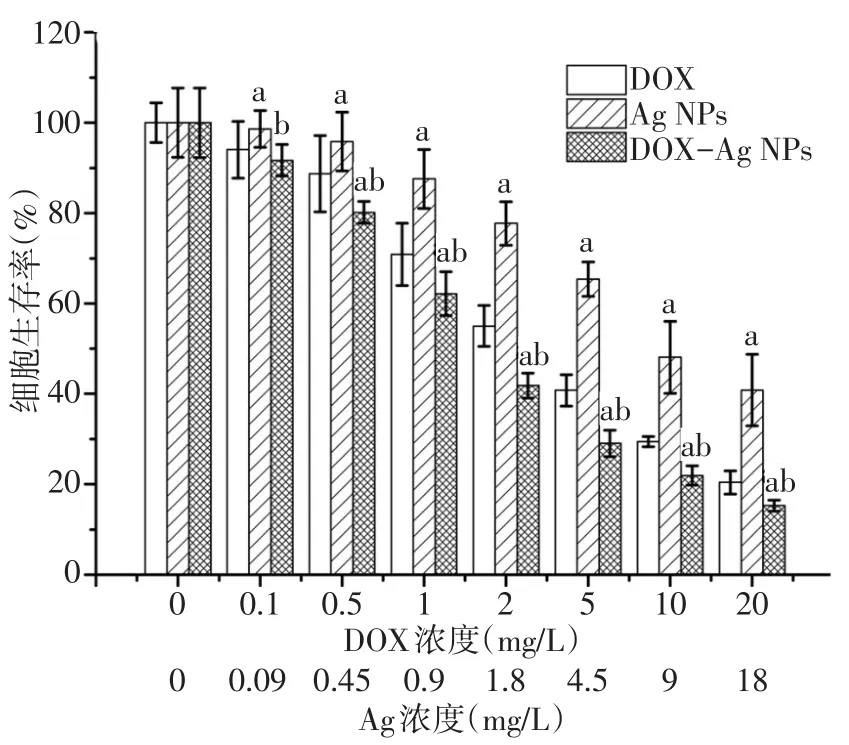
Fig.8 Comparison of theeffects of DOX,Ag NPs and DOX-Ag NPson survival ratesof HepG2 cells图8 DOX、Ag NPs和DOX-Ag NPs对HepG2细胞的生存率影响比较
3 讨论
与单一疗法相比,多种药物的联合治疗是一种更为有效的癌症治疗方法,原因是联合治疗过程中,各种药物不仅能发挥协同治疗效果,而且药物用量低,毒副作用小[13]。之前基于DOX和Ag NPs联合抗肿瘤的研究中,均是通过静电吸附作用将DOX负载到Ag NPs表面。然而,由于静电作用力较弱,导致DOX-Ag NPs生理稳定性较差,DOX易泄漏。此外,上述DOX-Ag NPs不具有肿瘤pH环境响应性,不能在肿瘤组织特异性释放药物,降低了治疗效果的同时也增加了对正常组织的毒副作用,大大限制了其应用前景。本研究所制备的具有pH响应性的DOX-Ag NPs联合抗肿瘤纳米药物不仅保持了纳米药物体内长循环和通过EPR效应靶向肿瘤的能力,而且由于DOX是通过化学键连的方式负载,DOXAg NPs的生理稳定性得到提升。此外,DOX-Ag NPs的pH响应特性使DOX能够特异性地在肿瘤组织中释放,减少了药物在体循环过程中的泄漏,降低了对正常组织的毒副作用[14]。
本研究中LA-NHN=DOX的1H NMR数据与文献[10]报道一致,且通过HRMS检测到746.275 6处的分子离子峰与[LA-NHN=DOX+H+]理论相对分子质量746.241 2相一致,证明了LA-NHN=DOX的成功合成。通过材料表征可以发现,DOX-Ag NPs的粒径较Ag NPs增大,说明DOX成功负载到Ag NPs上。值得注意的是,由DLS测得的粒径大于由TEM测得的粒径,原因是纳米粒在水中处于溶胀状态,DLS测得的是其水合粒径,而TEM测试采用的是干燥样品,制样过程中纳米粒收缩,导致测得的粒径偏小。负载上DOX之后,纳米银的ζ-电位由(-1.2±0.7)mV增大到(15.8±0.9)mV,原因是DOX分子上的氨基带正电荷,DOX的成功负载增加了纳米银表面的正电荷数目。DOX-Ag NPs的紫外-可见吸收峰为416 nm,且在480 nm处的吸光度较Ag NPs大,分别与典型的纳米银最大吸收波长[15]和DOX最大吸收波长[16]相符合,进一步证明DOX已成功负载到Ag NPs上。DOX-Ag NPs上的DOX荧光强度明显低于游离DOX的荧光强度,原因是DOX与Ag NPs之间存在强烈的共振能量转移[17],导致DOX荧光被淬灭。
基于肿瘤组织弱酸性的特点,用pH 5.5的PBS模拟肿瘤微环境,pH 7.4的PBS模拟正常生理条件。药物释放实验结果表明,DOX-Ag NPs在弱酸性环境中能够快速释放出DOX,这主要是因为LANHN=DOX分子中的腙键具有酸敏感性[18],能够在酸性条件下发生断裂,从而加速了DOX的释放。该纳米抗癌药在正常生理环境中DOX释放缓慢,有利于延长血液循环时间,增加在肿瘤部位的富集;而一旦到达肿瘤组织,便能够在肿瘤弱酸性环境中快速释放出DOX,发挥抗肿瘤活性。利用体循环与肿瘤微环境之间存在的pH梯度,便可实现抗癌药物DOX的可控性释放。
体外抗肿瘤结果显示,DOX-Ag NPs具有较游离DOX及Ag NPs更好的肿瘤细胞增殖抑制效果,这主要是由于DOX-Ag NPs既能发挥DOX破坏细胞DNA的功能,还能通过Ag NPs促进细胞内ROS的产生,从而对肿瘤细胞进行联合杀伤。此外,游离DOX受到水溶性影响,杀伤作用受到限制,降低了其抗肿瘤效果。
本课题制备的DOX-Ag NPs是一种有效的联合抗肿瘤纳米制剂,能够将DOX和Ag NPs稳定结合,并通过其酸敏感的特性在肿瘤部位智能释放药物,为基于纳米银的抗癌药物的合理设计提供了有益的借鉴,值得进行深入探究。
[1]DeSantis CE,Siegel RL,Sauer AG,et al.Cancer statistics for African Americans,2016:progress and opportunities in reducing racial disparities[J].CA Cancer J Clin,2016,66(4):290-308.doi:10.3322/caac.21340.
[2]Jia T,Huang S,Yang C,et al.Unimolecular micelles of amphiphilic cyclodextrin-core star-like copolymers with covalent pH-responsive linkage of anticancer prodrugs[J].Mol Pharm,2017,14(8):2529-2537.doi:10.1021/acs.molpharmaceut.6b00708.
[3]Yang L,GaoY,Liu J,et al.Silver-coated nanoparticles combined with doxorubicin for enhanced anticancer therapy[J].J Biomed Nanotechnol,2018,14(2):312-320.doi:10.1166/jbn.2018.2481.
[4]Yu H,Tang Z,Li M,et al.Cisplatin loaded poly(L-glutamic acid)-g-methoxy poly(ethylene glycol) complex nanoparticles for potential cancer therapy:preparation,in vitro and in vivo evaluation[J].J Biomed Nanotechnol,2016,12(1):69-78.doi:10.1166/jbn.2016.2152.
[5]刘金华,郭倩倩,华海婴,等.穿膜肽提高纳米银穿膜活性的研究[J].中国现代应用药学,2012,29(10):865-868.Liu JH,Guo QQ,Hua HY,et al.The penetrating activity of nano-silver mediated by cell penetrating peptide[J].Chin JMAP,2012,29(10):865-868.doi:10.13748/j.cnki.issn1007-7693.2012.10.002.
[6]Farkhani SM,Fard AA,Zakeri-Milani P,et al.Enhancing antitumor activity of silver nanoparticles by modification with cellpenetrating peptides[J].Artif Cells Nanomed Biotechnol,2017,45(5):1029-1035.doi:10.1080/21691401.2016.1200059.
[7]Wei L,Lu J,Xu H,et al.Silver nanoparticles:synthesis,properties,and therapeutic applications[J].Drug Discov Today,2015,20(5):595-601.doi:10.1016/j.drudis.2014.11.014.
[8]Gupta NR,Prasad BLV,Gopinath CS,et al.A nanocomposite of silver and thermo-associating polymer by a green route:a potential soft-hard material for controlled drug release[J].RSCAdv,2014,4(20):10261-10268.doi:10.1039/C3RA45022H.
[9]Elbaz NM,Ziko L,Siam R,et al.Core-shell silver/polymeric nanoparticles-based combinatorial therapy against breast cancer invitro[J].Sci Rep,2016,6:30729-30737.doi:10.1038/srep30729.
[10]Cui T,Liang JJ,Chen H,et al.The performance of doxorubicin-conjugated gold nanoparticles:regulation of drug location[J].ACS Appl Mater Interfaces,2017,9(10):8569-8580.doi:10.1021/acsami.6b16669.
[11]Cumberland SA,Lead JR.Particle size distributions of silver nanoparticles at environmentally relevant conditions [J].J Chromatogr A,2009,1216(52):9099-9105.doi:10.1016/j.chroma.2009.07.021.
[12]Fernandez-Lopez C,Mateo-Mateo C,Alvarez-Puebla RA,et al.Highly controlled silica coating of PEG-capped metal nanoparticles and preparation of SERS-encoded particles[J].Langmuir,2009,25(24):13894-13899.doi:10.1021/la9016454.
[13]Lv S,Tang Z,Li M,et al.Co-delivery of doxorubicin and paclitaxel by PEG-polypeptide nanovehicle for the treatment of non-small cell lung cancer[J].Biomaterials,2014,35(23):6118-6129.doi:10.1016/j.biomaterials.2014.04.034.
[14]刘金剑,张玉民,杨翠红,等.酸敏感阿霉素前药纳米粒的合成及其在治疗脑胶质瘤中的作用[J].天津医药,2016,44(1):33-37.Liu JJ,Zhang YM,Yang CH,et al.Synthesis of acid-sensitive doxorubicin prodrug nanoparticle and its application in brain glioma treatment[J].Tianjin Med J,2016,44(1):33-37.doi:10.11958/20150109.
[15]Medina-Ramirez I,Bashir S,Luo Z,et al.Green synthesis and characterization of polymer-stabilized silver nanoparticles[J].Colloids Surf B Biointerfaces,2009,73(2):185-191.doi:10.1016/j.colsurfb.2009.05.015.
[16]Wang C,Cheng L,Liu Z.Drug delivery with upconversion nanoparticles for multi-functional targeted cancer cell imaging and therapy[J].Biomaterials,2011,32(4):1110-1120.doi:10.1016/j.biomaterials.2010.09.069.
[17]Wang C,Tang F,Wang X,et al.Self-assembly of fluorescent hybrid core-shell nanoparticles and their application[J].ACSAppl Mater Interfaces,2015,7(24):13653-13658.doi:10.1021/acsami.5b03440.
[18]Ge Z,Liu S.Functional block copolymer assemblies responsive to tumor and intracellular microenvironments for site-specific drug delivery and enhanced imaging performance[J].Chem Soc Rev,2013,42(17):7289-7325.doi:10.1039/C3CS60048C.



