王晶,徐超,李晓红,涂悦,陈翀,马铁柱,王丽娜,朱旭,任吉滨,许子宁,杨慧云,张赛△
颅脑创伤(traumatic brain injury,TBI)是世界范围内严重的公共卫生问题,是导致我国青壮年死亡及致残的主要原因之一,给社会和家庭带来了沉重负担[1]。神经发生主要包括神经干细胞(neural stem cells,NSCs)增殖、迁移、分化及存活等多个过程,内源性神经干细胞的增殖和分化使新生神经元(newborn neurons)在哺乳动物大脑中持续存在[2]。研究证实TBI后海马齿状回(dentate gyrus,DG)区神经发生增加,神经元前体细胞在损伤侧DG区聚集并整合入现有神经网络中,海马区新生神经元长期存活及成熟可能有助于TBI后神经功能恢复[3-4]。亚低温(mild hypothermia,MHT)具有抑制TBI后继发性损伤过程中某些破坏性代谢途径的潜力,进而影响神经发生过程,发挥神经保护作用[5]。本研究旨在探讨MHT是否可促进TBI后海马DG区新生神经元细胞长期存活及成熟,进而促进TBI后神经功能恢复,以期探讨MHT疗法减缓TBI的有效性及其机制。
1 材料与方法
1.1 实验动物及材料 59只SPF级成年雄性Sprague Dawley(SD)大鼠,体质量240~280 g,均购自解放军军事医学科学院实验动物中心。采用随机数字表法分为假手术(sham)组(n=15)、TBI组(n=22)及TBI+MHT组(n=22)。MODEL01-B液压颅脑损伤仪由美国弗吉利亚大学医学院研制,T1型亚低温治疗仪购于中国珠海黑马(Hema)公司。大鼠抗5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU)抗体、兔抗NeuN抗体(Abcam,英国);FITC标记山羊抗大鼠IgG二抗、山羊抗兔IgG二抗、核荧光染料4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI;Invitrogen,美国)。
1.2 动物模型的建立 TBI组及TBI+MHT组动物称体质量,5%水合氯醛(7 mL/kg)经腹腔注射麻醉,固定头部。备皮消毒,头皮正中切口3 cm,剥离骨膜,以前囟后3.8 mm、中线右侧2.5 mm为中心,开直径4.0 mm圆形骨窗,暴露完整硬脑膜。置内径2.6 mm打击管,增强型牙科磷酸锌水门汀将打击管固定于颅骨上,管内充满生理盐水,连接液压冲击脑损伤仪(2.0 atm,1 atm=101.325 kPa)打击骨窗建立重型TBI模型,TBI后骨蜡止血,逐层缝合手术切口并消毒。sham组动物暴露完整硬脑膜后直接逐层缝合手术切口并消毒,不进行液压打击,暴露硬脑膜过程同前。正态分布的计量资料以均数±标准差(±s)表示,2组间均数比较采用独立样本t检验,多组间比较采用单因素方差分析(ANOVA),多组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
1.3 MHT的实施 重型TBI模型建立后,立即将动物置于降温冰毯上接受MHT治疗,降温后直肠目标温度33.5℃,维持4 h,1.5 h内缓慢复温至37℃。MHT治疗过程中若出现呼吸抑制,立即给予经口气管插管,采用小动物呼吸机行机械通气直至产生自主呼吸。所有操作完成后常规喂养动物,自由饮水,白昼与夜晚各12 h,环境温度(37±1)℃。
1.4 Morris水迷宫试验 于造模后21~26 d连续每天训练大鼠记忆水迷宫中隐藏平台的能力,记录从大鼠入水到找到平台所需的时间,即逃避潜伏期。在造模后第28天撤去平台,测量大鼠穿越平台的次数及停留在目标象限中的时间。
1.5 BrdU腹腔注射 标记新生有丝分裂细胞于大鼠造模后连续5 d腹腔注射BrdU,每隔12 h注射1次,每日2次,共10次,剂量150 mg/kg,各组大鼠于造模后1、4、8周分别随机挑选5只,进行大鼠的灌流固定及取材。
1.6 改良神经功能缺损评分评估神经功能恢复情况 TBI组及TBI+MHT组各随机选取12只大鼠,分别于造模后1、2、4周对两组大鼠进行神经功能缺损评分(Modified neurological severity scores,mNSS),评分由运动试验(提尾试验、异常活动)、感觉试验(视觉、触觉及本体感觉)、平衡木试验、反射活动及异常运动组成,得分在0~18分,分值越低表示神经功能越好。
1.7 免疫荧光染色检测大鼠海马BrdU、NeuN表达 选取脑组织切片置于1 mol/L HCl中4℃处理10 min,2 mol/L HCl常温处理10 min,37℃处理20 min,0.01 mol/L硼酸溶液中和10 min,PBS洗5 min× 3次;0.5%TritonX-100浸泡20 min,PBS洗5 min×3次;滴加5%BSA 100µL/片封闭,37℃孵育15 min,用滤纸吸去血清,不洗,直接滴加一抗BrdU(1∶100)、NeuN(1∶200),放入湿盒后置于4℃冰箱过夜;隔日切片室温复苏1 h,PBS洗5 min×3次;滴加二抗,37℃温箱避光50 min,PBS洗5 min× 3次;滴加DAPI,PBS洗5 min× 3次,50%甘油封片。在100倍荧光显微镜下以损伤侧海马作为观察区域,选取连续5张脑组织切片分别计数阳性细胞数,最后算出5张切片的平均阳性细胞数。
1.8 统计学方法 使用SPSS 19.0统计软件进行数据处理,
2 结果
2.1 Morris水迷宫试验结果 与sham组相比,TBI组大鼠的逃避潜伏期显着延长,平台穿越次数及目标象限停留时间均明显减少(P<0.01)。与TBI组相比,TBI+MHT组大鼠的逃避潜伏期缩短(P<0.05),平台穿越次数及目标象限停留时间均增加(P<0.05),见表1。
Tab.1 Comparison of the results of Morris water maze test between three groups表1 各组Morris水迷宫试验结果比较 (n=12,±s)
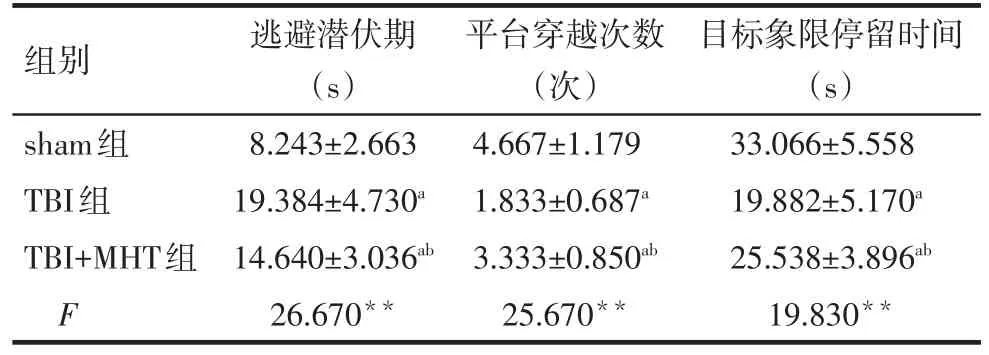
Tab.1 Comparison of the results of Morris water maze test between three groups表1 各组Morris水迷宫试验结果比较 (n=12,±s)
**P<0.01;a与sham组比较,b与TBI组比较,P<0.05
组别sham组TBI组TBI+MHT组F逃避潜伏期(s)8.243±2.663 19.384±4.730a 14.640±3.036ab 26.670**平台穿越次数(次)4.667±1.179 1.833±0.687a 3.333±0.850ab 25.670**目标象限停留时间(s)33.066±5.558 19.882±5.170a 25.538±3.896ab 19.830**
2.2 TBI组及TBI+MHT组mNSS评分比较 因sham组大鼠神经功能无缺损过程,实验进行mNSS评分的目的在于比较大鼠神经功能缺损后的恢复情况,因此未将sham组纳入比较。与TBI组比较,TBI+MHT组大鼠的mNSS评分在损伤后1、2及4周均降低(P<0.01),见表2。
Tab.2 Comparison of modified neurological severity scores between TBI group and TBI+MHT group表2 TBI组及TBI+MHT组mNSS评分比较(n=12,分,±s)
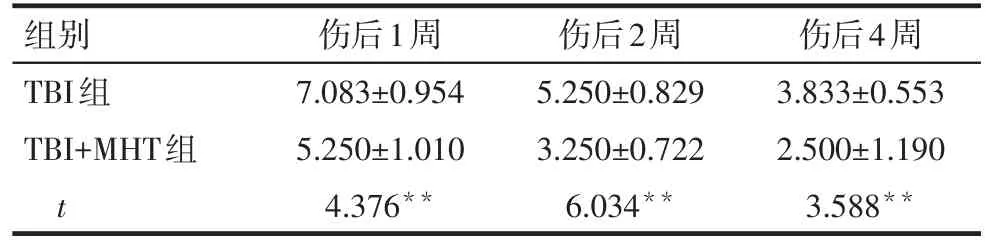
Tab.2 Comparison of modified neurological severity scores between TBI group and TBI+MHT group表2 TBI组及TBI+MHT组mNSS评分比较(n=12,分,±s)
**P<0.01
组别TBI组TBI+MHT组t伤后1周7.083±0.954 5.250±1.010 4.376**伤后2周5.250±0.829 3.250±0.722 6.034**伤后4周3.833±0.553 2.500±1.190 3.588**
2.3 损伤后各组BrdU免疫荧光染色结果 与sham组相比,损伤后1、4、8周TBI组和TBI+MHT组大鼠损伤侧海马齿状回区BrdU阳性细胞均增加,且TBI+MHT组较TBI组显着增加(P<0.05)。此外,TBI组BrdU阳性细胞在损伤后4周及8周较损伤后1周均减少,损伤后8周较损伤后4周减少(P<0.05),而TBI+MHT组在损伤后4周较损伤后1周进一步增加(P<0.05),损伤后8周较损伤后1周及4周无差异,见表3。
2.4 损伤后各组BrdU/NeuN双标记免疫荧光染色结果 损伤后1、4、8周,TBI组及TBI+MHT组大鼠损伤侧海马DG区BrdU/NeuN双标记阳性细胞从颗粒下层(SGZ)逐渐向颗粒细胞层(GCL)移位,见图1。伤后各时间点TBI组及TBI+MHT组BrdU/NeuN双阳性细胞数均较sham组增加,且与TBI组比较,TBI+MHT组双阳性细胞数在各时间点均显着增加(P<0.05)。此外,与损伤后1周相比,TBI组损伤后4周及8周BrdU/NeuN双阳性细胞数减少,而TBI+MHT组双阳性细胞数增加,该两组损伤后8周与损伤后4周比较均无差异,见表4。

Fig.1 Double immunostaining of BrdU/NeuN in injured hippocampus of three groups at each time point after injury(×100)图1 伤后各时间点各组损伤侧海马Brdu/NeuN双标记免疫荧光染色结果(×100)
Tab.3 Comparison of BrdU-labeled cells in injured hippocampus at 1,4 and 8 weeks after injury between three groups表3 伤后1周、4周及8周各组损伤侧海马BrdU阳性细胞表达数比较 (n=5,个,±s)
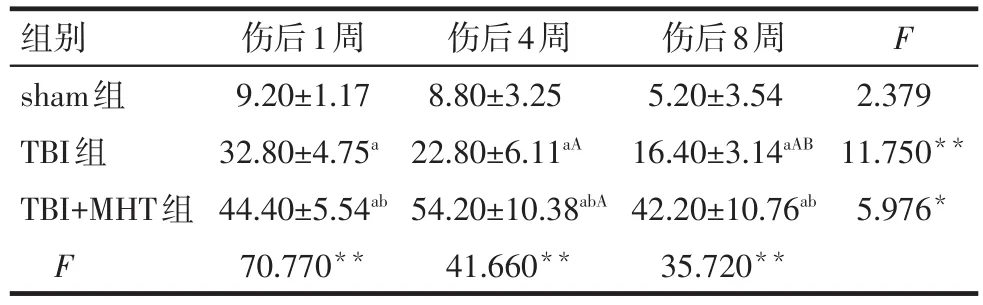
Tab.3 Comparison of BrdU-labeled cells in injured hippocampus at 1,4 and 8 weeks after injury between three groups表3 伤后1周、4周及8周各组损伤侧海马BrdU阳性细胞表达数比较 (n=5,个,±s)
*P<0.05,**P<0.01;a与sham组比较,b与TBI组比较,A与伤后1周比较,B与伤后4周比较,P<0.05
组别sham组TBI组TBI+MHT组F伤后1周9.20±1.17 32.80±4.75a 44.40±5.54ab 70.770**伤后4周8.80±3.25 22.80±6.11aA 54.20±10.38abA 41.660**伤后8周5.20±3.54 16.40±3.14aAB 42.20±10.76ab 35.720**F 2.379 11.750**5.976*
Tab.4 Comparison of Brdu/NeuN double-labeled cells in injured hippocampus at 1,4 and 8 weeks after injury between three groups表4 伤后1周、4周及8周各组损伤侧海马Brdu/NeuN双标记细胞表达数比较 (n=5,个,±s)
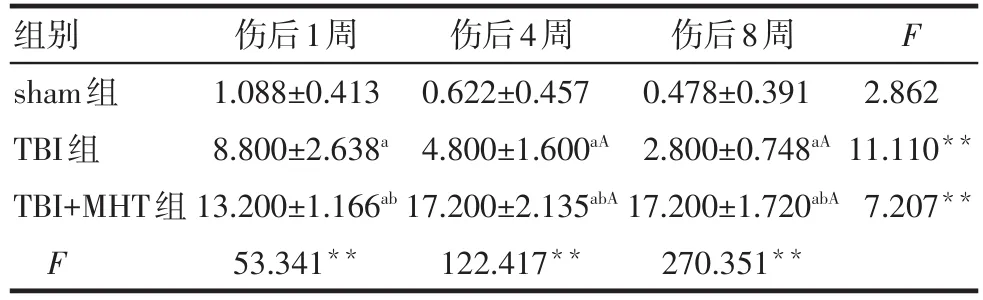
Tab.4 Comparison of Brdu/NeuN double-labeled cells in injured hippocampus at 1,4 and 8 weeks after injury between three groups表4 伤后1周、4周及8周各组损伤侧海马Brdu/NeuN双标记细胞表达数比较 (n=5,个,±s)
**P<0.01;a与sham组比较,b与TBI组比较,A与伤后1周比较,P<0.05
组别sham组TBI组TBI+MHT组F伤后1周1.088±0.413 8.800±2.638a 13.200±1.166ab 53.341**伤后4周0.622±0.457 4.800±1.600aA 17.200±2.135abA 122.417**伤后8周0.478±0.391 2.800±0.748aA 17.200±1.720abA 270.351**F 2.862 11.110**7.207**
3 讨论
3.1 MHT可促进TBI后神经功能缺损的修复 TBI是耗费社会成本的重大健康问题,TBI后很多患者出现偏瘫、失语及记忆力减退等神经功能缺损及预后不良表现,目前尚无十分有效的治疗方法[6]。海马区是神经发生的重要部位,与大脑学习记忆等功能密切相关,而DG区是海马的关键性组成部分,因此研究TBI诱导的海马DG区神经发生对海马功能及神经功能缺损修复的潜在影响十分必要。TBI后神经功能缺损涉及多种病理机制,有效的治疗应是指能够抑制继发性损伤并扩大内源性神经可塑性的治疗[7-8]。MHT是一种应用药物或物理方法使患者体温下降至目标温度,以达到治疗目的的治疗方法。20世纪90年代至今,MHT治疗TBI逐渐被研究者及临床工作者所关注,但疗效仍存在争议。研究已证实,MHT可通过多种神经保护机制抑制TBI后继发性脑损伤过程,如降低脑耗氧量、抑制乳酸堆积、降低颅内压、维持正常脑代谢等从而降低TBI患者的病死率,改善神经功能预后[9]。但也有研究报道MHT对TBI患者神经功能预后可能无影响甚至可导致预后不良[10]。本研究显示MHT可引起大鼠逃避潜伏期缩短、穿越平台次数及目标象限停留时间增加、mNSS评分降低,表明MHT可促进TBI大鼠的学习及记忆功能恢复,减轻TBI后神经功能缺损,并促进TBI后神经功能缺损恢复。
3.2 TBI后海马DG区神经发生增加但并不持久 神经发生主要存在于成年哺乳动物大脑的两个区域:脑室下区(SVZ)及海马DG区[3],研究TBI后海马神经发生过程对进一步认识TBI后脑及神经功能变化十分必要。成体海马神经发生是新生功能性神经元整合入海马DG区现有回路的过程,由多个层次的病理生理活动共同调控,包括成体NSCs或前体神经细胞增殖、祖细胞分化及新生神经元存活和成熟等[3,11]。成体NSCs是神经系统中一类可以自我更新并向各个类型神经细胞分化的细胞。尽管研究已证实TBI后新生神经元细胞及成体NSCs会大量增殖[12],但TBI对神经发生的影响仍存在争议。有研究表明,TBI后神经发生增加[13-14];有研究则表明TBI后神经发生并未发生变化[15];还有研究报道TBI后神经发生减少[16]。为了明确TBI后神经发生的变化,本研究将核苷酸类似物BrdU作为细胞示踪剂引入有丝分裂细胞,结果显示TBI在损伤后1周促进海马DG区NSCs的“爆发性”增殖,但并不持久(未持续至损伤后4周及8周)。
3.3 MHT可促进TBI后海马DG区长期持续性神经发生 神经细胞生成阶段及新生神经元整合阶段是海马DG区神经发生的两个关键性时期。有研究表明,神经发生作用对海马功能可塑性具有重要意义[17],不能进一步发育为成熟神经元的新生神经元细胞将会在新生后1周内死亡[18-19]。因此,在出现后进一步发育为成神经细胞或成熟神经元对TBT后海马DG区新生细胞存活至关重要。已有研究证实,成年大鼠海马DG区SGZ层增殖的前体细胞可形成中间祖细胞,进而生成成神经细胞,成神经细胞可逐渐发育为成熟神经元细胞并部分迁移至海马DG区GCL层,进而影响神经突触形成和神经传导[20]。但MHT是否会增加TBI后海马DG区神经发生、并影响内源性神经可塑性,改善新生神经元长期存活及成熟目前尚无定论。因此,为研究MHT对TBI海马DG区神经再生的影响,本实验通过免疫荧光法检测损伤侧海马DG区新生细胞(BrdU标记)中成熟神经元(NeuN标记)的表达情况,结果显示,在损伤后各时间点,TBI组和TBI+MHT组大鼠损伤侧海马DG区新生及成熟神经元细胞均增加,且TBI+MHT组较TBI组增加更明显,两组新生神经元细胞均从SGZ层逐渐向GCL层移位并逐渐成熟;且与损伤早期(1周)相比,损伤后期(4周及8周)TBI组成熟神经元细胞减少,而TBI+MHT组则进一步增加。这些都表明TBI仅能促进脑创伤后新生神经细胞的大量增殖及短期存活,而MHT可促进TBI后海马DG区新生神经细胞的长期存活及成熟。
综上所述,MHT可通过诱导颅脑创伤后新生神经元细胞的长期存活及成熟来促进TBI后大鼠神经功能恢复,为TBI内源性治疗提供潜在策略。



