崔立华,李杨,白晶,马小焱,王萌,马婧怡,宋佳慧,冯福民
丙戊酸钠(valproate,VPA)是临床常用的儿童广谱抗癫痫药,在控制和治疗婴幼儿各种类型癫痫中具有重要作用[1-2]。但是,其不良反应主要为肝毒性,严重时可致患者肝功能衰竭而死亡[3]。因此,临床用药需定期监测肝功能,减少肝损伤的发生。传统的临床诊断肝损伤的实验室指标反应滞后[4]。寻找早期诊断VPA致肝损伤的生物标志物对药物性肝损伤的预防和临床治疗具有重要的意义。近期研究发现微小RNA(miRNA,miR)广泛参与了肝脏的多种生理和病理过程,影响肝细胞的发育和疾病的进程[5]。miR-122在肝脏中含量丰富,与病毒感染[6]、炎症反应[7]、癌症[8]等有着密切联系,被认为是一个新的肝损伤预警标志物。研究发现miR-155与酒精性脂肪肝及乙型肝炎病毒感染密切相关,在调控炎症反应中可能发挥重要作用[9-10]。但是,miR-122和miR-155能否对VPA致儿童肝损伤进行早期预警尚需验证。本研究旨在探讨血清miR-122和miR-155在VPA致小鼠仔鼠肝损伤过程中的动态表达及其与肝损伤的关系,以期为儿童药物性肝损伤的早期诊断寻找新的生物标志物。
1 材料与方法
1.1 主要材料 SPF级3周龄昆明小鼠86只,雌雄各半,体质量10~15 g,购自北京华阜康生物科技股份有限公司,动物许可证号:SCXK(京)2016-0006。饲养温度24~26℃,相对湿度60%~70%,光照明暗时间各12 h,提供标准饲料,适应性喂养1周。丙戊酸钠,100 mg/片,购自湖南省湘中制药有限公司,批号:171211。TRIpure总RNA抽提试剂盒(北京百泰克生物技术有限公司);miRNA逆转录试剂盒(PrimeScript™RT master Kit)和实时荧光定量聚合酶链式反应(qPCR)试剂盒(日本TaKaRa公司)。7600-020全自动生化分析仪(日本日立公司);qPCR仪(美国Applied Biosystems公司)。
1.2 方法
1.2.1 实验动物分组与给药 将适应性喂养后的小鼠按随机数字表法和雌雄均等分为对照组30只和实验组56只。实验组又分为7组,分别给予375 mg·kg-1·d-1VPA(按标准每千克体质量剂量的25倍计算)灌胃1、3、5、7、14、21和28 d。每组灌胃,2次/d。对照组又分为5组,分别给予1 mL生理盐水灌胃1、7、14、21和28 d。各组小鼠末次给药后12 h,摘眼球取血,室温静置15 min后,3 500 r/min离心20 min,收集血清,-80℃保存,待测miRNA和肝功能指标。采血后,收集小鼠的肝组织,用4%多聚甲醛固定。
1.2.2 HE染色观察肝组织病理学变化 按照标准步骤制作肝组织切片,进行HE染色。经多聚甲醛固定的肝组织,常规石蜡包埋,制成4μm切片,37℃恒温烘烤24 h。切片放入二甲苯中脱蜡10 min;经无水乙醇浸泡10 min,双蒸馏水洗2 min;放入苏木素浸泡10 min染核,自来水蓝化20 min;入伊红染液浸泡2 min染细胞质;经95%乙醇和无水乙醇脱水;二甲苯浸6 min透明;最后中性树胶封片。光学显微镜下观察各时间点小鼠肝组织的病理学状态。
1.2.3 肝功指标检测 采用全自动生化分析仪检测实验组和对照组小鼠各时间点血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平。
1.2.4 qPCR检测miR-122和miR-155表达量 Trizol法提取血清中总RNA,按照逆转录试剂盒说明书逆转录为cDNA,应用qPCR检测miR-122和miR-155表达水平,U6为内参。10μL逆转录体系:PrimeScript™RT master Mix 2μL,茎环引物0.5μL,总RNA 500 ng,RNase-Free ddH2O加至10μL。反应条件:37℃15 min,80℃5 s。20μL PCR反应体系:2×SYBR Green PCR Mastermix 10μL,cDNA 2μL,RNase-Free ddH2O 6μL,上、下游引物各0.8μL,ROXdyeⅡ0.4μL。反应条件:95℃预变性30 s;95℃变性5 s,60℃退火30 s,共60个循环,熔解曲线检测。以2-ΔΔCt计算miR-122和miR-155的相对表达量。使用课题组前期设计的miR-122、miR-155、U6引物[11],引物序列见表1,由上海生工生物工程有限公司合成。

Tab.1 Primer sequences of miR-122,miR-155 and internal reference U6表1 miR-122、miR-155及内参U6的引物序列
1.3 统计学方法 采用SPSS 22.0软件对数据进行分析。计量资料以均数±标准差(±s)描述,组间比较采用独立样本t检验,组内不同时间点比较采用单因素方差分析,多重比较采用LSD-t法,用Spearman行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 肝组织病理学结果 各组小鼠肝脏表面光滑,未见结节及肿物生长。对照组小鼠肝脏组织切片未见明显异常改变,肝小叶结构完整,肝细胞呈放射状排列,肝索整齐,肝细胞界限清晰。实验组肝脏组织均出现不同程度的肝细胞空泡变性,1 d时肝组织结构正常;3、5、7 d时可见肝细胞胞浆内存在圆形的小空泡,少量炎性细胞;14 d时肝细胞胞浆内圆形的空泡增多,细胞肿胀,较多炎性细胞浸出;21 d时大量肝细胞变性坏死,胞浆内空泡增大,大量炎性细胞,肝细胞间结构不清,肝索紊乱;28 d时肝细胞变性坏死,大量肝细胞再生。见图1。
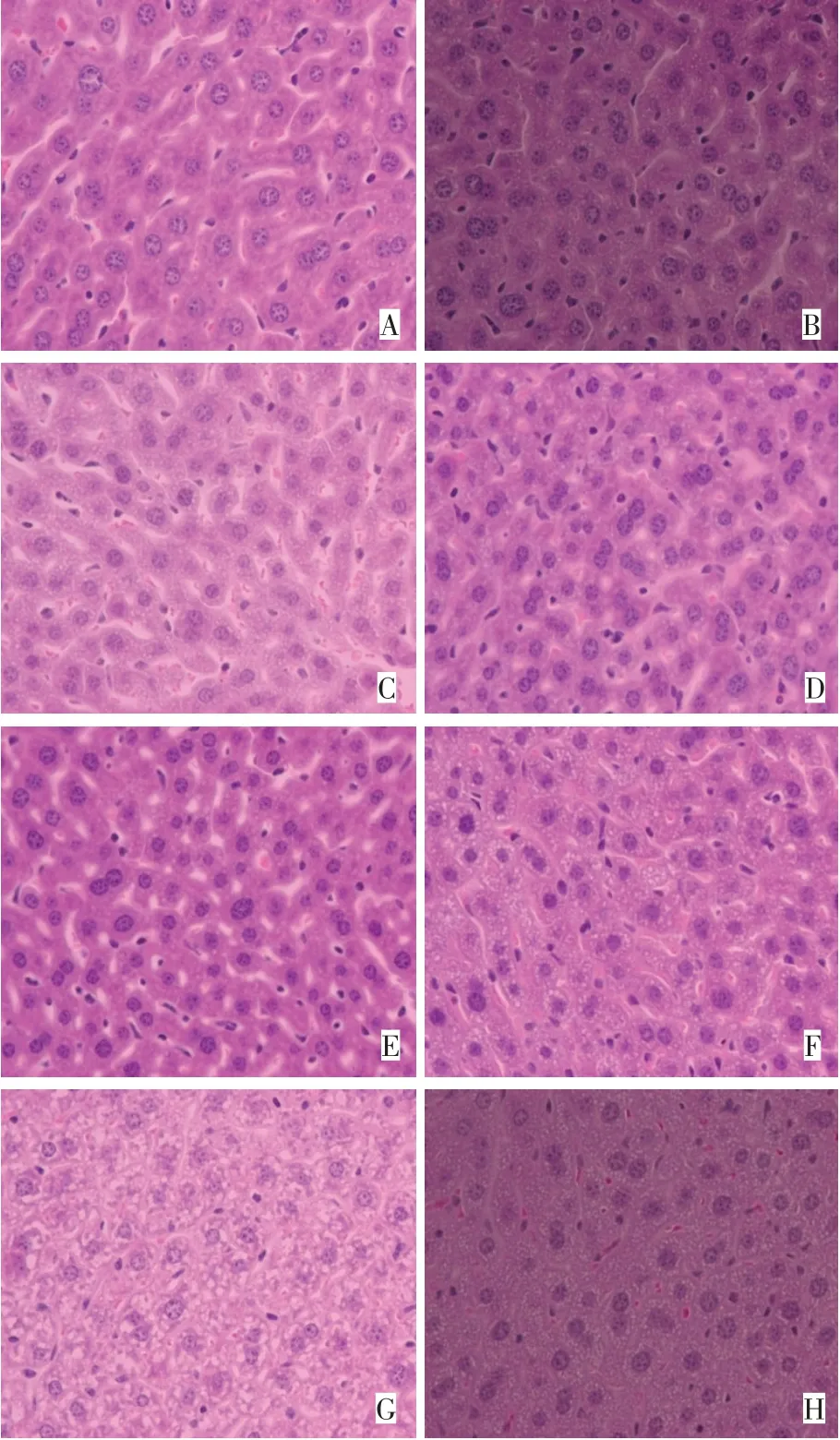
Fig.1 Pathological diagram of VPA-induced liver injury in mice(HE,×400)图1 VPA诱导的小鼠肝损伤病理图(HE,×400)
2.2 血清ALT与AST的变化 与对照组相比,实验组血清ALT与AST均呈现下降-升高的趋势(均P<0.01),两者的总体走向大致相同。给药后1 d,血清ALT与AST一过性升高,之后持续下降;ALT在给药后5 d下降到给药前水平(15.43±0.50)U/L,后又开始出现升高,至给药后21 d达到高峰(30.25±3.64)U/L;AST在给药后7 d降低至低点(28.11±2.33)U/L,之后开始出现持续上升,至给药后28 d升高至高峰(46.68±5.17)U/L。见图2。

Fig.2 The serum levels of ALT and AST at different time points in VPA-induced liver injury in mice图2 VPA诱导的小鼠肝损伤过程中不同时点血清ALT和AST的水平
2.3 miR-122和miR-155表达水平的变化 与对照组相比,实验组miR-122在1 d后开始下调,至7 d时降至最低点,此时下降了81%,之后开始回升,但低于对照组的相对表达量。miR-155的表达趋势与miR-122相反,其在1 d后上调,在给药后7 d达到最高点,此时表达水平是对照组的2.88倍,之后开始下调。见图3。
2.4 miR-122、miR-155与ALT、AST的相关性分析 miR-122与ALT和AST呈正相关(rs分别为0.965、0.900,均P<0.05),miR-155与AST呈负相关(rs=-0.811,P<0.05),而miR-155与ALT无相关性(rs=-0.198,P>0.05)。
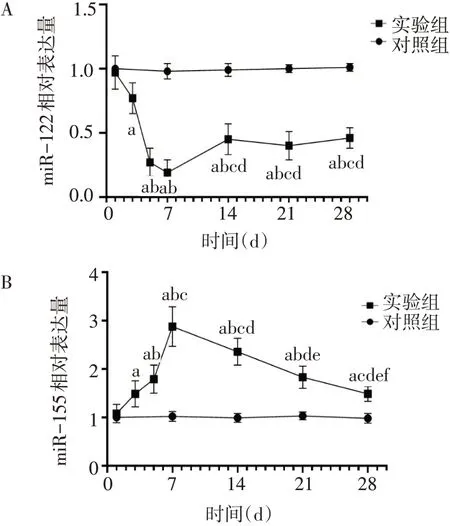
Fig.3 The relative expressions of miR-122 and miR-155 in VPA-induced liver injury in mice图3 VPA诱导的小鼠肝损伤过程中不同时点miR-122和miR-155的相对表达量
3 讨论
3.1 临床诊断肝损伤方法的局限性 丙戊酸钠是临床上导致儿童药物性肝损伤的常见药物之一,临床用药时需警惕药物导致的肝损伤、肝衰竭。目前,临床诊断肝损伤主要依据肝穿刺活检和血清肝功能检查。活检虽是诊断肝损伤的“金标准”,但其创伤大,不易被临床接受。ALT和AST是临床诊断肝损伤时广泛应用的实验室指标,但其在诊断过程中存在灵敏度和特异度偏低,易出现假阳性或假阴性,并且反应滞后,易错过肝损伤最佳治疗时机。因此,及早、有效地监测肝功能,找到灵敏的早期监测指标对预防儿童药物性肝损伤的发生发展具有重要意义。
3.2 miR-122和miR-155在VPA致小鼠肝损伤中异常表达分析 研究发现miR-122和miR-155在肝脏疾病的发生发展中发挥着重要作用[9,12]。miR-122是肝特异性表达的miRNA,约占肝脏总miRNA的70%,参与肝细胞发育、脂代谢、应激、肝炎病毒感染和肝癌等生理、病理过程[5]。miR-155与人体免疫密切相关,参与B细胞及T细胞等重要免疫细胞的分化、活化,从而影响免疫细胞功能,并可调控多个基因,如转录因子和细胞因子等表达[13-14],在炎症和肿瘤的发生发展中发挥一定作用。本研究发现,在VPA致肝损伤的过程中,血清miR-122、miR-155均出现了异常表达,随着给药时间的延长,miR-122的表达水平出现先下调、后上调的趋势,至7 d时降低至最低点;而miR-155的表达趋势与miR-122相反,至7 d时升高至最高点。结合病理学结果显示,给药3~7 d肝组织开始出现炎症反应。血清miR-122主要来自于肝细胞,当肝细胞受损时miR-122表达水平下调,miR-155表达水平上调,且相关性分析发现miR-122与ALT和AST、miR-155与AST存在较强的相关性,提示miR-122和miR-155可能参与了VPA诱导小鼠肝损伤的发生,两者发生异常表达时间早于病理学变化。miR-122和miR-155在给药7 d后又逐渐向正常水平恢复,这可能是由于随着炎症的加重,抗炎因子表达增强,抑制了miR-155的表达水平[15],也可能与肝细胞再生和自身修复有关。具体机制有待于进一步探究。
3.3 血清miR-122和miR-155在VPA致肝损伤中的预警作用分析 目前ALT和AST是检测肝损伤的标志性酶,两者活性的高低反映了细胞膜相结构的损伤程度。通过血清检测及病理组织观察,结果显示给药后1 d血清ALT与AST一过性升高,但此时病理学结果显示肝组织结构正常,未见明显异常改变,因此这可能与应激反应有关。由于实验组动物全程用同一剂量染毒,起始阶段肝脏对药物的应激反应较大,而使血清ALT与AST快速升高;随着染毒剂量逐渐升高可能大大降低了起始阶段VPA药物对肝脏的刺激反应,不会出现ALT与AST一过性升高。这一结果提示临床上癫痫儿童服用VPA时,起始药量应低于治疗剂量,随治疗时间逐渐增加剂量,防止发生肝损伤和其他不良反应。给药3 d后血清ALT与AST水平下降,可能是机体发生了适应性变化。ALT、AST分别在给药7 d后持续上升,此阶段与病理学结果炎症反应逐渐加剧相吻合。进一步结合miR-122和miR-155基因表达情况,发现在给药起始阶段(3 d、5 d)血清miR-122和miR-155与ALT和AST均能反映肝功能的早期状况,而且miR-155表达水平变化的幅度更大。若早期用药时逐渐增加药物剂量,减少或控制肝脏对药物的应激反应,血清miR-122和miR-155发生异常表达时间可能早于ALT与AST的升高;而且两者发生异常表达的时间早于病理学变化,显示出血清miR-122和miR-155能更早地反映肝损伤。因miR-122在肝组织中高度表达,且种属间高度保守,能被高特异度和灵敏度的qPCR技术快速、定量、准确地检测出,成为评估药物性肝损伤的理想血液学检测指标。上述结果表明血清miR-122和miR-155能早期预警肝损伤的发生,有望成为VPA致肝损伤的早期预警标志物,但两者在肝损伤中的具体作用机制尚不明确,需进一步探究它们是通过何种途径调控炎症反应及其他病理过程的。
综上所述,血清miR-122低表达和miR-155高表达与VPA药物性肝损伤的发生发展有关,有望成为VPA致肝损伤的早期预警指标,为临床VPA药物性肝损伤的早发现、早诊断、早治疗提供了新的实验依据。



