王居鹏,朱黎娜,马明坤,陈慧,郭素香,任丽
肺炎支原体(MP)是引起儿童社区获得性肺炎(CAP)的主要病原体[1-2],10%~46%的儿童CAP 由MP感染引起[3-5]。MP感染每3~7年可出现周期性流行[6-7]。MP缺乏细胞壁,仅对氟喹诺酮类、大环内酯类和四环素类药物敏感[8]。早期诊断是尽早治愈的关键,也可避免抗生素滥用。专家共识推荐联合病原学与血清学方法进行MP 感染的检测[9]。目前许多实验室不具备开展核酸检测或病原体培养等病原学检测的条件。血清学方法中被动凝集法(PA)检测MP 总抗体,非特异性反应小,少数患儿可呈持续高滴度,阳性并不能说明是现症感染。间接免疫荧光法(IFA)和胶体金法(GICT)定性检测MP-IgM 抗体,阳性可提示MP急性感染,但IFA易受人为因素、类风湿因子及自身抗体等影响,也易因包被抗原不足出现假阴性。GICT 操作简单快速,所需血量少,但患者体内抗体含量低时易造成漏诊。实验室需至少开展2种或以上方法弥补相互不足。许多研究比较了血清学方法间的优缺点[10-12],但对血清学方法联合检测的研究甚少。本研究旨在比较PA、IFA 和GICT 两两联合检测对儿童MP 感染的诊断价值,为选择更准确、经济的儿童MP感染检测方法提供实验室依据。
1 对象与方法
1.1 研究对象及分组 纳入 2019 年1 月1 日—2021 年 8 月31日于天津中医药大学第二附属医院儿科住院的行MP抗体检测的患儿617例,其中男298例,女319例,年龄1~15岁,平均(5.6±2.9)岁。纳入标准:(1)患儿就诊时以咳嗽、咽痛、发热症状为主要表现。(2)入院后采用PA、IFA和GICT检测MP抗体。(3)临床资料完整。排除标准:存在免疫缺陷、心血管疾病、先天畸形等。MP 感染临床诊断标准[13-14]:(1)持续剧烈咳嗽,干咳为主,发热多见,胸部影像学表现较早期肺部体征更明显。(2)外周血白细胞计数大多正常或稍增高,重症患儿可见白细胞降低,C 反应蛋白(CRP)多增高,血沉多增快。(3)青霉素、头孢类抗生素治疗无效。(4)结合MP血清学检测结果。共345例患儿确诊为MP感染(MP感染组),男160例,女 185 例,年龄 1~14 岁,平均(6.3±3.0)岁;272 例为非 MP 感染组,男138 例,女134 例,年龄1~15 岁,平均(4.8±2.7)岁。本研究已通过医院伦理委员会审批(审批号2020-026-01)。
1.2 试剂与仪器 MP总抗体检测试剂盒购自日本富士瑞必欧株式会社;9 项呼吸道感染病原体IgM 抗体检测试剂盒购自西班牙Vircell 公司;肺炎支原体IgM 抗体检测试剂盒(胶体金法)购自北京贝尔生物工程有限公司。荧光显微镜BX51 购自日本 Olympus 公司;TL-2000MM-1 型微量振荡仪购自上海宇力电子有限公司。
1.3 检测方法 收集患儿PA 检测MP 总抗体检测结果,IFA、GICT检测MP-IgM的检测结果(均为患儿入院后治疗前采样)。PA:采用MP 总抗体检测试剂盒检测患儿MP 总抗体,按说明书进行操作并判读阴阳性结果及抗体滴度,滴度<1∶40 为阴性,滴度≥1∶40 判断为阳性。IFA:采用9 项呼吸道感染病原体IgM 抗体检测试剂盒检测患儿MP-IgM 抗体,实验步骤严格按照说明书进行,标本中1%~15%细胞的细胞核、胞浆或胞膜出现苹果绿色荧光,判定为阳性。GICT:采用肺炎支原体IgM 抗体检测试剂盒(胶体金法)检测患儿MP-IgM抗体,严格按照说明书进行操作并判读阴阳性结果,若质控线和检测线均出现,判定阳性;若只出现质控线,不出现检测线,判定阴性;若质控线、检测线均不出现或只出现检测线,表明测试无效,应重新对标本进行检测。当2种检测方法联合进行结果判断时,1种方法阳性即为结果阳性。
1.4 统计学方法 采用SPSS 22.0软件进行数据分析。符合正态分布的计量资料以表示,2 组间比较采用独立样本t检验。计数资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法。采用Kappa值进行一致性检验,Kappa值0~0.2 为一致性差;0.21~0.40 为一致性弱;0.41~0.60 为中度一致;0.61~0.80 为一致性较好;0.81~1.00 为一致性极好[15]。绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC)。P<0.05为差异有统计学意义。
2 结果
2.1 2 组一般资料比较 MP 感染组患儿的年龄大于非MP 感染组,2 组性别差异无统计学意义。MP感染组 PA 检测 MP 总抗体、IFA 和 GICT 检测 MPIgM 抗体的阳性率较非MP 感染组高(P<0.01),见表1。PA 检测MP 总抗体的阳性检出率为74.39%(459/617),高于IFA 和GICT 检测MP-IgM 抗体的阳性检出率[分别为45.54%(281/617)和31.28%(193/617)],差异有统计学意义(χ2=238.123,P<0.01)。
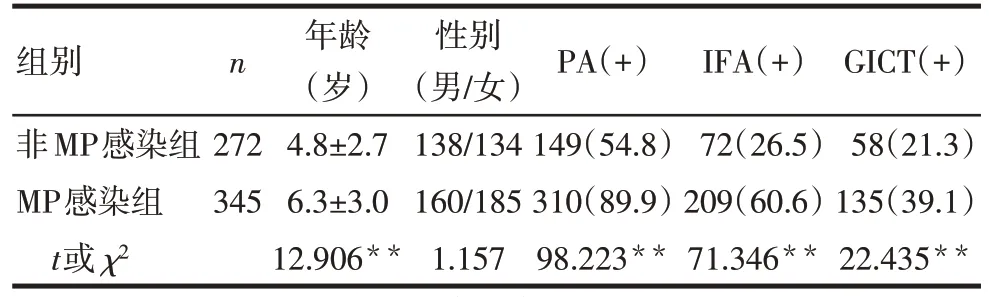
Tab.1 Comparison of general data and MP results between the two groups of children表1 2组患儿一般资料及MP检测结果比较
2.2 3种方法单独及两两联合检测判断结果 单独检测时,PA、IFA与临床诊断一致性弱(Kappa值分别为0.37、0.33,P<0.05),GICT 与临床确诊的一致性差(Kappa 值=0.17,P<0.05)。PA 联合 GICT、IFA 联合GICT 均与临床诊断一致性弱(Kappa 值分别为0.34、0.36,P<0.05),PA联合IFA与临床诊断中度一致(Kappa 值=0.41,P<0.05)。PA 和 IFA 联合检测时,2 例 2 种方法均阴性的 MP 感染患儿,GICT 结果为阳性。见表2。
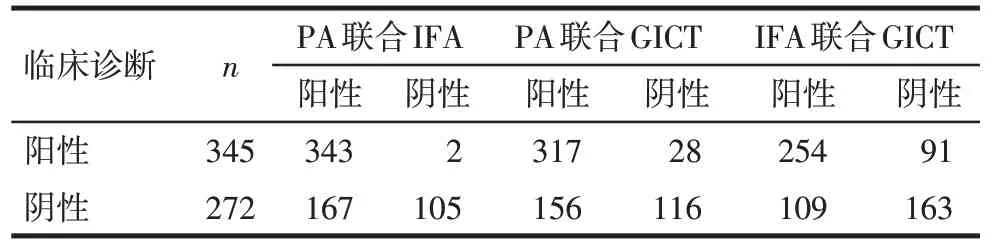
Tab.2 Analysis of MP antibody results by three methods pairwise combination表2 3种方法两两联合检测判断MP抗体结果分析(例)
2.3 ROC 曲线分析联合检测对MP 感染的诊断价值 3 种方法单独检测和两两联合检测中,PA 联合IFA的AUC、敏感度、总符合率、阴性预测值最高,阴性似然比最低。GICT单独检测特异度最高。IFA单独检测阳性预测值和阳性似然比最高。见图1、表3。
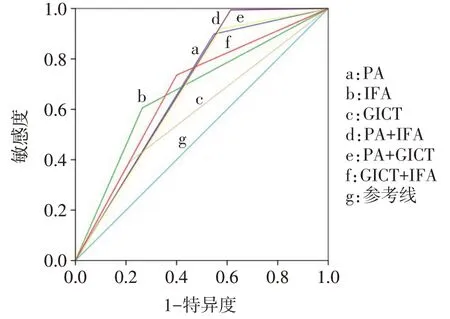
Fig.1 ROC curve analysis of the diagnostic value of the three methods alone and their pairwise combination for MP infection图1 3种方法单独检测及两两联合检测诊断MP感染的ROC曲线
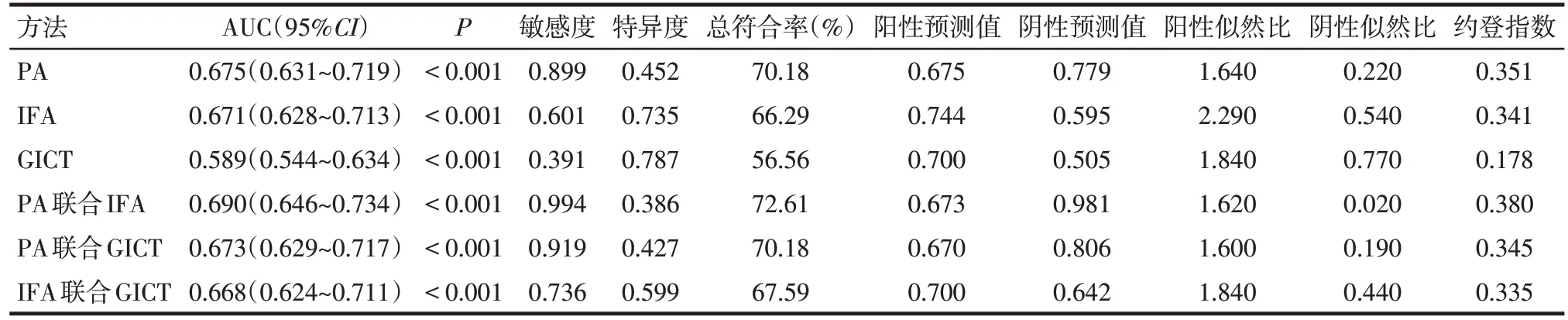
Tab.3 ROC analysis of the diagnostic value of the three methods for the diagnosis of MP infection表3 ROC分析3种方法单独检测及两两联合检测对MP感染诊断的诊断价值
2.4 PA联合IFA检测患儿MP抗体情况 当IFA检测MP-IgM抗体阳性时,MP感染组49例(23.44%)患儿 MP 总抗体滴度<1∶160,非 MP 感染组 34 例(47.22%)MP 总抗体滴度≥1∶160。非MP 感染组MP总抗体滴度1∶40~1∶80、1∶160 患儿比例高于MP 感染组,总抗体滴度在1∶640和1∶1 280患儿比例低于MP 感染组(P<0.05)。当IFA 检测MP-IgM 抗体阴性时,MP 感染组125 例(91.91%)患儿MP 总抗体滴度≥1∶160,非MP感染组147例(73.50%)患儿总抗体滴度<1∶160。非MP感染组总抗体阴性和总抗体滴度1∶40~1∶80患儿比例高于MP感染组,滴度1∶640、1∶1 280 患儿比例低于MP 感染组(P<0.01)。见表4、5。
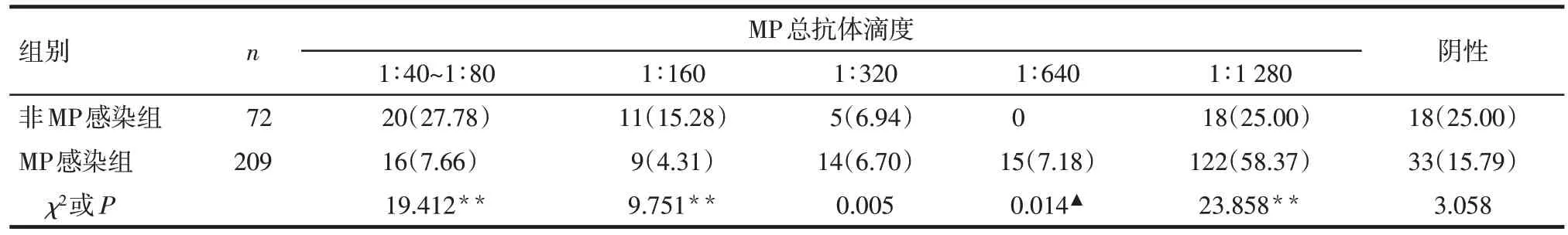
Tab.4 Comparison of the titer of total MP antibody between the two groups when MP-IgM antibody was positive表4 2组MP-IgM抗体阳性时MP总抗体滴度比较 [例(%)]
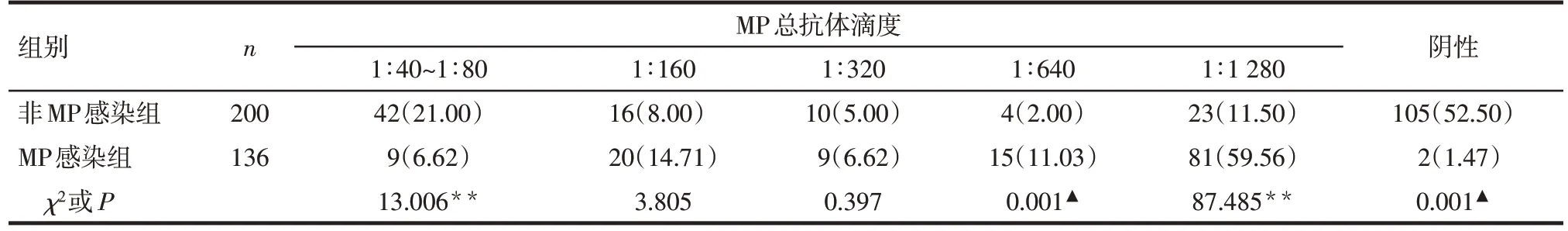
Tab.5 Comparison of the titer of total MP antibody between the two groups when MP-IgM antibody was negative表5 2组MP-IgM抗体阴性时MP总抗体滴度比较 [例(%)]
3 讨论
MP 感染难以通过临床症状和体征与其他病原体感染鉴别,依靠胸片、CT 等影像学检查也不能对早期MP感染做出准确判断[16]。由于该病易因误诊和漏诊而致病情恶化,严重时可危及患儿生命[17-18],因此MP 的早期实验室诊断对儿童MP 感染的诊治具有重要意义。目前尚缺乏能够可靠检测MP 感染的单一方法[19]。专家共识推荐不同等级的病原学方法和血清学方法联合检测MP,依次推荐分子生物学RNA 检测和PA 抗体滴度测定,分子生物学DNA 检测和酶联免疫吸附试验(ELISA)抗体分型检测,培养法或直接检测法和IFA、GICT 及非特异性血清学检测方法[9]。MP 的分离培养生长缓慢、条件苛刻[18],且容易被污染出现假阳性[20-21],且MP 分子生物学检测方法复杂,对实验室要求高,难以广泛开展,而血清学试验操作简便快速,常被用于临床诊断 MP[22-23]。
MP 感染后,体内可产生特异性的IgM、IgA 和IgG抗体。IgM抗体一般在感染后4~5 d出现,3~4周达到高峰,2~3个月降至最低,可作为近期感染的诊断标志[22,24-25],但部分患儿在急性感染早期和再感染时血液中IgM抗体水平过低,无法检测到。IgA抗体在 MP 感染早期迅速上升,7~14 d 达峰值,对儿童和成人 MP 均有诊断价值[26]。IgG 于感染后 14 d 升高,峰值一般在感染后5 周,恢复期的MP 感染患儿IgG水平高于急性期[27]。本研究PA检测MP总抗体的阳性检出率(74.39%),与杭州地区患儿的MP 总抗体检出率(73.68%)[12]相近,GICT 检测MP-IgM 抗体的阳性检出率(31.28%)高于杭州地区(26.72%)。IFA 检测MP-IgM 抗体的阳性检出率(45.54%)高于北京地区(15.19%)和合肥地区(29.70%)[28-29]。本研究中 PA 的敏感度为 0.899,与李少丽等[21]对确诊CAP的患儿进行PA检测的研究结果相近,但特异度低于该研究,可能与本研究纳入的患儿以咳嗽、发热、咽痛为标准,许多患儿可能处于感染早期,体内抗体含量较低有关。急性期和恢复期(间隔2周)双份血清MP总抗体水平呈4倍及以上变化时,可确诊为MP感染[26,30],但临床上往往难以获得恢复期的血清,因此采用PA 不能以MP 抗体单次阳性结果来确诊MP感染。IFA敏感度为0.601,特异度为0.735,略低于国内其他相关研究[31-32],可能与个体、地域差异等因素有关,也可能与本研究的儿童处于感染初期,体内IgM含量偏低有关。刘卫萍等[33]发现,病程对IFA的阳性检出率有影响,在MP感染后的3~4周IgM抗体达峰值时,IFA的阳性检出率最高,结果最为准确。
本研究中,3种方法单独使用时,与临床诊断结果的一致性均不强。因此,有必要选择2 种方法结果进行联合判断,尽可能提高与临床诊断一致性。PA 和IFA 联合检测判断结果与临床诊断一致性最强,同时AUC、总符合率、阴性预测值均高于单独检测和其他两两联合检测,敏感度达0.994,阴性似然比最低。因此,PA 和IFA 联合检测有助于提高MP感染诊断的敏感度及与临床诊断的符合率,排除非MP 感染患儿。GICT 的特异度最高,但敏感度和阴性预测值均较其他2 种方法低,虽存在较高的漏诊率,但因其检测方便、快捷、取血量少,适合用于门急诊定性筛查。本研究中PA和IFA联合检测时,2例2种方法均阴性的MP 感染患儿,GICT 结果为阳性。因此,采用GICT 时,对于检测带出现若隐若现的检测线时,也应果断报告阳性;如检测结果阴性时,临床高度怀疑MP感染的患儿,需再进一步采取其他检测方法,结合临床症状和影像学表现来判断是否为MP感染,以免漏诊。
PA 和IFA 联合检测判断结果的敏感度高,但特异度较单独使用PA或IFA进行检测时低。IFA阳性预测值和阳性似然比为3种方法单独检测或两两联合检测中最高的。因此,临床判读这2 种方法的结果时,可先观察IFA 检测MP-IgM 抗体的结果。当MP-IgM 抗体阳性时,MP 感染组有23.44%的患儿MP总抗体<1∶160,可能与患儿处于感染早期,机体迅速产生IgM,而IgG 尚未产生,未能达到试剂方法学判断标准有关;也可能与检测方法的敏感度有关。目前共识认为 PA 检测 MP 总抗体滴度≥1∶160 提示有近期或现症感染[5]。研究显示,有44.44%确诊MP感染的成人早期的MP总抗体滴度未达该诊断标准,但有影像学表现和临床症状,最终根据病原学检测结果被确诊为MP 感染[16]。葛梦蕾等[34]研究显示,90.3%MP 总抗体<1∶160 的 MP 肺炎患儿 MP-RNA检测阳性。因此,对于MP-IgM 抗体阳性的患儿,若只考虑MP 总抗体滴度≥1∶160 的患儿有感染的可能,容易引起漏诊。非MP感染组47.22%的患儿MP总抗体滴度≥1∶160,这部分患儿MP 总抗体中可能为IgG 抗体,为既往感染。因此,对于MP-IgM 抗体阳性的患儿,判读MP总抗体滴度结果在诊断MP感染中的意义,需结合临床症状和影像学表现,MP 总抗体滴度在1∶40~1∶80 或者阴性仍存在MP 感染的可能,需引起临床医师的注意,防止漏诊和误诊。当MP-IgM抗体阴性时,MP感染组有91.91%的患儿MP总抗体滴度≥1∶160,提示若临床上只检测MP-IgM,会造成部分感染者的漏诊,血清特异性MP-IgM 阴性不能排除急性感染[35];而非MP感染组患儿MP总抗体滴度<1∶160 比例(73.50%)远高于MP 感染组(8.09%)。因此对于MP-IgM抗体阴性的患儿,需着重注意总抗体滴度≥1∶160的患儿MP感染的可能。
综上所述,PA、IFA 和 GICT3 种方法检测 MP 抗体均存在一定的优缺点。PA 和IFA 联合检测可为临床提供更客观、更准确的检测结果。



