王非凡 王庆福 张硕 李广忠
摘要:目的 探讨TiO2纳米管表面聚合物辅助沉积五氧化二钽(Ta2O5)涂层对小鼠成骨前体细胞MC3T3-E1生物学活性的影响。方法 制备出Ta/TiO2纳米管(Ta/NT组)、Ta2O5/纯钛(Ta2O5/PT组)及Ta2O5/TiO2纳米管(Ta2O5/NT组)3组样本,其中后2组的Ta2O5涂层通过聚合物辅助沉积法制备。对3组样品进行表征检测:扫描电镜(SEM)观察表面形貌,X射线光电子能谱(XPS)分析表面元素组成,X射线衍射(XRD)检测表面化合物。选用MC3T3-E1细胞探讨3组样品对细胞生物学活性影响;荧光显微镜观察细胞骨架和细胞核的黏附;CCK-8法测定细胞活性;检测细胞碱性磷酸酶(ALP)活性;茜素红染色后半定量分析钙沉积;Real-time PCR检测成骨标志基因重组人骨形态发生蛋白-2(BMP-2)、ALP、骨钙蛋白(OCN)和骨桥蛋白(OPN)的基因表达。结果 SEM图像显示Ta2O5/NT组表面可见TiO2纳米管基底表面覆盖片状、带状交联的微-纳米级Ta2O5涂层结构;XRD显示Ta2O5/NT组的TiO2纳米管呈现微量的脱矿钛及金红石晶体结构;与Ta/NT组比,Ta2O5/NT组和Ta2O5/PT组黏附细胞核密度较高,细胞骨架块状、丝状结构相对较大,交联、团簇状较多,细胞骨架张力较大,具有较高的细胞活力;茜素红染色样本半定量分析显示Ta2O5/NT组、Ta/NT组、Ta2O5/PT组钙沉积量依次降低(P<0.01);Ta2O5/NT组、Ta/NT组和Ta2O5/PT组7 d和14 d 的ALP活性、钙沉积量和ALP、OCN、OPN mRNA含量依次降低,14 d Ta2O5/NT组的BMP-2 mRNA含量在3组中最高(P<0.05)。结论 Ta2O5/TiO2纳米管复合涂层可促进MC3T3-E1细胞黏附、细胞活性、ALP活性、矿化及成骨相关基因的表达,有利于其生物学活性的发挥。
关键词:钛;纳米管;Ta;Ta2O5涂层;聚合物辅助沉积;表面改性;生物活性
中图分类号:R783.1文献标志码:ADOI:10.11958/20230648
Effects of polymer assisted deposition of Ta2O5coating on the surface of TiO2nanotubes on improving the biological activity of MC3T3-E1 cells
WANG Feifan1, WANG Qingfu1, ZHANG Shuo1, LI Guangzhong2△
1 Department of Oral Implantology, Tianjin Stomatological Hospital, School of Medicine, Nankai University, Tianjin 300041, China; 2 State Key Laboratory of Porous Metal Materials, Northwest Institute for Nonferrous Metal Research
△Corresponding Author E-mail: shlgznin@126.com
Abstract: Objective To explore the effect of polymer assisted deposition of tantalum pentoxide (Ta2O5) coating on the surface of TiO2nanotubes on the biological activity of mouse bone forming precursor cells, MC3T3-E1 cells. Methods Three sets of samples were prepared, including Ta/TiO2nanotubes (the Ta/NT group), Ta2O5/pure titanium (the Ta2O5/PT group) and Ta2O5/ TiO2nanotubes (the Ta2O5/NT group). The Ta2O5/PT group and the Ta2O5/NT group were prepared by polymer-assisted deposition. The three sets of samples were characterized and tested by scanning electron microscopy (SEM) to observe the surface morphology. X-ray photoelectron spectroscopy (XPS) was used to analyze surface element composition, and X-ray diffraction (XRD) was used to detect surface compounds. MC3T3-E1 cells were selected to explore the effect of three groups of samples on cell biological activity. Fluorescence microscope was used to observe the adhesion of cytoskeleton and nucleus. Cell activity was determined by CCK-8 method. Cell alkaline phosphatase (ALP) activity was detected. Calcium deposition was detected by alizarin red staining and semi-quantitative analysis. The expression levels of recombinant human bone morphogenetic protein-2 (BMP-2), ALP, osteocalcin (OCN) and osteopontin (OPN) were detected by real-time PCR. Results SEM images showed that on the surface of the Ta2O5/NT group, the TiO2nanotube substrate was covered with a sheet-like, banded cross-linked micro-nano Ta2O5coating structure. XRD showed that the TiO2nanotubes in the Ta2O5/NT group presented a trace of demineralized titanium and rutile crystal structure. Compared with the Ta/NT group, the Ta2O5/NT group and the Ta2O5/PT group showed higher cell density, larger cytoskeletal mass and filamentous structure, more crosslinking and clusters, higher cytoskeletal tension and higher cell activity. The semi-quantitative analysis of alizarin red staining samples showed that calcium deposition decreased successively in the Ta2O5/NT group, the Ta/NT group and the Ta2O5/PT group (P<0.01). The ALP activity, calcium deposition and ALP, OCN and OPN mRNA contents on day 7 and 14 were decreased successively in the Ta2O5/NT group, the Ta/NT group and the Ta2O5/PT group, and the BMP-2 mRNA content on day 14 in the Ta2O5/NT group was the highest in the three groups (P<0.05). Conclusion Ta2O5/TiO2nanotube composite coating can promote the adhesion of MC3T3-E1 cells, the expression of mineralization and osteogenic genes, and enhance the activities of cell and ALP, which is conducive to the play of biological activities.
Key words: Titanium; nanotubes; Tantalum; Tantalum pentoxide coating; polymer-assisted deposition; surface characterization; biological activity
对钛种植体进行表面改性是近年来学者们研究的热点,可缩短种植周期并增强骨结合强度。TiO2纳米管具有独特的纳米管形貌、优异的理化特性(粗糙度和亲水性)及成骨活性[1-2]。目前,TiO2纳米管成骨研究方向主要集中在复合表面处理以协同发挥骨结合作用[3-5]。钽(Ta)涂层具有优良的化学稳定性、生物相容性及成骨性能[6-8]。然而Ta优良性能可归功于其表面稳定的五氧化二钽(Ta2O5)[9]。相关研究显示,与单纯Ta涂层相比,Ta2O5涂层具有较强的生物相容性及亲水性,有利于钙磷的沉积[10-11]。聚合物辅助沉积法是一种较好的Ta2O5涂层制备方法,工艺简单有效,可控性较强,还可以通过热处理提高涂层的致密度及结合强度[12]。本课题组前期已在TiO2纳米管上制备Ta薄膜,结果显示此复合涂层可协同促进小鼠成骨前体细胞MC3T3-E1细胞的分化及钙磷沉积[13]。本研究拟进一步通过聚合物辅助沉积法将Ta2O5涂层加载至TiO2纳米管表面形成Ta2O5/TiO2纳米管复合涂层,以期制备出具有较强生物学活性的种植体表面改性涂层。
1 材料与方法
1.1 材料
纯钛购自西北有色金属研究院;MC3T3-E1细胞购自苏州海星生物公司;五氯化钽(TaCl5)购自德国默克公司;胎牛血清购自美国Sciencell公司;青霉素链霉素、多聚甲醛、Triton X-100购自北京索莱宝公司;α-MEM完全培养基、Trizol及X射线光电子能谱分析仪购自美国赛默飞世尔公司;骨诱导培养基购自美国赛业生物公司;Hoechst购自上海联迈生物公司;Phalloidin-Alexa-Fluor 555购自英国艾博抗公司;CCK-8试剂盒购自日本同仁化学;碱性磷酸酶(ALP)活性测定试剂盒购自苏州科铭公司;RNA提取试剂盒购自德国凯杰公司;逆转录试剂盒购自美国Promega公司;扫描电镜购自日本电子公司;X射线衍射仪购自德国布鲁克公司;激光共聚焦扫描显微镜购自德国徕卡公司;酶标仪购自瑞士帝肯公司。
1.2 各组试样制备
将直径1.4 cm的纯钛片用280、600、1 200目碳化硅砂纸序列打磨抛光,依次经丙酮、无水乙醇及去离子水进行超声清洗10 min后,室温下自然干燥备用。将处理好的试样随机分成Ta/TiO2纳米管(Ta/NT)组、Ta2O5/纯钛(Ta2O5/PT)组及Ta2O5/TiO2纳米管(Ta2O5/NT)组。TiO2纳米管及Ta/NT组试样制备参照文献[10]。Ta2O5/PT组及Ta2O5/NT组的Ta2O5涂层通过聚合物辅助沉积法制备:将6 g TaCl5溶解到1 L无水乙醇中。随后将预处理的纯钛及TiO2纳米管放置在此溶液中30 s,取出后放入烘箱80 ℃烘干,并在500 ℃马弗炉中处理1 h。Ta2O5/PT组重复此操作3遍,而Ta2O5/NT组仅操作1次。
1.3 表征检测
1.3.1 扫描电镜(SEM)观察表面形貌
通过溅射镀膜法在3组表面溅射20 nm厚的金钯薄膜,在5 kV加速电压下采用SEM观察试样的表面形貌。
1.3.2 X射线光电子能谱(XPS)分析表面元素组成
采用XPS检测3组试样表面元素的组成及化学状态,采用单色Al Kα(hv=1 486.6 eV)X射线,使用45°发射角氩离子轰击溅射,结合能的参考值为284.8 eV的C1s峰。
1.3.3 X射线衍射(XRD)检测表面化合物
在40 kV、40 mA及铜Kα辐射(λKα=1.540 6 ?)的条件下,采用XRD仪检测样品表面产生的化合物。
1.4 体外细胞试验
1.4.1 MC3T3-E1细胞培养
选用MC3T3-E1细胞探讨3组样品对细胞生物学活性的影响。在37 ℃、5%CO2条件下,将MC3T3-E1细胞置于含10%胎牛血清、1%青霉素链霉素的α-MEM培养基中培养。每3 d采用0.25%胰蛋白酶消化传代细胞,将第3代用于随后的体外细胞实验。将3组样品经高压灭菌后置于24孔板中。将MC3T3-E1细胞以2×104个/mL的密度接种于样品表面,在上述培养条件下进行培养。在第3天更换为含10%胎牛血清、1%青霉素链霉素、10 nmol/L地塞米松、150 mg/L抗坏血酸和10 mmol/L β-磷酸甘油的α-MEM骨诱导培养基,进行细胞分化检测(ALP活性检测、茜素红染色、成骨标志基因检测),每3 d更换骨诱导培养基进行细胞培养。
1.4.2 荧光显微镜观察细胞骨架和细胞核黏附
将MC3T3-E1细胞在3组试样表面培养1 d后,采用4%多聚甲醛溶液固定细胞,并使用0.1%Triton X-100进行渗透。随后加入Phalloidin-Alexa-Fluor 555和Hoechst分别染色黏附细胞的细胞骨架及细胞核,采用激光共聚焦扫描显微镜观察。
1.4.3 CCK-8法测定细胞活性
使用CCK-8试剂盒检测MC3T3-E1细胞在3组试样的细胞活力。培养1、4、7 d后,在每孔中加入900 μL新鲜α-MEM培养基和100 μL CCK-8溶液。孵育1 h后,采用酶标仪检测在450 nm波长下的光密度(OD)值。
1.4.4 ALP活性检测
采用ALP活性测定试剂盒检测3组MC3T3-E1细胞的ALP活性。成骨诱导分化培养7 d和14 d后,收集上清液,用ALP活性测定试剂盒处理上清液,采用酶标仪在510 nm波长下测定各样本OD值。
1.4.5 茜素红染色检测钙沉积
采用茜素红检测MC3T3-E1细胞在3组表面的钙沉积。成骨诱导分化培养培养14 d后,4%多聚甲醛固定细胞,使用茜素红对样本进行染色,随后进一步半定量分析钙沉积,向每个样品中加入茜素红洗脱液(10%乙酸∶无水乙醇=8∶2)。采用酶标仪在490 nm波长下测试洗脱液的OD值。
1.4.6 Real-time PCR检测成骨标志基因表达
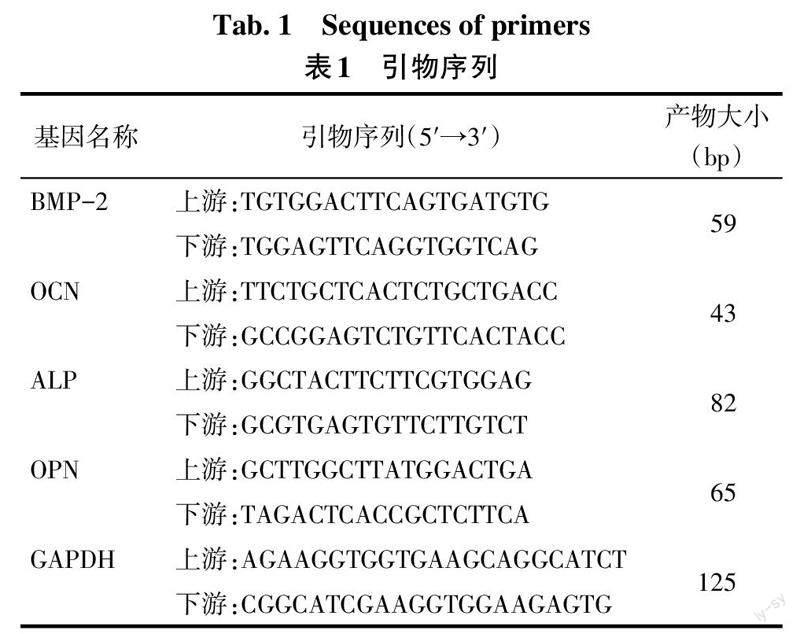
成骨诱导分化培养7 d、14 d后,采用Trizol法提取MC3T3-E1细胞总RNA,随后用逆转录试剂盒对各RNA样本逆转录形成cDNA,采用Real-time PCR定量分析成骨标志基因:重组人骨形态发生蛋白-2(BMP-2)、ALP、骨钙蛋白(OCN)和骨桥蛋白(OPN)的基因表达。引物序列由苏州金唯智生物科技有限公司合成,序列见表1。PCR扩增反应条件:95 ℃ 预变性2 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。反应体系20 μL:cDNA 1 μL,上、下游引物各0.5 μL,SYBR Green Master Mix 10 μL,ddH2O 8 μL。分别以GAPDH为内参,2-ΔΔCt法计算目的基因的相对表达量。
1.5 统计学方法
采用SPSS 25.0软件进行数据分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 表面形貌
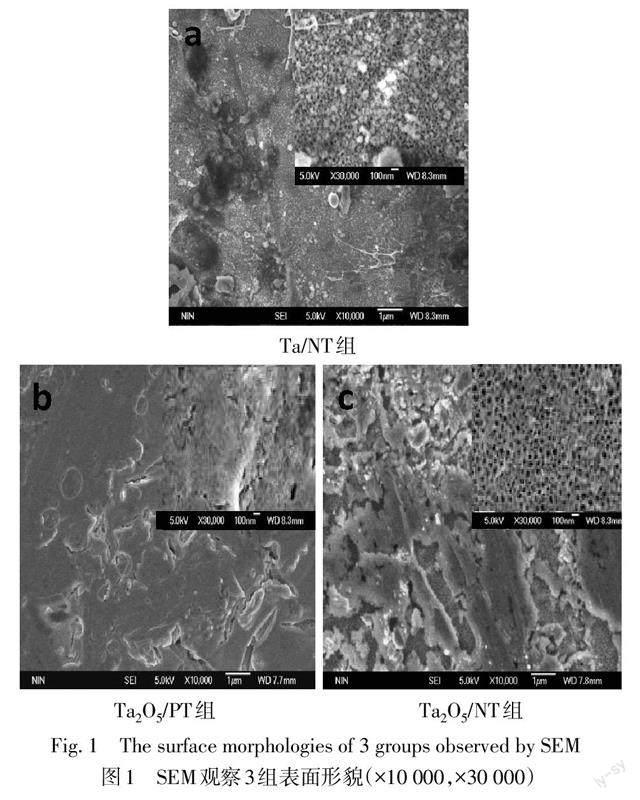
SEM图像显示,Ta/NT组为TiO2纳米管基底,表面部分覆盖球状、带状交错的微-纳米级Ta涂层结构。Ta2O5/PT组表面覆盖较为广泛且平整的Ta2O5涂层结构,偶见球状及带状结构;高倍镜下可见涂层分布较为均匀致密且主要为微米级的Ta2O5涂层。Ta2O5/NT组可见TiO2纳米管基底表面覆盖较为平滑的片状、带状交联的微-纳米级Ta2O5涂层结构;高倍镜下呈现暴露的纳米管及部分覆盖纳米管的块状Ta2O5涂层的复合结构,见图1。Ta/NT组及Ta2O5/NT组TiO2纳米管管径为(70±10)nm,管壁厚度约10 nm。
2.2 表面元素组成及化合物分析
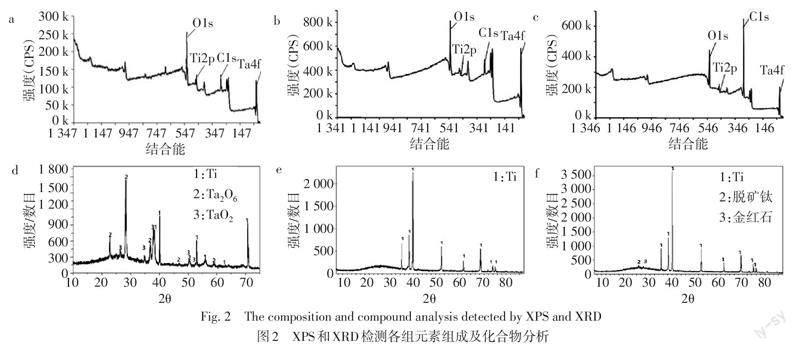
XPS结果显示,Ta/NT组、Ta2O5/PT组及Ta2O5/NT组的表面元素组成相似,主要为Ti、O、C及Ta元素(图2a—c)。XRD分析显示,Ta/NT组表面化合物为Ti、Ta2O5和TaO2(图2d)。Ta2O5/PT组XRD检测显示仅由Ti组成(图2e)。Ta2O5/NT组表面化合物主要为Ti,并含有微量的脱矿钛及金红石晶体结构的TiO2(图2f)。
2.3 细胞骨架和细胞核黏附的荧光显微镜观察
Hoechst细胞核染色显示,培养1 d后Ta2O5/NT组、Ta2O5/PT组黏附细胞核密度高于Ta/NT组,见图3。Phalloidin-Alexa-Fluor 555细胞骨架染色结果显示,Ta2O5/PT组和Ta2O5/NT组黏附细胞骨架块状、丝状结构相对较大,细胞骨架张力较大,交联、团簇状较多,而Ta/NT组细胞骨架分布块状、丝状交联结构较小,细胞骨架张力较小。Ta2O5/PT组与Ta2O5/NT组细胞骨架张力较为接近,见图3。
2.4 细胞活力比较
培养1、4、7 d,Ta2O5/PT组及Ta2O5/NT组细胞活力高于Ta/NT组(P<0.05),Ta2O5/NT组与Ta2O5/PT组间差异无统计学意义,见表2。
2.5 ALP活性比较
Ta2O5/NT组、Ta/NT组和Ta2O5/PT组7 d和14 d ALP活性逐次降低(P<0.05),见表3。
2.6 钙沉积比较
培养14 d后茜素红染色样本半定量分析显示Ta2O5/NT组、Ta/NT组、Ta2O5/PT组钙沉积量(OD490)依次降低,分别为0.408±0.018、0.289±0.017和0.142±0.010(n=3,F=223.663,P<0.01)。
2.7 成骨基因表达情况
在诱导培养7 d和14 d,Ta2O5/NT组、Ta/NT组和Ta2O5/PT组ALP、OCN、OPN的mRNA含量逐次降低,14 d Ta2O5/NT组的BMP-2 mRNA含量在3组中最高(P<0.05)。见表4。
3 讨论
Ta表面在空气中极易氧化形成致密的氧化物Ta2O5,Ta2O5结构稳定,且具有优良的生物相容性和耐腐蚀性。本课题组前期在Ta/TiO2纳米管复合涂层的研究基础上,进一步引入Ta2O5涂层至TiO2纳米管表面形成Ta2O5/TiO2纳米管复合涂层,分析其表面特征及对MC3T3T-E1细胞生物学活性的影响。
聚合物辅助沉积技术制备Ta2O5涂层是将溶解TaCl5的有机溶液沉积在基质表面,随后进行高温退火处理形成Ta2O5涂层。其操作简单可控,降低了生产成本,还通过热处理提高了涂层的致密度及结合强度。本研究通过调整样品在TaCl5的有机溶液中的浸泡次数,在纯钛表面制备了较为致密的Ta2O5涂层,在TiO2纳米管表面制备了部分覆盖的Ta2O5涂层,SEM图像显示Ta/NT组与Ta2O5/NT组呈现微纳米的复合结构,微纳米结构不仅可发挥TiO2纳米管的仿生性,还有利于成骨信号通路的传导及骨细胞向微孔中长入[14-16]。
本研究从XPS结果可以推测出Ta及Ta2O5涂层已分别加载至Ti及TiO2基底表面。C元素可归因于样本表面形成的污染层。由于仅有晶体可对X射线发生衍射,而Ta/NT组及Ta2O5/NT组XRD检测TiO2纳米管是以非晶体化合物的无定形结构组成,所以仅检测出Ti。此外,Ta2O5/NT组表面检测出微量的脱矿钛及金红石晶体结构的TiO2。研究表明,TiO2纳米管在500~600 ℃时可形成金红石与脱钛矿复合结构[17]。此复合结构可以显着改善其表面和生物学性质,促进TiO2纳米管的亲水性,并促进成骨细胞的黏附、增殖、分化、羟基磷灰石的沉积[18]。故本研究选择500 ℃进行聚合物辅助沉积法热处理,XPS元素组成及XRD化合物分析显示Ta2O5/NT组的TiO2纳米管呈现微量的脱矿钛及金红石晶体结构。此外,研究显示聚合物辅助沉积法只有在高于700 ℃热处理才能获得结晶的Ta2O5涂层[19]。因此,XRD结果显示Ta2O5/PT组及Ta2O5/NT组未检测出Ta2O5晶体结构存在。
与Ta2O5涂层组(Ta2O5/NT组和Ta2O5/PT组)相比,Ta/NT组细胞核黏附密度、细胞骨架张力均较高。此结果归因于Ta2O5较Ta具有更强的生物活性。Ta2O5/NT组与Ta/NT组的细胞活性、ALP活性、钙沉积及BMP-2、ALP、OCN和OPN表达均高于Ta2O5/PT组,尤其是Ta2O5/NT组。究其原因为,MC3T3-E1细胞的分化能力可受样本表面元素生物学活性、形貌、细胞黏附、增殖能力的影响[20-21]。纳米管复合涂层组(Ta2O5/NT组与Ta/NT组)可具有协同的生物学成骨分化作用,且呈现微纳米管形貌,因此分化作用强于单纯Ta2O5涂层即Ta2O5/PT组。此外,Ta2O5/NT组的TiO2纳米管具有微量的脱矿钛及金红石晶体结构,可增强TiO2纳米管复合涂层的分化作用。
综上所述,Ta2O5/TiO2纳米管复合涂层可促进MC3T3-E1细胞黏附、细胞活性、ALP活性、矿化及成骨相关基因的表达,有利于生物学活性的发挥,为制备出一种新型成骨性能较优的种植体表面改性涂层提供了材料学及细胞学基础。未来本课题组拟进一步通过调整Ta2O5/TiO2纳米管的工艺参数来优化生物活性,并通过开展动物实验对此复合涂层进行成骨机制方面的探讨制及动物学探讨。
参考文献
[1] KHRUNYK Y Y,BELIKOV S V,TSURKAN M V,et al. Surface-dependent osteoblasts response to TiO2nanotubes of different crystallinity[J]. Nanomaterials(Basel),2020,10(2):320. doi:10.3390/nano10020320.
[2] OCAMPO R A,ECHEVERRIA F E. Antibacterial and biological behavior of TiO2nanotubes produced by anodizing technique[J]. Crit Rev Biomed Eng,2021,49(1):51-65. doi:10.1615/CritRevBiomedEng.2021037758.
[3] PARK J,CIMPEAN A,TESLER A B,et al. Anodic TiO2nanotubes:tailoring osteoinduction via drug delivery[J]. Nanomaterials(Basel),2021,11(9):2359. doi:10.3390/nano11092359.
[4] HASHEMI A,EZATI M,MOHAMMADNEJAD J,et al. Chitosan coating of TiO2nanotube arrays for improved metformin release and osteoblast differentiation[J]. Int J Nanomedicine,2020,15:4471-4481. doi:10.2147/IJN.S248927.
[5] 韩天啸,句世颖,何琳,等. 载锶纳米管化纯钛种植体成骨性能的动物实验[J]. 中华口腔医学杂志,2022,57(6):618-624. HAN T X,JU S Y,HE L,et al. In vivo osteogenic evaluation of titanium implants with strontium loaded nanotubes[J]. Chinese Journal of Stomatology,2022,57(6):618-624. doi:10.3760/cma.j.cn112144-20211019-00469.
[6] TANG J,LI H,GUO M,et al. Enhanced spreading,migration and osteodifferentiation of HBMSCs on macroporous CS-Ta - A biocompatible macroporous coating for hard tissue repair[J]. Mater Sci Eng C Mater Biol Appl,2021,129:112411. doi:10.1016/j.msec.2021.112411.
[7] LEI P,QIAN H,ZHANG T,et al. Porous tantalum structure integrated on Ti6Al4V base by laser powder bed fusion for enhanced bony-ingrowth implants:in vitro and in vivo validation[J]. Bioact Mater,2022,7:3-13. doi:10.1016/j.bioactmat.2021.05.025.
[8] HUANG G,PAN S T,QIU J X. The clinical application of porous tantalum and its new development for bone tissue engineering[J]. Materials(Basel),2021,14(10):2647. doi:10.3390/ma14102647.
[9] ASADULLAH S,MEI S,WANG D,et al. Sulfonated porous surface of tantalum pentoxide/polyimide composite with micro-submicro structures displaying antibacterial performances and stimulating cell responses[J]. Materials & Design,2020,190:108510. doi:10.1016/j.matdes.2020.108510.
[10] SARRAF M,RAZAK B A,NASIRI-TABRIZI B,et al. Nanomechanical properties,wear resistance and in-vitro characterization of Ta2O5nanotubes coating on biomedical grade Ti-6Al-4V[J]. J Mech Behav Biomed Mater,2017,66:159-171. doi:10.1016/j.jmbbm.2016.11.012.
[11] PANG Z,PAN Z,MA M,et al. Nanostructured coating of non-crystalline tantalum pentoxide on polyetheretherketone enhances RBMS cells/HGE cells adhesion[J]. Int J Nanomedicine,2021,16:725-740. doi:10.2147/IJN.S286643.
[12] XU G,SHEN X,HU Y,et al. Fabrication of tantalum oxide layers onto titanium substrates for improved corrosion resistance and cytocompatibility[J]. Surf Coat Tech,2015,272:58-65. doi:10.1016/j.surfcoat.2015.04.024.
[13] WANG F,LI C,ZHANG S,et al. Tantalum coated on titanium dioxide nanotubes by plasma spraying enhances cytocompatibility for dental implants[J]. Surf Coat Tech,2020,382:125161. doi:10.1016/j.surfcoat.2019.125161.
[14] SOUZA J,SORDI M B,KANAZAWA M,et al. Nano-scale modification of titanium implant surfaces to enhance osseointegration[J]. Acta Biomater,2019,94:112-131. doi:10.1016/j.actbio.2019.05.045.
[15] LI J,HOU W,YANG Y,et al. Micro/nano-topography promotes osteogenic differentiation of bone marrow stem cells by regulating periostin expression[J]. Colloids Surf B Biointerfaces,2022,218:112700. doi:10.1016/j.colsurfb.2022.112700.
[16] HOU C,AN J,ZHAO D,et al. Surface modification techniques to produce micro/nano-scale topographies on Ti-based implant surfaces for improved osseointegration[J]. Front Bioeng Biotechnol,2022,10:835008. doi:10.3389/fbioe.2022.835008.
[17] BEN?INA M,IGLI? A,MOZETI? M,et al. Crystallized TiO2nanosurfaces in biomedical applications[J]. Nanomaterials(Basel),2020,10(6):1121. doi:10.3390/nano10061121.
[18] KIM S Y,KIM Y K,PARK I S,et al. Effect of alkali and heat treatments for bioactivity of TiO2nanotubes[J]. Applied Surface Science,2014,321:412-419. doi:10.1016/j.apsusc.2014.09.177.
[19] EPIFANI M,ZAMANI R,ARBIOL J,et al. Soft chemistry routes to transparent metal oxide thin films. The case of sol-gel synthesis and structural characterization of Ta2O5thin films from tantalum chloromethoxide[J]. Thin Solid Films,2014,555:39-41. doi:10.1016/j.tsf.2013.05.139.
[20] GUI N,XU W,MYERS D E,et al. The effect of ordered and partially ordered surface topography on bone cell responses:a review[J]. Biomater Sci,2018,6(2):250-264. doi:10.1039/c7bm01016h.
[21] NOURI-GOUSHKI M,ANGELONI L,MODARESIFAR K,et al. 3D-printed submicron patterns reveal the interrelation between cell adhesion,cell mechanics,and osteogenesis[J]. ACS Appl Mater Interfaces,2021,13(29):33767-33781. doi:10.1021/acsami.1c03687.
(2023-04-28收稿 2023-06-02修回)
(本文编辑 李志芸)



