郭玉峰 刘玉梅 毕秀增 郭俊麟 孙莉 王维秀 杨定位


摘要:目的 探讨成人肾病综合征患者黄斑区视网膜厚度与尿蛋白的相关性。方法 选择内科收治的住院患者112例,按照尿蛋白检测结果分为正常尿蛋白组28例(56眼)、轻度异常尿蛋白组30例(58眼)、中度异常尿蛋白组27例(51眼)、肾病综合征组27例(53眼)。利用光学相干断层扫描仪(OCT)测量黄斑中央区(Center)、内环颞侧(InT)、内环上方(InS)、内环鼻侧(InN)、内环下方(InI)、外环颞侧(OutT)、外环上方(OutS)、外环下方(OutI)、外环鼻侧(OutN)9个区域视网膜平均厚度,采用相关比率E2对各组黄斑区视网膜平均厚度与尿蛋白分级进行相关性分析。结果 轻度异常尿蛋白组黄斑区Center、InT、InN和InI视网膜平均厚度高于正常尿蛋白组,中度异常尿蛋白组黄斑区Center、InT、InS、InN、InI和OutN视网膜平均厚度低于轻度异常尿蛋白组,肾病综合征组黄斑区InT、InS、InN和InI视网膜平均厚度高于中度异常尿蛋白组(均P<0.05)。黄斑区InT、InS、InN、InI视网膜平均厚度与尿蛋白严重程度呈中度相关(0.06≤E2<0.16),Center、OutN视网膜平均厚度与尿蛋白严重程度的相关性较弱(E2<0.06)。结论 黄斑区InT、InS、InN、InI视网膜平均厚度有可能成为成人肾病综合征早期病变的生物标志物。
关键词:肾病综合征;体层摄影术,光学相干;尿蛋白;黄斑区视网膜厚度
中图分类号:R771.3文献标志码:ADOI:10.11958/20221421
Correlation between macular retinal thickness and urinary protein in adult patients with nephrotic syndrome
GUO Yufeng LIU Yumei BI Xiuzeng GUO Junlin SUN Li WANG Weixiu YANG Dingwei
1 Department of Ophthalmology, 2 Department of Nephrology, Tianjin Hospital, Tianjin 300211, China
Abstract: Objective To investigate the correlation between retinal thickness in macular area and urinary protein in adult patients with nephrotic syndrome. Methods A total of 112 inpatients admitted to the internal medicine department were selected and divided into the normal urine protein group (28 cases, 56 eyes), the mildly abnormal urine protein group (30 cases, 58 eyes), the moderately abnormal urine protein group (27 cases, 51 eyes) and the nephrotic syndrome group (27 cases, 53 eyes) according to results of urine protein detection. Optical coherence tomography (OCT) was used to measure the average retinal thickness of the nine divisions in the macula regions, including the central region (Center), temporal side of the inner ring (InT), superior the inner ring (InS), nasal side of the inner ring (InN), inferior the inner ring (InI), temporal side of the outer ring (OutT), superior the outer ring (OutS), inferior the outer ring (OutI) and nasal side of the outer ring (OutN). The correlation ratio E2 was used to analyze the correlation between the mean retinal thickness of different macular regions and the grading of urinary protein in each group. Results The mean retinal thickness of Center, InT, InN and InI in the macular area was higher in the mildly abnormal urine protein group than that in the normal urine protein group. The mean retinal thickness of Center, InT, InS, InN, InI and OutN in the macular area was lower in the moderately abnormal urine protein group than that in the mildly abnormal urine protein group, and the mean retinal thickness of InT, InS, InN and InI in the macular area was higher in the nephrotic syndrome group than that in the moderately abnormal urinary protein group (All P<0.05). The mean retinal thickness of InT, InS, InN and InI in macular area was moderately correlated with the severity of urinary protein group (0.06≤E2<0.16), while the mean retinal thickness of Center and OutN in macular area was weakly correlated with the severity of urinary protein group (E2<0.06). Conclusion The mean retinal thickness of InT, InS, InN and InI in macular area may be biomarkers of early lesions of adult nephrotic syndrome.
Key words: nephrotic syndrome; tomography, optical coherence; urine protein; macular retinal thickness
肾脏和眼睛在结构、发育、遗传路径上有诸多相似之处[1]。肾小球和脉络膜具有结构相似的血管网络;血视网膜内屏障和肾小球滤过屏障具有相似的发育路径;肾素-血管紧张素-醛固酮激素系统存在于眼睛和肾脏中[2]。肾病综合征患者可出现眼底的浆液性视网膜脱离[3-5]、黄斑水肿[6]、视网膜色素上皮脱离[4]和脉络膜新生血管[7]等并发症。慢性肾病患者可出现脉络膜视网膜微血管重建和脉络膜视网膜变薄[8]。近年来,对于眼睛和肾脏之间同源性的研究不断涌现,其中临床个案报道较多,成人肾病综合征患者肾与眼的关系研究尚鲜见。肾病综合征是由一组有类似的临床表现、不同的病因及病理表现的肾脏疾病构成的临床症候群。这组疾病的临床表现有相似之处,均具有大量蛋白尿这一突出特征[9]。本研究通过分析无可见视网膜病变的成人肾病综合征患者黄斑区视网膜厚度与尿蛋白的相关性,探讨黄斑区视网膜厚度改变与肾脏损伤的关系。
1 对象与方法
1.1 研究对象
选择2020年7月—2022年7月于天津医院内科住院的患者112例,其中男87例,女25例;年龄52~87岁,平均(67.30±7.31)岁;右眼112眼,左眼106眼。依据患者尿蛋白定性检测、24 h尿微量白蛋白定量检测和尿蛋白定量检测结果进行分组。正常尿蛋白组(A组),尿蛋白定性(-)、24 h尿微量白蛋白≤20 mg/L、尿蛋白定量<150 mg/24 h;轻度异常尿蛋白组(B组),尿蛋白定性(±)、20 mg/L<24 h尿微量白蛋白<200 mg/L、150 mg/24 h≤尿蛋白定量<500 mg/24 h;中度异常尿蛋白组(C组),尿蛋白定性(+~+++)、24 h尿微量白蛋白≥200 mg/L、500 mg/24 h≤尿蛋白定量<3 500 mg/24 h;肾病综合征组(D组),尿蛋白定性(++++)、24 h尿微量白蛋白≥200 mg/L、尿蛋白定量≥3 500 mg/24 h。本研究已通过医院伦理委员会审查(伦理编号:2020医伦审079)。
1.2 纳入及排除标准
纳入标准:年龄>50岁;最佳矫正视力≥4.3,眼压在正常范围(10~21 mmHg,1 mmHg=0.133 kPa);屈光不正等效球镜在+3.0 D~-6.0 D之间;眼部屈光间质清晰;眼底镜检查未见明显异常者。排除标准:青光眼患者;有明确玻璃体、视网膜、脉络膜疾病病史;有眼科干预手术史,如激光光凝、抗血管内皮生长因子玻璃体腔注射和玻璃体切除术;有眼部外伤病史;伴有严重的全身疾病患者,如控制不良的高血压、糖尿病、高脂血症、血液疾病等。
1.3 检查方法
患者均行裂隙灯显微镜、眼底镜、最佳矫正视力(BCVA)、非接触式眼压(NT-510,NIDEK,Japan)、光学相干断层扫描(3D OCT-2000,TOPCON,Japan)检查,同一患者的所有检查均在1 d内由专业医技人员完成操作。
患者均行免散瞳OCT检查,在暗室环境下进行,每只眼睛进行3次扫描,应用黄斑区6 mm×6 mm、立方体512×128 OCT扫描模式。以黄斑中心凹为圆心,以直径1 000 μm、3 000 μm、6 000 μm画圆,中央区独立,再按照上、下、鼻、颞在内、外圆间分区(图1),获取黄斑中央区(Center)、内环颞侧(InT)、内环上方(InS)、内环鼻侧(InN)、内环下方(InI)、外环颞侧(OutT)、外环上方(OutS)、外环下方(OutI)、外环鼻侧(OutN)9个区域的区域内黄斑视网膜厚度平均值。3次检查结果由1名高年资眼科病医师审查,记录最佳测量结果。
1.4 统计学方法
采用SPSS 21.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验;计数资料组间比较采用χ2检验;相关性分析采用相关比率(Eta平方系数,E2),E2<0.06为弱相关,0.06≤E2<0.16为中度相关,E2≥0.16为强相关;以P<0.05为差异有统计学意义。
2 结果
2.1 患者一般情况比较
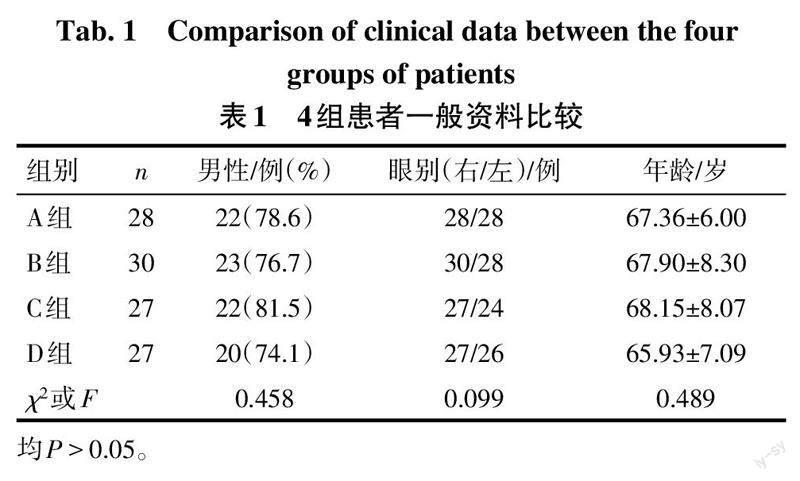
各组性别、年龄、眼别差异均无统计学意义(P>0.05),见表1。
2.2 各组各区黄斑区视网膜平均厚度比较分析
与A组比较,B组黄斑区Center、InT、InN和InI视网膜平均厚度增加(P<0.05),InS和OutN差异无统计学意义(P>0.05);与B组比较,C组黄斑区Center、InT、InS、InN、InI和OutN视网膜平均厚度均减少(P<0.05);与C组比较,D组黄斑区InT、InS、InN和InI视网膜平均厚度增加(P<0.05),Center和OutN差异无统计学意义(P>0.05)。各组黄斑区OutT、OutS、OutI视网膜平均厚度差异无统计学意义(P>0.05),见表2。
2.3 黄斑区各区视网膜平均厚度与尿蛋白严重程度的相关性分析
采用相关比率E2对黄斑区Center、InT、InS、InN、InI、OutN视网膜平均厚度与尿蛋白严重程度进行相关性分析,结果显示,InT、InS、InN、InI视网膜平均厚度与尿蛋白严重程度呈中度相关,Center、OutN视网膜平均厚度与尿蛋白严重程度的相关关系较弱,见表3。
3 讨论
本研究结果显示,正常尿蛋白组、轻度异常尿蛋白组、中度异常尿蛋白组、肾病综合征组黄斑区Center、InT、InS、InN、InI、OutN视网膜平均厚度存在差异,提示尿蛋白的出现对黄斑区以中心凹为中心、直径3 000 μm圆形区域以及向视盘方向以中心凹为中心、半径3 000 μm与水平线上下各夹角45°的扇形区域内视网膜厚度影响显着,这可能与黄斑区独特的凹形解剖结构、黄斑中央存在直径为400~500 μm的无血管区、视盘与黄斑之间的视盘周围放射状毛细血管较短有关。
本研究发现,随着尿蛋白严重程度的变化,黄斑区Center、InT、InS、InN、InI、OutN大部分区域视网膜平均厚度有改变,且有从正常到升高,再下降,复又升高的变化。Yao等[10-11]研究发现,成人和儿童原发性肾病综合征患者黄斑中心凹视网膜厚度高于正常对照组,与本研究结果相似。本研究选取的研究对象眼底镜检查未见明显异常,不伴有严重的全身性疾患,以老年人居多。老年肾病综合征患者常合并多种慢性疾病,病理类型及病因复杂[12-13],疾病谱与年轻患者不同[14],蛋白尿的增加可能是由高血压、糖尿病、高尿酸血症、肾炎、肾盂肾炎等多种因素引起的。机体衰老时微循环的结构和功能障碍,对组织氧合、营养输送、废物清除产生不利影响[15]。滕娟等[16]研究发现,糖尿病视网膜在临床静息期,正常白蛋白尿组和微量白蛋白尿组黄斑区各层视网膜及脉络膜毛细血管血流密度(macular vascular density,MVD)均降低,且微量白蛋白尿出现后,深层视网膜及脉络膜毛细血管MVD明显降低,黄斑中心凹无血管区增大,表明视网膜微循环的改变先于微量白蛋白尿的出现,与Cankurtaran等[17]研究结果一致。Yao等[10]研究发现,成年原发性肾病综合征患者较健康成人黄斑区血管密度降低。以上研究提示黄斑区血管密度降低可能是导致尿蛋白异常患者黄斑区视网膜厚度改变的关键。
本研究按照尿蛋白检查结果分组,4组模拟尿蛋白从正常、轻度异常、中度异常逐渐发展到肾病综合征的过程。依据本研究结果笔者推测,成人尤其是老年肾病综合征患者,在微量蛋白尿出现之前视网膜微循环障碍已经出现,视网膜毛细血管密度降低;尿微量白蛋白出现时,血管内皮功能障碍[18],出现细胞外间隙水肿,血管渗出物或细胞碎片积聚[8],视网膜水肿、厚度增加[19],且视网膜毛细血管进一步受损;随着病情进展,尿蛋白进一步增多,血浆白蛋白减少,血浆渗透压下降,血视网膜内屏障破坏,视网膜水肿会进一步加重[20]。但如果黄斑区各层视网膜及脉络膜毛细血管网退化萎缩,黄斑区处在缺血状态,在视网膜色素上皮完整、血视网膜外屏障功能完好时,水分向脉络膜转移,且部分视网膜间隙内的白蛋白扩散到玻璃体中[21]。部分受损组织萎缩,黄斑水肿反而减轻,直至肾病综合征出现,黄斑区血管密度及黄斑区供血进一步下降,但大量蛋白尿导致的低蛋白血症以及血视网膜内、外屏障的进一步破坏,代偿功能不及,黄斑水肿再次出现。
Farrah等[8]研究认为,肾脏损伤的组织学标记与临床和临床前期OCT检测到的视网膜微血管病理循环存在联系。本研究应用方便、无创、定量、微米级的OCT检查黄斑区视网膜,显示黄斑区InT、InS、InN、InI视网膜平均厚度与尿蛋白严重程度呈中度相关,Center、OutN视网膜平均厚度与尿蛋白严重程度的相关性较弱,提示黄斑区视网膜厚度与尿蛋白分级间存在关联,黄斑区InT、InS、InN、InI视网膜平均厚度可能亦可作为成人肾病综合征组织学标志物。但本研究为小样本探索性研究,存在局限性,有待大样本、前瞻性纵向研究进一步验证。
参考文献
[1] WONG C W,WONG T Y,CHENG C Y,et al. Kidney and eye diseases:common risk factors,etiological mechanisms,and pathways[J]. Kidney Int,2014,85(6):1290-1302. doi:10.1038/ki.2013.491.
[2] FURSOVA A Z,DERBENEVA A S,VASILYEVA M A,et al. Development,clinical manifestations and diagnosis of retinal changes in chronic kidney disease[J]. Vestn Oftalmol,2021,137(1):107-114. doi:10.17116/oftalma2021137011107.
[3] BILGE A D,YAYLALI S A,YAVUZ S,et al. Bilateral serous macular detachment in a patient with nephrotic syndrome[J]. Retin Cases Brief Rep,2018,12(3):260-262. doi:10.1097/ICB.0000000000000487.
[4] HAGER A,WIEGAND W. Bilateral serous detachment of the neurosensory retina and retinal pigment epithelium with rip of the peripheral pigment epithelium[J]. Ophthalmologe,2006,103(11):966-970. doi:10.1007/s00347-006-1437-1.
[5] IZZEDINE H,FARDEAU C,GAUTHIER M,et al. Bilateral serous retinal detachment as a presenting sign of nephrotic syndrome[J]. Intern Med,2014,53(22):2609-2613. doi:10.2169/internalmedicine.53.2720.
[6] DE BENEDETTO U,PASTORE M R,BATTAGLIA PARODI M,et al. Retinal involvement in nephrotic syndrome secondary to minimal change disease[J]. Eur J Ophthalmol,2012,22(5):843-845. doi:10.5301/ejo.5000153.
[7] GAMBATO T,FRANCESCUTTI L,LANZETTA P. Choroidal neovascularization in primary membranous nephropathy [J]. Am J Case Rep,2020,21:e923454. doi:10.12659/AJCR.923454.
[8] FARRAH T E,DHILLON B,KEANE P A,et al. The eye,the kidney,and cardiovascular disease:old concepts,better tools,and new horizons[J]. Kidney Int,2020,98(2):323-342. doi:10.1016/j.kint.2020.01.039.
[9] 梅长林. 肾病综合征[M]. 北京:科学出版社,2012:1-2. MEI C L. Nephrotic Syndrome[M]. Beijing:Science Press,2012:1-2.
[10] YAO T,HE Y,HUANG L,et al. Quantitative vessel density analysis of macular and peripapillary areas by optical coherence tomography angiography in adults with primary nephrotic syndrome[J]. Microvasc Res,2022,144:104407. doi:10.1016/j.mvr.2022.104407.
[11] ZHANG W,ZHANG Y,KANG L,et al. Retinal and choroidal thickness in paediatric patients with hypoalbuminaemia caused by nephrotic syndrome[J]. BMC Ophthalmol,2019,19(1):44. doi:10.1186/s12886-019-1050-0.
[12] 陶琳,刘改灵,邵凤民,等. 老年肾病综合征患者临床特征及心血管事件发病率[J]. 中国老年学杂志,2022,42(11):2713-2715. TAO L,LIU G L,SHAO F M,et al. Clinical characteristics and incidence of cardiovascular events in elderly patients with nephrotic syndrome[J]. Chinese Journal of Gerontology,2022,42(11):2713-2715.
[13] 刘玲玲. 老年肾病综合征的临床病理分析及不同治疗方法的疗效比较[D]. 承德:承德医学院,2021. LIU L L. Clinicopathological analysis of elderly nephrotic syndrome and comparison of therapeutic effects under different treatment methods[D]. Chengde:Chengde Medical College,2021. doi:10.27691/d.cnki.gcdyx.2021.000157.
[14] 杨光,赵佳慧,程庆砾. 老年肾病综合征的特点与诊治[J]. 中国临床保健杂志,2020,23(1):31-35. YANG G,ZHAO J H,CHENG Q L. Characteristics and diagnosis of nephrotic syndrome in the elderly[J]. Chin J Clin Healthc,2020,23(1):31-35.
[15] UNGVARI Z,TARANTINI S,SOROND F,et al. Mechanisms of vascular aging,a geroscience perspective:JACC focus seminar[J]. J Am Coll Cardiol,2020,75(8):931-941. doi:10.1016/j.jacc.2019.11.061.
[16] 滕娟,余海跃,陈志萍,等. 2型糖尿病患者尿微量白蛋白含量与黄斑区视网膜微循环相关性分析[J]. 眼科新进展,2020,40(10):952-956. TENG J,YU H Y,CHE Z P,et al. Correlation analysis between microalbumin changes and macular retinal microcirculation in type 2 diabetic patients[J]. Rec Adv Ophthal,2020,40(10):952-956.
[17] CANKURTARAN V,INANC M,TEKIN K,et al. Retinal microcirculation in predicting diabetic nephropathy in type 2 diabetic patients without retinopathy[J]. Ophthalmologica,2020,243(4):271-279. doi:10.1159/000504943.
[18] OCHODNICKY P,HENNING R H,VAN DOKKUM R P,et al. Microalbuminuria and endothelial dysfunction:emerging targets for primary prevention of end-organ damage[J]. J Cardiovasc Pharmacol,2006,47(Suppl 2):S151-S176. doi:10.1097/00005344-200606001-00009.
[19] DARUICH A,MATET A,MOULIN A,et al. Mechanisms of macular edema: beyond the surface[J]. Prog Retin Eye Res,2018,63:20-68. doi:10.1016/j.preteyeres.2017.10.006.
[20] KHATRI A,PANDEY A,JOSHI K,et al. Redefining response in wet AMD to anti VEGF therapy based on non-OCTA versus OCTA evaluation[J]. Eur J Ophthalmol,2021,32(5):2719-2725. doi:10.1177/11206721211059349.
[21] SCHOLL S,AUGUSTIN A,LOEWENSTEIN A,et al. General pathophysiology of macular edema[J]. Eur J Ophthalmol,2011,21(Suppl 6):S10-9. doi:10.5301/EJO.2010.6050.
(2022-09-14收稿 2023-02-06修回)
(本文编辑 陈丽洁)



