缪瑞宇,王碧,龙宗敏
前列腺炎是成年男性泌尿系统常见的炎症性疾病,而自身免疫性前列腺炎(experimental autoimmune prostatitis,EAP)是由于自身免疫反应导致的慢性前列腺疾病,主要临床表现为排尿异常、盆腔区疼痛或不适等症状[1]。EAP 影响因素众多,病因复杂,发病机制尚不明确[2]。辅助性T 细胞17(T helper 17,Th17)/调节性T 细胞(regulatory T cells,Treg)的动态平衡是维持免疫稳定的重要机制,与炎症、肿瘤及自身免疫疾病密切相关。研究显示,Th17/Treg失衡参与自身免疫性前列腺炎的发病,是治疗自身免疫性前列腺炎的重要靶点[3]。小檗碱,也称为黄连素,是从中药黄连中提取出的一种生物碱,具有抗炎、抗氧化、神经保护等药理作用,在高血压、糖尿病、心律失常等多种疾病的治疗中发挥重要作用[4]。有研究表明,小檗碱可通过多靶点代谢网络调节改善非细菌性前列腺炎[5]。腺苷酸活化蛋白激酶(adenosine monphate activated protein kinas,AMPK)/核因子-κB(nuclear factor-κB,NF-κB)是与炎症相关的重要信号通路,在骨关节炎、哮喘等多种炎症性疾病中发挥重要的调控作用[6]。有研究表明,小檗碱通过AMPK/NF-κB 途径调节巨噬细胞的极化,对大鼠佐剂性关节炎具有显着的治疗效果[7]。此外,AMPK 信号通路是调节Th17/Treg 平衡的重要通路之一[8]。但小檗碱调节AMPK/NF-κB信号通路对EAP 大鼠的影响尚不完全清楚。因此,本研究旨在探讨小檗碱调节AMPK/NF-κB 信号通路对EAP大鼠Th17/Treg平衡的影响及其作用机制。
1 材料与方法
1.1 实验动物 90只SPF级健康雄性SD大鼠,6~7周龄,体质量210~250 g,购自导科医药技术(广东)有限公司,生产许可证号:SCXK(粤)2022-0060。所有动物饲养在遵义医科大学实验动物中心,使用许可证号:SYXK(黔)2021-0004。喂养环境:12 h 光/暗循环、温度22~26 ℃、湿度55%~65%,自由摄食和进水。本实验获得遵义医科大学动物伦理委员会的批准(IACUC号:202103008)。于实验前1周对大鼠进行适应性饲养,按实验动物使用的3R原则给予人道关怀。
1.2 主要试剂与仪器 完全弗氏佐剂(货号:F5881)购自美国Sigma公司;百白破疫苗(货号:210415)购自昆明市五华区卫生防疫站;小檗碱(纯度:HPLC≥98%,货号:B21379)购自上海源叶生物科技有限公司;AMPK 抑制剂compound C(货号:UE171260)购自香港吉斯恩贝国际贸易有限公司;通用SP 免疫组织化学试剂盒(货号:SP0041)、大鼠白细胞介素(IL)-17 的酶联免疫吸附试验(ELISA)试剂盒(货号:SEKR-0007)、大鼠IL-10 的ELISA 试剂盒(货号:SEKR-0006)购自北京索莱宝科技有限公司;兔源抗大鼠一抗视黄酸相关核孤儿受体γt(RORγt,货号:ab219501)、叉头蛋白3(forkhead box protein 3,Foxp3,货号:ab215206)、AMPK(货号:ab32047)、p-AMPK(货号:ab133448)、NF-κB p65(货号:ab19870)、p-NFκB p65(货号:ab76302)、NF-κB 抑制蛋白α(IκBα,货号:ab32518)、甘油醛-3- 磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH,货号:ab8245)以及辣根过氧化物酶(HRP)标记的羊抗兔二抗(货号:ab288151)购自英国Abcam 公司。DSX100 光学显微镜(日本Olympus 公司);Synergy H4 多功能酶标仪(美国Bio Tek 公司);FACSCalibur流式细胞仪(美国Becton-Dickinson公司)。
1.3 实验方法
1.3.1 EAP 大鼠模型的构建及分组给药 采用大鼠盆腔区域及双侧肩胛皮下多点注射完全弗式佐剂与前列腺组织混合悬液的方法[9]构建EAP大鼠模型:取SD大鼠,使用戊巴比妥钠(40 mg/kg)麻醉后,颈椎脱臼处死,取前列腺组织进行冰浴下研磨,制成悬液,用磷酸盐缓冲溶液(PBS)稀释为60 g/L的大鼠前列腺蛋白提纯液,与弗式完全佐剂以1∶1比例充分混合研磨,使其形成油包水状态,于大鼠盆腔区域皮下和双侧肩胛皮下多点注射,同时腹腔注射百白破疫苗,分别在第0、7、14、28天进行4次注射。采用Von-Frey测痛纤维按照不同重量依次刺激大鼠的骨盆区域,如果大鼠出现腹部急剧收缩,跳跃,立即舔或刮擦细丝刺激的区域等表现,提示EAP大鼠模型构建成功。
采用随机数字表法将造模成功的75只EAP大鼠分为模型组、小檗碱低剂量组、小檗碱高剂量组、阳性对照组、抑制剂组,每组15 只,另选15 只正常大鼠,同时同部位注射等量的生理盐水作为对照组。小檗碱低剂量组、小檗碱高剂量组[10]、阳性对照组[11]分别灌胃25 mg/kg、50 mg/kg 小檗碱和40 mg/kg 阳性药物塞来昔布溶液,抑制剂组[12]灌胃50 mg/kg小檗碱及0.2 mg/kg AMPK抑制剂compound C,对照组和模型组灌胃等体积生理盐水,每天给药1次,持续4周。
1.3.2 标本采集 末次给药结束后,腹主动脉取血,其中一半血液静置后以3 000×g离心10 min 得血清,置于-80 ℃保存;麻醉大鼠后脱颈椎处死,取出前列腺组织,修剪脂肪及包膜,每组取5只大鼠的前列腺组织储存于-80 ℃,每组取10只大鼠的前列腺组织固定于4%多聚甲醛中。
1.3.3 HE 染色观察各组大鼠前列腺情况 每组取5 只固定在4%多聚甲醛24 h后的大鼠前列腺组织,常规石蜡包埋,切片(厚度4 μm)。HE染色后,于光学显微镜下观察前列腺组织变化。
1.3.4 免疫组织化学法检测大鼠前列腺组织中RORγt、Foxp3 的表达 每组取5 只固定在4%多聚甲醛的大鼠前列腺组织,进行石蜡包埋、切片(厚度4 μm),将切片经二甲苯脱蜡及乙醇水化后,置于微波炉中进行抗原修复10 min,山羊血清封闭30 min 后,加入RORγt、Foxp3 抗体(稀释比例1∶100)在4 ℃下孵育过夜,次日加入适量生物素标记的二抗室温孵育30 min,DAB显色,漂洗后苏木精复染,脱水后中性树胶封片,于光学显微镜下观察RORγt、Foxp3阳性表达情况并拍照记录。结果判定标准:细胞内可见棕黄/褐色颗粒为阳性细胞。每张切片随机读取5 个不重复视野,采用Image-Pro Plus 6.0软件计算蛋白阳性表达的积分光密度(integrated optical density,IOD)值对RORγt、Foxp3阳性表达进行量化。
1.3.5 ELISA 法检测大鼠血清中IL-17、IL-10水平 取各组大鼠血清,按照IL-17、IL-10 的ELISA 试剂盒说明书检测大鼠血清中IL-17、IL-10水平。
1.3.6 流式细胞仪检测大鼠外周血中Th17/Treg 细胞比值 取各组大鼠外周静脉血,加入红细胞裂解液,冰浴后离心,收集细胞沉淀,PBS 洗涤后重悬并计数,取约含有1×106个细胞的悬浮液,加入大鼠PE-TGF-β、FITC-IL-17 单克隆抗体,避光孵育20 min,离心,洗涤,加入预冷的PBS 重悬细胞,混匀后,用流式细胞仪检测Th17、Treg 细胞百分比,并计算比值。
1.3.7 Western blot 检测前列腺组织AMPK、NF-κB p65 及其磷酸化蛋白的表达 取-80 ℃保存的前列腺组织(100 mg),用RIPA裂解缓冲液提取总蛋白,BCA法检测蛋白浓度,将总蛋白(30 μg)通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,然后转移至聚偏二氟乙烯(PVDF)膜。用5%脱脂奶粉封闭1 h 后,将膜与一抗AMPK(1∶1 000)、p-AMPK(1∶1 000)、NF-κB p65(1∶1 000)、p-NF-κB p65(1∶500)、IκBα(1∶1 000)、GAPDH(1∶2 000)于4 ℃下孵育过夜,然后将膜暴露于HRP 标记的二抗(1∶2 000)中1 h。加入电化学发光(ECL)试剂检测蛋白质印迹。以GAPDH 为内参,使用Image LabTM软件分析目标蛋白的灰度值。
1.4 统计学方法 采用GraphPad Prism 5.0软件进行数据分析。计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠前列腺情况比较 与对照组比较,模型组大鼠前列腺组织部分腺腔结构萎缩、损毁,间质水肿,纤维组织增生明显,腺泡上皮变扁平,大量炎性细胞浸润;与模型组比较,小檗碱低剂量组、小檗碱高剂量组和阳性对照组大鼠前列腺组织腔内有粉色分泌物,腺上皮细胞轻度增生,排列整齐,间质炎性细胞少量分布,炎症明显消退;与小檗碱高剂量组比较,抑制剂组大鼠前列腺组织腺上皮细胞明显增生,间质炎性细胞分布较多,见图1。
2.2 各组大鼠前列腺组织中RORγt、Foxp3 表达比较 与对照组比较,模型组大鼠前列腺组织中RORγt 表达水平升高,Foxp3 表达水平降低(P<0.05);与模型组比较,小檗碱低、高剂量组和阳性对照组大鼠前列腺组织中RORγt表达水平降低,Foxp3表达水平升高(P<0.05);与小檗碱高剂量组比较,抑制剂组大鼠前列腺组织中RORγt 表达水平升高,Foxp3表达水平降低(P<0.05),见表1,图2、3。
Tab.1 Comparison of positive expression levels of RORγt and Foxp3 in rat prostate tissue between the six groups表1 各组大鼠前列腺中RORγt、Foxp3阳性表达水平比较(n=5,IOD,)

Tab.1 Comparison of positive expression levels of RORγt and Foxp3 in rat prostate tissue between the six groups表1 各组大鼠前列腺中RORγt、Foxp3阳性表达水平比较(n=5,IOD,)
**P<0.01;a与对照组比较,b与模型组比较,c与小檗碱低剂量组比较,d与小檗碱高剂量组比较,P<0.05。
?

Fig.2 Expression of RORγt in prostate of rats detected by immunohistochemistry satining in each group(×200)图2 免疫组织化学染色检测各组大鼠前列腺中RORγt的表达(×200)
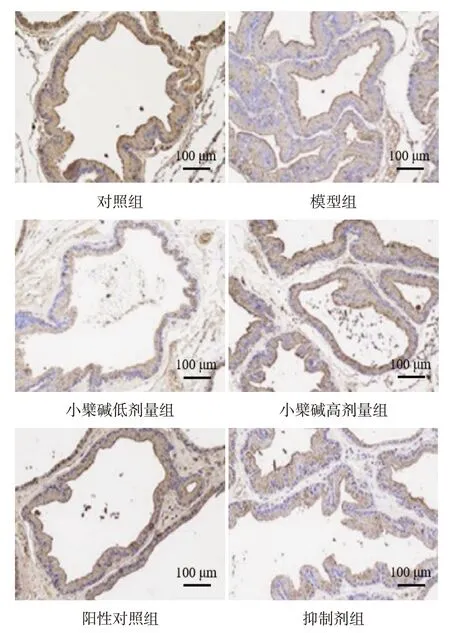
Fig.3 Expression of Foxp3 in prostate of rats detected by immunohistochemistry satining in each group(×200)图3 免疫组织化学染色检测各组大鼠前列腺中Foxp3的表达(×200)
2.3 各组大鼠血清IL-17、IL-10水平比较 与对照组相比,模型组大鼠血清中IL-17 水平升高,IL-10水平降低(P<0.05);与模型组比较,小檗碱低、高剂量组和阳性对照组大鼠血清IL-17 水平降低,IL-10水平升高(P<0.05);与小檗碱高剂量组比较,抑制剂组大鼠血清IL-17水平升高,IL-10水平降低(P<0.05),见表2。
Tab.2 Comparison of serum levels of IL-17 and IL-10 between the six groups表2 各组大鼠血清中IL-17、IL-10水平比较(n=15,ng/L,)

Tab.2 Comparison of serum levels of IL-17 and IL-10 between the six groups表2 各组大鼠血清中IL-17、IL-10水平比较(n=15,ng/L,)
**P<0.01;a与对照组比较,b与模型组比较,c与小檗碱低剂量组比较,d与小檗碱高剂量组比较,P<0.05。
?
2.4 各组大鼠外周血Th17/Treg 平衡比较 与对照组(2.91±0.17)比较,模型组(12.65±1.04)外周血Th17/Treg 比值明显升高(P<0.05);与模型组比较,小檗碱低(8.43±0.48)、高剂量组(3.36±0.36)和阳性对照组(3.13±0.29)外周血Th17/Treg 比值明显降低(P<0.05);与小檗碱高剂量组比较,抑制剂组(6.54±0.35)Th17/Treg 比值显着升高(P<0.05),差异有统计学意义(F=804.963,P<0.05),见图4。

Fig.4 Th17/Treg balance in peripheral blood of rats in each group图4 各组大鼠外周血Th17/Treg平衡情况
2.5 各组大鼠前列腺组织中AMPK/NF-κB 通路相关蛋白表达比较 与对照组相比较,模型组大鼠前列腺组织中p-AMPK/AMPK、IκBα表达水平降低,p-NF-κB p65/NF-κB p65 表达水平升高(P<0.05);与模型组比较,小檗碱低剂量组、小檗碱高剂量组和阳性对照组大鼠前列腺组织中p-AMPK/AMPK、IκBα表达水平升高,p-NF-κB p65/NF-κB p65 表达水平降低(P<0.05);与小檗碱高剂量组比较,抑制剂组大鼠前列腺组织中p-AMPK/AMPK、IκBα 表达水平降低,p-NF-κB p65/NF-κB p65 表达水平升高(P<0.05),见图5、表3。
Tab.3 Comparison of expressions of AMPK/NF-κB pathway related proteins in prostate tissue of rats between the six groups表3 各组大鼠前列腺组织中AMPK/NF-κB通路相关蛋白表达比较(n=5,)

Tab.3 Comparison of expressions of AMPK/NF-κB pathway related proteins in prostate tissue of rats between the six groups表3 各组大鼠前列腺组织中AMPK/NF-κB通路相关蛋白表达比较(n=5,)
**P<0.01;a与对照组比较,b与模型组比较,c与小檗碱低剂量组比较,d与小檗碱高剂量组比较,P<0.05。
?

Fig.5 Expression of AMPK/NF-κB pathway related proteins in rat prostate tissue detected by Western blot analysis图5 Western blot检测大鼠前列腺组织中AMPK/NF-кB通路相关蛋白表达
3 讨论
EAP 是自身免疫性疾病,CD4+T 细胞可诱发巨噬细胞和单核细胞浸润,影响自身反应性T细胞,进而诱发自身免疫炎症反应[13]。Th17 细胞是CD4+T细胞受自身限制而分化的辅助性T 细胞,Treg 细胞是CD4+T 分化产生的具有免疫抑制作用的细胞,Th17 和Treg 细胞的平衡在疾病状态时被打破[14]。本研究采用盆腔区域及双侧肩胛皮下多点注射完全弗式佐剂与前列腺组织混合悬液构建EAP 大鼠模型,结果发现,模型大鼠前列腺组织部分腺腔结构萎缩、损毁,间质水肿,大量炎性细胞浸润,外周血Th17/Treg 比值明显升高,提示EAP 模型构建成功。RORγt是参与Th17细胞分化过的重要启动因子,其对产生IL-17具有直接启动作用[15];而Foxp3是Treg细胞标志物,其可通过转录效应促进基因突变从而参与自身免疫反应[16]。有文献报道,恢复Th17/Treg的平衡可减缓自身免疫性前列腺炎的进展[3]。本研究中模型大鼠前列腺组织RORγt 表达和血清IL-17水平升高,前列腺组织Foxp3表达和血清IL-10水平降低,提示EAP模型大鼠存在Th17/Treg失衡现象。
小檗碱是黄连的主要活性成分,在炎症性疾病中发挥重要作用[17]。研究表明,小檗碱通过调节巨噬细胞和肝细胞中内质网应激介导的ERK1/2 活化来抑制棕榈酸或脂多糖诱导的炎症反应[18];小檗碱对结扎诱导的牙周炎大鼠的牙槽骨丢失和炎症亦有明显的抑制作用[19]。本研究发现,小檗碱处理后EAP 大鼠前列腺组织腺上皮细胞排列整齐,炎症明显消退,可降低RORγt 和IL-17 表达以及外周血Th17/Treg 比值,同时升高Foxp3 和IL-10 表达水平,提示小檗碱可促进EAP大鼠的Th17/Treg平衡。
AMPK 是生物能量代谢调节的关键分子,NFκB与细胞的炎症反应和免疫应答密切相关,AMPK/NF-κB 信号通路对骨关节炎[20]、佐剂性关节炎[21]、肝脂肪变性[22]等多种疾病具有重要调控作用。有研究表明,小檗碱可通过激活AMPK,抑制NF-κB的磷酸化活化,促进巨噬细胞向抗炎表型M2 型极化,并诱导Th17/Treg细胞平衡,对佐剂性关节炎大鼠发挥保护作用[7]。本研究结果显示,模型大鼠前列腺组织中p-NF-κB p65/NF-κB p65 表达水平升高,p-AMPK/AMPK、IκBα 表达水平降低,提示AMPK/NFκB 通路可能参与调节EAP 大鼠的Th17/Treg 平衡。给予小檗碱干预后,大鼠前列腺组织中p-NF-κB p65/NF-κB p65 表达水平降低,p-AMPK/AMPK、IκBα 表达水平升高,推测小檗碱可能通过激活AMPK 促进EAP 大鼠Th17/Treg 趋于平衡。为了验证该推测,本研究利用AMPK 抑制剂compound C 进行干预,结果发现,与小檗碱高剂量组比较,抑制剂组大鼠前列腺组织中腺上皮细胞明显增生,间质炎性细胞分布较多,血清IL-17水平、外周血Th17/Treg比值、前列腺组织RORγt 和p-NF-κB p65/NF-κB p65 表达水平明显升高,血清IL-10 水平、前列腺组织Foxp3、p-AMPK/AMPK 和IκBα 表达水平降低,提示抑制AMPK 活化可减弱小檗碱对EAP 大鼠Th17/Treg 平衡的促进作用,证实小檗碱可通过调节AMPK/NF-κB通路促进EAP大鼠Th17/Treg平衡。
综上所述,小檗碱可通过调节AMPK/NF-κB 信号通路促进EAP大鼠Th17/Treg平衡。然而,小檗碱调控EAP 大鼠前列腺组织Th17/Treg 平衡涉及的通路较多,有待后续进一步深入探究。



