作者单位:510080 广州,中山大学附属第一医院皮肤科
急性鼻窦炎继发中毒性休克综合征一例
唐旭华周晖章星琪
【摘要】中毒性休克综合征是产外毒素的金黄色葡萄球菌或化脓性链球菌释放超抗原,诱导大量的巨噬细胞和CD4`+T细胞活化产生细胞因子风暴,导致的一种特征性感染性休克。该文报道1例急性鼻窦炎继发可能与金黄色葡萄球菌相关的中毒性休克综合征,表现为高热、皮疹、结膜充血、咽红、全身浮肿、持续性低血压、肌痛、胸腔积液、肝损伤、尿蛋白、凝血功能异常、低氧血症,多次血培养和咽拭子、胸水培养均阴性。给予利奈唑胺和头孢哌酮舒巴坦抗感染和抑制超抗原生成、静脉用丙种球蛋白中和超抗原、糖皮质激素抑制超抗原诱导的免疫反应等治疗很快痊愈。该文提示中毒性休克综合征不仅需要选择敏感的抗生素,还可以应用抑制超抗原生成、中和超抗原、抑制超抗原免疫反应的药物。
【关键词】鼻窦炎;中毒性休克综合征
DOI:10.3969/g.issn.0253-9802.2015.07.017
通讯作者,章星琪,E-mail:xingqi.zhang@aliyun.com
Abstract【】Toxic shock syndrome is a characteristic infectious shock caused by the cytokine storm that results from massive activation of macrophages and CD4`+ T cells in response to the release of superantigens by exotoxin-producing Staphylococcus aureus or Streptococcus pyogenes. Here, we report a case of toxic shock syndrome likely caused by Staphylococcus aureus-associated acute sinusitis. The main symptoms were high fever, rash, conjunctival hyperaemia, pharynx hyperaemia, general edema, persistent hypotension, myalgia, pleural effusion, hepatic abnormality, urine protein, coagulation disorder, and hypoxemia. Multiple blood cultures, cultures of throat swabs, and the pleural effusion were all negative for pathogens. The patient had a rapid recovery after intravenous administration of linezolid and cefoperazone-sulbactam to control the infection and inhibit the production of the superantigens, oral administration of glucocorticoids to suppress the immune response to the superantigens, and intravenous administration of gamma globulin to neutralize the superantigens. This result suggests that in addition to sensitive antibiotics, agents that can decrease superantigen production, neutralize superantigens, and suppress the immune response activated by superantigens should also be administered to patients with toxic shock syndrome.
收稿日期:(2015-02-18)
Toxic shock syndrome secondary to acute sinusitis: a case reportTangXuhua,ZhouHui,ZhangXingqi.DepartmentofDermatology,theFirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510080,China
Correspondingauthor,ZhangXingqi,E-mail:xingqi.zhang@aliyun.com
【Key words】Sinusitis; Toxic shock syndrome
中毒性休克综合征(TSS)临床表现为发热、皮疹、毛细血管渗漏继发低血压、恢复期皮肤脱屑、胃肠道、肾脏、肝、中枢神经系统、黏膜、肌肉、血液系统等多器官系统受累,金黄色葡萄球菌(SA)引起的TSS血培养常阴性,而化脓性链球菌(SP)常阳性。TSS占全部感染性休克的27.3%,与其他原因引起的非TSS型感染性休克不同之处在于,TSS有超抗原参与免疫激活和休克发生,以及与轻度皮肤或软组织感染不成比例的SIRS[1]。人类对超抗原特别敏感,静脉给予0.001 μg/kg的超抗原即可引起发热和低血压。识别TSS引起的感染性休克的临床重要性在于治疗不同于非TSS型感染性休克,如不仅要选择敏感的抗生素,还要选择可以通过抑制细菌蛋白表达从而抑制超抗原产生的抗生素如克林霉素、利奈唑胺,可以提供多种超抗原的中和性抗体和调理细菌吞噬作用的静脉用丙种球蛋白(IVIG),以及抑制超抗原诱发SIRS的糖皮质激素[1]。本文报道1例急性鼻窦炎继发可能与SA相关的TSS。
病例资料
一、病史及体格检查
患者女,21岁,因“发热9 d,皮疹伴血压下降6 d”于2013年8月31日入住我院内科重症监护病房。患者9 d前(月经来潮前1 d)出现发热,体温38℃左右,全身肌肉酸痛,双肩部尤甚,7 d前出现头痛、高热,最高体温39.7℃,头颅X片提示左侧急性上颌窦炎,给予哌拉西林、左氧氟沙星抗感染等治疗无效,6 d前出现全身弥漫性红斑,不痒,伴全身浮肿,并出现血压下降至70/42 mm Hg (1 mm Hg=0.133 kPa),呼吸道病原体9项和流感病毒A+B抗原检测均阴性,改用阿奇霉素和莫西沙星抗感染,同时持续给予多巴胺维持升压等抗休克治疗,患者仍有发热,为进一步诊治收入我院。未婚育,平素月经规律,近3个月月经不规则,月经周期15~20 d,8 d前出现末次月经。既往史、个人史、家族史无特殊。入院后行体格检查,体温37.5℃,脉搏120次/分,呼吸20次/分,血压93/62 mm Hg(多巴胺维持)。全身皮肤重度水肿并可见弥漫性红色斑疹(图1),触痛,睑结膜充血显着,口唇糜烂,口腔黏膜光滑,咽充血,扁桃体Ⅰ°肿大,余无异常。
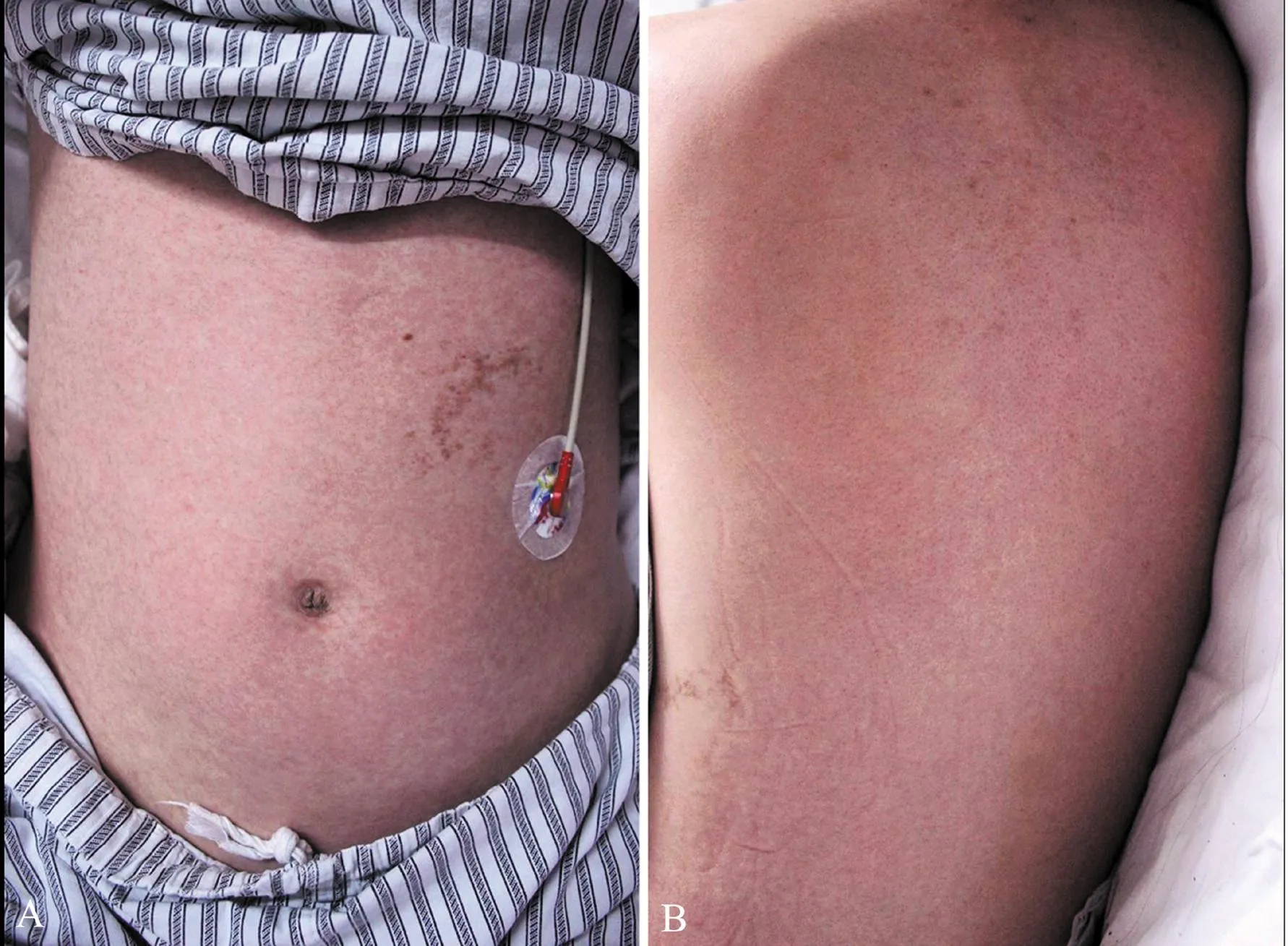
图1中毒性休克综合征患者腹部和背部猩红热样红斑
A:腹部弥漫性淡红色斑疹; B: 背部弥漫性淡红色斑疹
二、实验室及辅助检查
血常规示白细胞16.58×109/L,中性粒细胞0.837,血红蛋白161 g/L,红细胞比积43.1%,血小板150×109/L。血液生化示钠121 mmol/L,钙1.6 mmol/L,渗透压261.7 mOsm/L,ALT 129 U/L,AST 314 U/L,γ-谷氨酰转移酶142 U/L,乳酸脱氢酶大于853 U/L,胆碱酯酶2 973 U/L,白蛋白17 g/L。出凝血常规示活化的部分凝血活酶时间37.4 s,凝血酶时间22.3 s,纤维蛋白原0.98 g/L,D-二聚体22.09 mg/L。血清降钙素原(PCT)0.47 ng/ml。脑钠肽1 346 pg/ml。大便常规正常,尿常规示尿蛋白(+),尿粒细胞酯酶(+),尿液电导率2 mS/cm,余正常。ESR正常,CRP 5.42 mg/L,血清淀粉样蛋白38.2 mg/L。24 h尿蛋白0.745 g。抗O和抗DNA酶B抗体阴性。免疫球蛋白IgA 1.38 g/L,IgG 7.1 g/L,IgM 1.09 g/L,补体C3 0.53 g/L,C4 0.18 g/L。真菌葡聚糖、新型隐球菌抗原、假丝酵母抗原、曲霉菌抗原、肥达氏反应、外斐氏反应、乙型病毒性肝炎两对半、梅毒和HIV检测均阴性,多次血培养和咽拭子培养均阴性。抗核抗体、抗中性粒细胞抗体、抗心磷脂抗体均阴性。考虑诊断为急性鼻窦炎继发TSS。
三、治疗及转归
给予利奈唑胺和头孢哌酮舒巴坦抗感染,甲泼尼龙40 mg/d抗休克,扩容、补充白蛋白,去甲肾上腺素升压,IVIG调节免疫,纤维蛋白原纠正凝血异常,入院第3日再次出现高热,最高体温39.2℃,第4日出现活动后气促,体温上升到39.7℃,血氧下降至86%,给予呋塞米利尿,多索茶碱强心解痉,胸片提示双肺炎症,双侧胸腔积液,胸部CT提示右上肺积气,给予胸腔置管闭式引流,胸水细菌培养阴性,给予无创呼吸机辅助通气,血氧饱和度维持在91%~94%。入院第6日体温降至正常,气促缓解,全身水肿逐渐消退,查动脉血气pH 7.5,PaO264 mm Hg,PaCO237 mm Hg,血氧饱和度98%。入院第7日激素减量为甲泼尼龙20 mg/d,B超提示左侧胸腔中量积液,给予左侧胸腔穿刺置管引流,入院第8日全身水肿完全消退,入院第9日停用利奈唑胺,入院第10日全身皮疹明显消退,入院第11日激素减量为口服甲泼尼龙8 mg/d,复查血常规、白蛋白、出凝血指标恢复正常,PCT、肝酶、脑钠肽明显下降,入院第15日停用激素,全身皮疹完全消退,入院第17日复查胸片正常痊愈出院。
讨论
Todd等(1978年)报道了7例儿童患者(8~17岁),临床表现为高热、头痛、意识模糊、结膜充血、猩红热样皮疹、皮下水肿、呕吐、水样腹泻、尿少、急性肾衰竭倾向、肝损伤、弥散性血管内凝血、重度持续性休克,恢复期受累皮肤出现细碎鳞屑和掌跖脱皮,1例患者死亡,1例出现脚趾坏疽,SA从鼻咽部、阴道、气管黏膜或隐蔽的脓腔或脓肿部位分离得到,血培养阴性,这些分离得到的SA分泌一种与噬菌体Ⅱ型SA分泌的表皮剥脱毒素(颗粒层分离)不同的外毒素(基底层或基底层下分离),后来这种外毒素被命名为中毒性休克综合征毒素-1(TSST-1),月经期青年女性好发,与经期使用月经棉有关,后来发现葡萄球菌肠毒素(SE)B和C也可引起的TSS,其与多数非月经期TSS患者有关。Cone等(1987年)最早报道2例SP引起的TSS,其中1例46岁男性右前臂外伤后感染SP,表现为局部皮肤红肿和含黄色液体的皮肤大疱形成,不久出现类似TSS临床表现,血培养阴性,虽然经过头孢他啶、苯唑西林、水剂青霉素治疗但最终死亡。另1例59岁女性右踝和足部感染SP,不久也出现类似TSS临床表现,血培养也阴性,经治疗痊愈。上述分离得到的2株SP分别分泌毒素A和毒素B,但在患者感染期间不能从血清中检测到针对毒素A或毒素B的抗体,第2例患者在恢复期也只是产生针对毒素B的1∶40低滴度抗体。目前研究发现SP至少有11种不同的超抗原,所有这些超抗原均可以引起TSS[2]。本例患者为青年女性,月经期急性起病,初为左侧急性上颌窦炎,伴高热、肌痛,很快出现非瘙痒性猩红热样红斑、结膜充血显着、口唇糜烂、咽充血、全身浮肿、持续性低血压休克、肝损伤、胸腔积液、出凝血功能异常、低氧血症、尿蛋白、低蛋白血症,同时多次血培养和咽拭子及胸水培养均阴性,抗O和抗DNA酶B抗体均阴性,经利奈唑胺、糖皮质激素、IVIG等治疗较快痊愈,均支持该患者可能为SA相关的TSS,不足的是我院未能开展超抗原的检测。
SA是常见引起败血症的细菌,其定植的部位包括上呼吸道、皮肤、生殖道黏膜上皮,多达40%的患者存在鼻腔或阴道等黏膜定植,但仅约5%的菌株分泌TSST-1,损伤的皮肤表面如特应性皮炎患者的皮损几乎均有SA定植[3-4]。SA相关TSS的危险因素包括月经期的青年女性、术后、鼻腔手术填塞、鼻窦炎、宫内避孕器。常见局部感染的部位包括手术伤口、烧伤创面、肺炎、急性鼻窦炎等。最近有文献回顾性分析76例SA相关的TSS患者,发现17例(21%)有急性鼻窦炎,而无其他部位感染征象,因此该患者也可能是由于左侧上颌窦出现局限性SA感染后释放超抗原入血诱导大量的巨噬细胞和CD4+T细胞活化产生细胞因子风暴导致TSS的发生[5]。
SA是一种兼性好氧菌,分泌的TSST-1及SE和SE样超抗原由噬菌体、质粒、致病性基亚岛和核心染色体编码,不同SA携带不同的SA编码基因[6]。SA或SP本身不需穿过黏膜屏障,而是通过分泌外毒素如细胞溶素α破坏上皮细胞和诱导上皮细胞产生致炎因子和趋化因子等途径,帮助这些超抗原穿过上皮,然后募集T细胞和巨噬细胞到黏膜下通过MHC-Ⅱ信号通路产生大量细胞因子导致TSS的发生[7]。与SA不同的是,SP是一种耐氧厌氧菌,分泌的链球菌溶素O不需要强烈的炎症反应就可以直接破坏黏膜上皮,从而帮助SP及其分泌的超抗原如链球菌致热性外毒素(SPE)穿过上皮到达黏膜下,继而入血,因此SP引起的TSS可以从血液中分离到[8]。除了上述黏膜部位,SP感染破损皮肤后也可诱发TSS,而SA常停留在黏膜表面通过分泌的超抗原诱发TSS。一般情况下多肽抗原特异性刺激万分之一的T细胞活化,而超抗原可以非特异性刺激机体多达50%的T细胞活化,产生TNF-α和TNF-β引起毛细血管外渗和继发低血压,IL-1β引起发热,IL-2和IFN-γ引起皮疹[7]。此外,有研究发现内毒素脂多糖与这些超抗原在诱导细胞因子方面具有协同作用,从而加快休克和增加死亡的发生[9]。除了上述分泌超抗原的菌原学方面外,宿主方面如缺少保护性抗体的生成,也是导致TSS发生的一个重要因素,20%美国人从来不产生针对任何超抗原的抗体,而且大多数月经期TSS患者也检测不到针对TSST-1的保护性抗体IgG,原因一方面可能同宿主基因易感性有关,一方面也可能与超抗原诱导T细胞衰竭等机制抑制保护性抗体的产生有关[9-10]。笔者推测本例患者一方面左侧上颌窦黏膜感染了分泌超抗原的SA,一方面机体未能产生针对超抗原的保护性抗体,由此导致该患者TSS的发生。
TSS的治疗包括纠正血流动力学紊乱及终末器官功能异常,清洁伤口、祛除坏死组织和引流以减少超抗原的产生,应用活化蛋白酶C治疗败血症诱导的微血管栓塞,应用具有抑制超抗原生成的抗生素如克林霉素、利奈唑胺等控制感染,应用含中和超抗原的IVIG或新鲜冰冻血浆,但新鲜冰冻血浆的作用不及IVIG,还有抑制超抗原引起的SIRS的糖皮质激素[11-13]。预后方面,SA相关的TSS总体患病率为1/10万~3/10万,病死率5%~10%,而SP相关的TSS病死率可达50%或更高,其中伴坏死性肌炎的TSS的病死率接近90%[7]。本例患者经上述治疗很快痊愈,提示我们在临床工作中遇到类似患者不但要选用敏感的抗生素如针对细菌细胞壁的β内酰胺类抗生素,而且要选择具有抑制超抗原产生的抗生素,同时可以联合IVIG和(或)糖皮质激素。
参考文献
[1]Smit MA, Nyquist AC, Todd JK. Infectious shock and toxic shock syndrome diagnoses in hospitals, Colorado, USA. Emerging Infect Dis,2013,19(11):1855-1858.
[2]Lin JN, Chang LL, Lai CH, Lin HH, Chen YH. Emergence of Streptococcus pyogenes emm102 causing toxic shock syndrome in Southern Taiwan during 2005-2012. PloS one,2013,8(12):e81700.
[3]曲亚丽,龚五星,蔡月明,凌文辉.败血症142例临床分析.新医学,2006,37(4):238-240.
[4]Schlievert PM, Strandberg KL, Lin YC, Peterson ML, Leung DY. Secreted virulence factor comparison between methicillin-resistant and methicillin-sensitive Staphylococcus aureus, and its relevance to atopic dermatitis. J Allergy Clin Immunol,2010,125(1):39-49.
[5]Chan KH, Kraai TL, Richter GT, Wetherall S, Todd JK. Toxic shock syndrome and rhinosinusitis in children. Arch Otolaryngol Head Neck Surg,2009,135(6):538-542.
[6]McCormick JK, Yarwood JM, Schlievert PM. Toxic shock syndrome and bacterial superantigens: an update. Annu Rev Microbiol,2001,55:77-104.
[7]Brosnahan AJ, Schlievert PM. Gram-positive bacterial superantigen outside-in signaling causes toxic shock syndrome. FEBS J,2011,278(23):4649-4667.
[8]Brosnahan AJ, Mantz MJ, Squier CA, Peterson ML, Schlievert PM. Cytolysins augment superantigen penetration of stratified mucosa. J Immunol,2009,182(4):2364-2373.
[9]Kulhankova K, King J, Salgado-Pabón W. Staphylococcal toxic shock syndrome: superantigen-mediated enhancement of endotoxin shock and adaptive immune suppression. Immunol Res,2014,59(1-3):182-187.
[10] Kansal R, Davis C, Hansmann M, Seymour J, Parsonnet J, Modern P, Gilbert S, Kotb M. Structural and functional properties of antibodies to the superantigen TSST-1 and their relationship to menstrual toxic shock syndrome. J Clin Immunol, 2007,27(3):327-338.
[11]Stevens DL, Ma Y, Salmi DB, McIndoo E, Wallace RJ, Bryant AE. Impact of antibiotics on expression of virulence-associated exotoxin genes in methicillin-sensitive and methicillin-resistant Staphylococcus aureus. J Infect Dis,2007,195(2):202-211.
[12]Tinelli M, Monaco M, Maffezzini E, Cerri MC, Piazza M, Minoli L, Anesi A, Pantosti A. Staphylococcus aureus toxic shock syndrome toxin-1 endocarditis with muscular metastatic abscesses. New Microbiol,2014,37(1):113-118.
[13]Vergis N, Gorard DA. Toxic shock syndrome responsive to steroids. J Med Case Rep,2007,1:5.
(本文编辑:杨江瑜)



