冯扬 赖重媛 陈静燕 古力切木·艾麦尔 廖松洁
神经病理性疼痛(NP)是由体感神经系统疾病或病理损伤所直接导致的疼痛,在全球范围内的患病率是6.9%~10.0%[1-2]。NP对患者的身心健康产生不容忽视的不良影响[3]。由于NP的发生机制未知领域众多,导致目前临床疗效尚不理想。因此,对参与NP发生机制的更深入研究极具临床和科研价值。自噬是细胞内降解长寿蛋白与细胞器的一条主要通路,是近年来的研究热点,在神经病学领域,自噬与帕金森病、老年痴呆、肌肉病及脑血管疾病密切相关,而在以NP为表现的有关周围神经病的研究中,自噬也成为了新的研究方向[4-8]。最近研究显示在不同的NP模型中,脊髓的自噬改变虽然不完全相同,但抑制自噬后大鼠疼痛加重,提示增强自噬可以成为治疗NP的新方向[9]。不少文献报道NP中脊髓背角不同神经细胞自噬水平的改变可能参与其发生与发展[10-12]。而在经典的周围神经病理性疼痛模型即坐骨神经压迫模型(CCI)中,以坐骨神经探讨自噬的相关改变较少,笔者见目前国内文献尚无报道。因此,为了提高对NP中坐骨神经自噬发生的认识,笔者观察了大鼠慢性神经压迫后坐骨神经自噬水平的表达,并进一步观察坐骨神经内不同神经细胞的自噬形态。
材料与方法
一、实验动物
采用36只体质量250~280 g、8周龄的成年雄性Sprague-Dawley大鼠(广东省医学动物中心,许可证号:SCXK粤2013-0011)作为实验动物。大鼠置于SPF级动物房中饲养,12 h光照,自由饮水进食,本研究中的实验动物均按照中山大学实验动物福利和伦理规范进行饲养和实验。
二、材 料
小动物手术器械购于深圳市瑞沃德生命科技有限公司;触觉测量套件购于Ugo Basile中国分公司;生理盐水、电镜固定液购于中山大学附属第一医院;dylight 488标记的山羊抗兔二抗免疫球蛋白G(1∶800,Jackson Immuno Reseach公司);兔抗大鼠LC3抗体(1∶1 000,CST公司);兔抗大鼠P62抗体(1∶500,CST公司);HRP标记抗兔IgG二抗(1∶2 000,CST公司)。
三、方 法
1.动物分组
采用随机数字表法将36只大鼠分为假手术组(Sham组)和坐骨神经结扎组(CCI组)各18只。术前1 d测定2组大鼠的足底基础痛阈值,术后1、4、7 d再次评定。术后4 d或7 d处死大鼠,2组每个时间点各9只大鼠,其中3只取坐骨神经组织行蛋白免疫印迹检测自噬特异蛋白微管相关蛋白轻链3-Ⅱ(LC3-Ⅱ)、P62蛋白的表达,3只冰冻切片后行免疫荧光检测LC3,余下3只行透射电镜观察坐骨神经的自噬状态。
2.模型制备
根据Bennet等[13]的研究制作CCI模型,在无菌条件下进行操作,以10%水合氯醛(300~400 mg/kg,腹腔注射)麻醉后,将大鼠置于俯卧位固定,从右侧大腿中部作1 cm长切口,沿股二头肌方向钝性分离肌肉,暴露坐骨神经主干。用3根3-0丝线(先用生理盐水浸泡)间隔约1 mm结扎,使神经的直径缩窄1/3,结扎力道以引起小腿肌肉轻微颤动反应为宜,逐层缝合手术切口。Sham组大鼠则切开右后肢皮肤,分离肌肉,暴露坐骨神经后立即缝合,仅暴露不结扎。
3.疼痛行为学测试
以大鼠机械性缩足反射阈值(MWT)评价疼痛,通过Chaplan等[14]的Up-down法于术前1 d测定MWT,术后第1、4、7日再次评定。该方法如下:将大鼠置于带有金属网底板的有机玻璃盒中,待大鼠较安静时,采用8根强度呈对数递增方式的Von Frey纤维丝,缓慢垂直刺向其右侧后足掌部,避开爪垫,使Von Frey丝发生弯曲并持续6~8 s。若大鼠在测试时或移开纤维丝时立刻出现快速的撤足反应,则记为阳性,若无反应,则为阴性。以2.0 g为初始刺激强度,若出现阴性反应给予相邻大一级的力度刺激;若出现阳性反应,则给予相邻小一级的力度刺激,如此反复,以第一个转折点的前一个点为起点,再向下连续测定5次,刺激结果为最终的撤足反应模式。根据Chaplan等[14]的计算方法,通过特定的程序将撤足反应模式转换为相应的撤足阈值(单位:m/g)。
4.坐骨神经组织准备
术后第4日和第7日,取Sham组及CCI组各9只大鼠,予腹腔麻醉后,将其中3只大鼠左心室灌注4 ℃生理盐水,快速取出术侧坐骨神经,置于预冷的1.5 ml 离心管中,立即投入液氮中急冻,随后取出放于超低温冰箱备用。再将3只大鼠的左心室行4%多聚甲醛灌注固定,快速取出术侧坐骨神经(结扎处远近段约5 mm),固定6 h,再浸泡于20%、30%蔗糖溶液于4 ℃梯度脱水,待组织沉底后,使用聚乙二醇和聚乙烯醇水溶性混合物(OCT)包埋,行坐骨神经横切面冰冻切片,片厚14 μm。余下3只大鼠予腹腔麻醉后,快速取大小约为1 mm×1 mm×1 mm的术侧坐骨神经组织,投入电镜固定液中,于4 ℃固定2~4 h。
5.免疫荧光检查
取冰冻切片进行免疫荧光检测,一抗为兔抗大鼠LC3抗体(1∶200,CST公司),于4 ℃过夜,加入荧光二抗dylight 488标记的山羊抗兔免疫球蛋白G(1∶800,Jackson Immuno Reseach公司)室温孵育1 h,滴加含4,6-二脒基-2苯基吲哚(DAPI)抗荧光淬灭封片剂封片,于荧光显微镜下观察并记录LC3的表达。
6.蛋白免疫印迹
从超低温冰箱取出坐骨神经样本,提取蛋白,使用二喹啉甲酸(BCA)蛋白测定试剂盒检测蛋白浓度,根据所测蛋白浓度配制蛋白样品,将蛋白样品煮沸5 min。将30 μg蛋白上样至12%浓度的变性聚丙稀酰胺凝胶,电泳后转移至硝酸纤维膜,置5%脱脂奶粉(CST)室温封闭1 h,分别加入兔抗大鼠LC3抗体(1∶1 000,CST公司)、P62抗体(1∶500,CST公司),于4 ℃摇床过夜,加入HRP标记抗兔IgG二抗(1∶2 000,CST公司),于摇床孵育1 h,滴加ECL发光液(Millipore公司)曝光显影。用ImageJ软件分析各条带的吸光度(A值),计算目的蛋白与β-actin A值的比值即为相对表达水平。
7.电镜检查
从4 ℃冰箱取出固定的坐骨神经,使用磷酸盐缓冲液(PBS)充分漂洗,经1%锇酸室温下固定2 h,充分漂洗,置于乙醇中梯度脱水,于丙酮812包埋剂混合液(1∶1)中渗透过夜。包埋剂包埋样本后,行超薄切片,经铀铅双层染色,室温风干。置于电镜下寻找自噬体:定义为细胞中包裹着线粒体、内质网等细胞器或其他胞浆物质的双层膜结构。
四、统计学处理
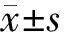
结 果
一、疼痛行为学测试结果
2组大鼠基线评分(足底基础痛阈值)相等;Sham组术后第1、4、7日痛阈值均正常。经重复测量的方差分析结果显示,时间与组别之间的交互效应具有统计学意义(P<0.001),也即Sham组和CCI组大鼠术后痛阈值降低随时间的变化趋势不同。术后第1、4、7日2组痛阈值比较差异均有统计学意义(P均<0.05),见表1。
二、坐骨神经自噬的变化
1.免疫荧光结果
Sham组为均质绿染的LC3荧光信号,与Sham组比较,CCI组术后第4日及第7日出现较多绿色荧光斑点,见图1。
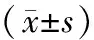
表1 Sham组与CCI组各时间点MWT的变化 m/g
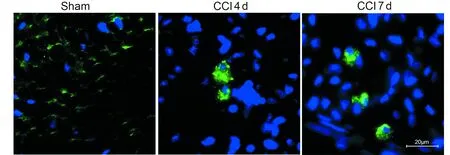
图1 Sham组、CCI术后第4日、术后第7日大鼠坐骨神经LC3与DAPI双标图
2.蛋白免疫印迹检测结果
Sham组坐骨神经LC3-Ⅱ蛋白表达水平低,P62蛋白表达明显;与Sham组比较,CCI术后第4日,LC3-Ⅱ蛋白水平增高,P62蛋白表达减少(P均<0.01),至CCI术后第7日,LC3-Ⅱ蛋白水平进一步上升(P<0.001), P62蛋白表达水平亦较CCI术后第4日有所上升(P<0.05),见表2及图2。

表2 Sham组与CCI术后第4日、术后第7日大鼠坐骨神经LC3-Ⅱ及P62的相对蛋白灰度值
注:a与Sham组比较的P值;b与CCI 4 d比较的P值
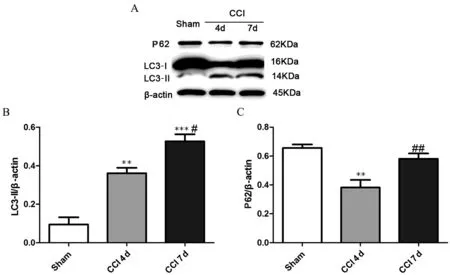
图2 蛋白免疫印迹检测结果
3.电镜观察结果
CCI术后第4日,大鼠坐骨神经髓鞘肿胀,板层松散,髓鞘碎片形状大小不一,施万细胞呈幼稚化改变,核质比增大,胞质内可见膜结合碎片与溶酶体形成自噬溶酶体,也可见有双层膜的自噬体,有髓纤维及部分无髓纤维内可见双层膜的自噬体及自噬溶酶体,见图3A~C。CCI术后第7日,大鼠坐骨神经髓鞘扭曲、溶解消失呈空泡状,髓鞘碎片少,可见幼稚的施万细胞及成髓鞘的施万细胞,胞质内含有不同自噬阶段的自噬体,仅少数有髓纤维出现微丝微管溶解,可见自噬溶酶体,见图3D、E。
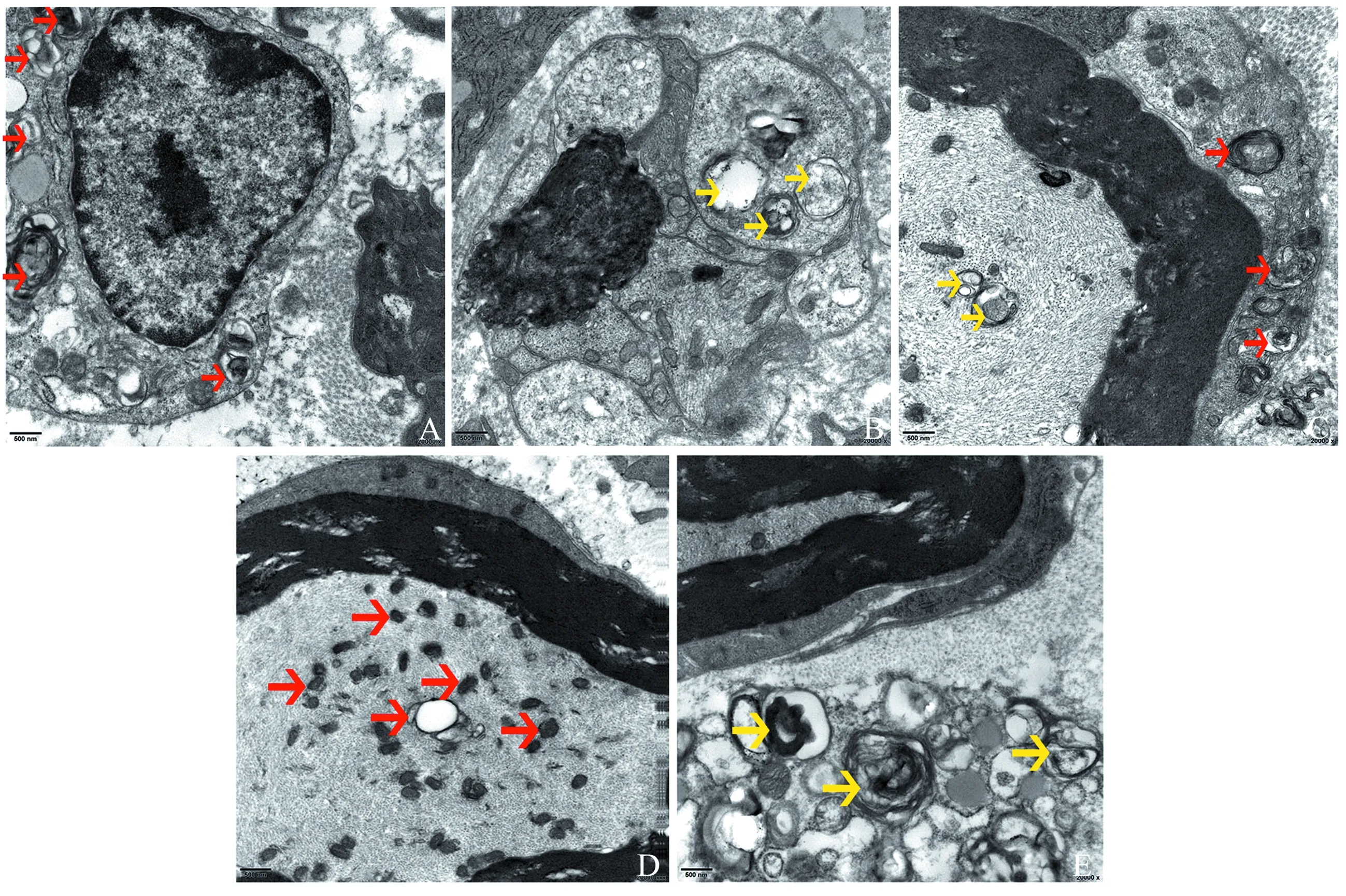
图3 电镜观察CCI术后第4日、术后第7日大鼠坐骨神经超微结构(×20 000)
讨 论
自噬是细胞内的一种“自食”现象,是指内质网来源的膜包绕胞质内蛋白与细胞器形成双层膜结构的自噬体,之后与溶酶体结合形成自噬溶酶体,降解自噬体内容物,生成的产物供细胞循环再利用,这个过程也称为自噬流[15]。在本研究中,笔者通过透射电镜观察CCI组大鼠的坐骨神经超微结构,在施万细胞的胞质、有髓纤维及部分无髓纤维的神经元轴突内均可见双层膜结构的自噬体及自噬溶酶体,提示CCI后损伤神经的施万细胞及轴突神经元内发生了自噬。另有研究表明在大鼠Wallerian变性模型中,坐骨神经通过神经元轴突自噬及施万细胞吞噬的方式清除变性轴突[16]。由此可知CCI后坐骨神经施万细胞及轴突神经元通过自噬清除变性组织,从而创造影响NP的微环境。
自噬高度相关蛋白LC3在自噬体膜的延伸和成熟中发挥关键作用,胞浆型LC3(即LC3-Ⅰ)被ATG4蛋白酶解掉一小段多肽,在ATG7、ATG3及ATG12形成复合物作用下,与磷脂酰乙醇胺共轭,形成膜结合型LC3(即LC3-Ⅱ)[17]。在2016年自噬研究指南中,以LC3-Ⅱ/actin作为自噬研究的关键指标。自噬是一个动态变化的过程,因此只检测自噬体并不能准确评价自噬情况,还要检测自噬的降解途径是否顺畅。P62是自噬溶酶体基本物质及泛素化结合蛋白,经自噬途径降解,与自噬泡清除水平密切相关,常作为反映自噬流的一个指标[18]。曾有研究报道在C57b1/6实验小鼠的CCI模型中发现周围神经损伤1周内自噬被激活,但自噬过程未能正常完成[19]。笔者通过蛋白免疫印迹法检测LC3-Ⅱ蛋白、P62蛋白的表达水平,结果同样印证了CCI后自噬的激活,但是与之前研究不同的是,我们采用的是不同的动物品种及自噬检测时间点,实验结果显示在CCI术后第4日,坐骨神经的自噬活性及自噬降解速度更强更快,至第7日,自噬体的下游降解能力减弱,提示大鼠坐骨神经损伤后局部自噬激活发生了动态的变化。
大鼠CCI模型是经典的诱导NP 的动物模型,通过轻度结扎坐骨神经,使有髓神经纤维选择性地损伤,并保留多数传递痛感的C类纤维[13,20]。该模型能模拟神经受压的临床病例,影响神经血供和轴索运输。在本研究中,笔者根据大鼠造模后的行为学改变进行测定,从而证明了CCI大鼠NP模型的成功建立。另外,还对大鼠CCI后坐骨神经局部自噬水平的表达及不同神经细胞的自噬形态进行了观察。但是自噬在不同神经细胞内及细胞相互间是如何进行调控的,仍待进一步阐明。
综上所述,大鼠坐骨神经损伤后局部自噬激活发生了动态的变化,不同的神经细胞之间(施万细胞及轴突神经元)通过自噬清除变性组织,共同参与影响NP的微环境。在本研究中,笔者对NP中坐骨神经局部自噬的发生进行了初步探究,下一步将进行调控机制的相关研究,以期为今后的治疗开拓新方向。



