细胞培养密度对MCF7乳腺癌细胞integrin β4水解的影响*
网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20150113.1857.017.html
严莉莎1, 霍建云1, 董宇华2, 潘娅1, 王晋星一1, 陈妮1, 臧贵勇3, 胡晓霞1, 陈腾祥1**
(1.贵阳医学院 生理学教研室, 贵州 贵阳550004; 2.贵阳医学院 机能学实验室, 贵州 贵阳550004; 3.贵阳医学院 人体解剖学教研室, 贵州 贵阳550004)
[摘要]目的: 研究细胞培养密度对MCF7乳腺癌细胞integrin β4水解机制。方法: 常规培养高密度和低密度MCF7乳腺癌细胞,分别给予钙离子螯合剂和肝素处理,用Western blot检测不同培养密度MCF7细胞integrin β4的水解情况;用Fluo-3 AM作为钙离子荧光探针,激光共聚焦扫描显微镜检测细胞内钙离子的分布。结果: Western blot检测结果显示,在低密度和高密度培养的MCF7细胞中,integrin β4的水解模式不同;在高浓度培养的细胞中,200 kD integrin β4片段产生增多;激光共聚焦扫描显微镜观察发现,低密度培养MCF7细胞中,钙离子的绿色荧光主要成团或颗粒状分布,而且与红色荧光有较多的重合,部分钙离子分布于细胞核内;在高密度培养的细胞中,钙离子在细胞质膜和细胞核中的定位较少;钙离子螯合剂BAPTA-AM处理可使200 kD integrin β4明显减少;10-6mol/L的肝素能够减少MCF7细胞200 kD水解片段的增多,随着肝素浓度的增高,抑制效果有所增强;相对于BAPTA-AM,10-4mol/L 肝素的抑制效应减弱。结论: 高密度培养的MCF7细胞中,钙离子从钙库中释放,细胞外内流增多,激活calpain 2, 导致200 kD integrin β4水解片段增多。
[关键词]钙离子; 培养密度; 整合素β4; 钙激活中性蛋白酶 2; 肝素
The Proteolysis of Integrin β4 in MCF7 Breast Cancer
整合素(integrin)β4既是黏附蛋白,也是重要的细胞信号转导分子,能通过结构或构象的改变,参与细胞形态的重构和细胞信号转导[1-2]。integrin β4可被钙激活中性蛋白酶2 (calcium activated neutral protease 2,CANP2, calpain 2)水解,产生200 kD大小的水解片段,进而使其发生修饰改变[3]。本课题组在前期研究中发现,乳腺癌细胞MCF7在不同培养密度条件下,其integrin β4被水解的程度不一样,表明在高密度培养时,相应的integrin β4的水解机制激活,本实验拟对其相关机制进行研究。
1材料与方法
1.1材料和设备integrin β4 antibody购于美国cell signaling technology公司,DMEM、胎牛血清(FBS)购于美国invitrogen公司,Hoechst 33258染色液、Fluo-3 AM(钙离子荧光探针)、1,1′-双十八烷基-3,3,3′,3′-四甲基吲哚羰花青高氯酸盐(1,1′-Dioctadecyl-3,3,3′,3′- tetramethylindocarbocyanine perchlorate,DiI)购于上海碧云天生物技术有限公司,BAPTA-AM、肝素钠(heparin sodium)购于美国Sigma-aldrich公司,其它试剂均为进口或国产分析纯。电泳仪及微型垂直电泳槽购于美国GE公司,GBOX iChemiXR化学发光及凝胶成像仪购于美国Syngene公司,FV-1000激光共聚焦扫描显微镜、倒置荧光显微镜购于奥林巴斯公司,高速冷冻离心机购于美国Beckman公司。
1.2细胞培养与分组MCF7细胞株购买于中国科学院典型培养物保藏委员会细胞库,于DMEM(高糖)培养液、37 ℃、10%FBS和5% CO2培养。低密度(sparse)培养的细胞检测时,细胞密度为70%,培养液为中性;高密度(dense)培养的细胞检测时,细胞密度为100%,培养液为酸性(pH 3~4)。
1.3MCF7细胞integrin β4水解情况用Western blot检测不同培养密度MCF7细胞integrin β4的水解情况,检测钙离子螯合剂BAPTA-AM将MCF7细胞内的钙离子进行螯合后integrin β4的水解情况,以及利用10-6、10-5和10-4mol/L的肝素分别处理MCF7细胞后,integrin β4的水解情况。Western blot检测:将MCF7细胞铺于6 cm培养皿,培养到所需的密度,用37 ℃ PBS快速洗涤,加入预冷RIPA细胞裂解液(20 mmol/L Tris-HCl pH 7.5,1% NP40,0.5% Na Deoxycholate, 0.1% SDS,10% glycerol,137 mmol/L NaCl,1 mmol/L CaCl2,1 mmol/L MgCl2,50 mmol/L NaF,1 mmol/L Na Vanadate,1 mmol/L PMSF)冰上裂解10 min,刮取裂解物,4 ℃ 12 000 r/min离心30 min,平衡各组总蛋白浓度后,上样行SDS-PAGE电泳,转印至PVDF膜,室温封闭1 h,4℃ I抗孵育过夜,室温II抗(HRP耦合)孵育1 h,加入化学发光试剂,GBOX iChemiXR进行化学发光检测。每组Western blot实验重复3次。
1.4MCF7细胞细胞钙离子分布用Fluo-3 AM作为钙离子荧光探针,对MCF7细胞内的钙离子和细胞质膜进行染色,激光共聚焦扫描显微镜检测细胞内钙离子的分布。将105个(低密度组)和106个(高密度组)MCF7细胞铺于多聚赖氨酸包被的激光共聚焦专用玻底皿。当细胞培养至需要的密度时,加入Hoechst 33258 染色液孵育30 min,然后加入5×10-6mol/L DiI (细胞膜红色荧光探针)孵育5 min后,在激光共聚焦扫描显微镜下观察。
2结果
2.1细胞培养密度影响MCF7乳腺癌细胞integrin β4的水解在低密度和高密度培养的MCF7细胞中,integrin β4的水解模式不同。在高浓度培养的细胞中,200 kD分子量大小的integrin β4片段产生增多,而低密度培养的细胞中增多不明显。见图1。
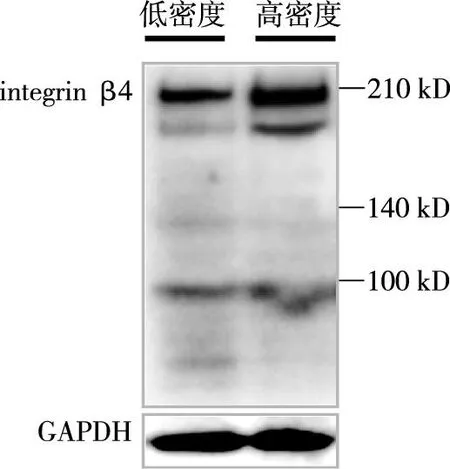
图1 细胞培养密度对MCF7乳腺癌细胞integrin β4水解的影响Fig.1 The cell density of culture involved in the proteolysis of integrin β4 in MCF7 breast cancer cells
2.2高密度与低密度培养的MCF7细胞中钙离子的分布如图2所示,蓝色荧光示细胞核,绿色荧光示钙离子,红色荧光示细胞质膜,Merge为三种颜色荧光的重叠图像。在低密度培养的MCF7细胞中,钙离子的显色较为明显,指示钙离子的绿色荧光主要成团或颗粒状分布,而且与红色荧光有较多的重合,不少钙离子分布与细胞核内。在高密度培养的细胞中,钙离子显示不明显,在细胞质膜和细胞核中的定位较少。
2.3BAPTA-AM对高密度培养 MCF7细胞integrin β4水解的影响BAPTA-AM处理可使200 kD分子量大小的integrin β4明显减少。BAPTA-AM的溶剂DMSO(与BAPTA-AM处理的细胞液的终浓度相同)处理后,200 kD大小的integrin β4与未处理细胞没有差异。见图3。
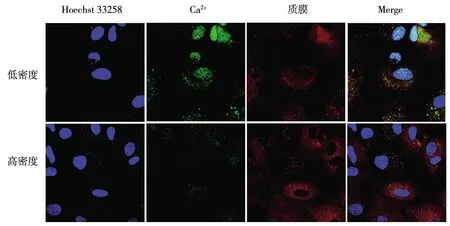
图2 不同培养密度MCF7乳腺癌细胞内钙离子的分布Fig.2 The distribution of Ca2+ in MCF7 breast cancer cells with different dense of culture
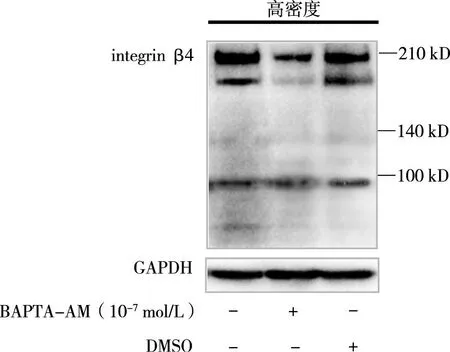
图3 BAPTA-AM对 MCF7乳腺癌细胞integrin β4水解的影响Fig.3 The role of Ca2+-chelator BAPTA-AM in the proteolysis of integrin β4 in MCF7 breast cancer cells
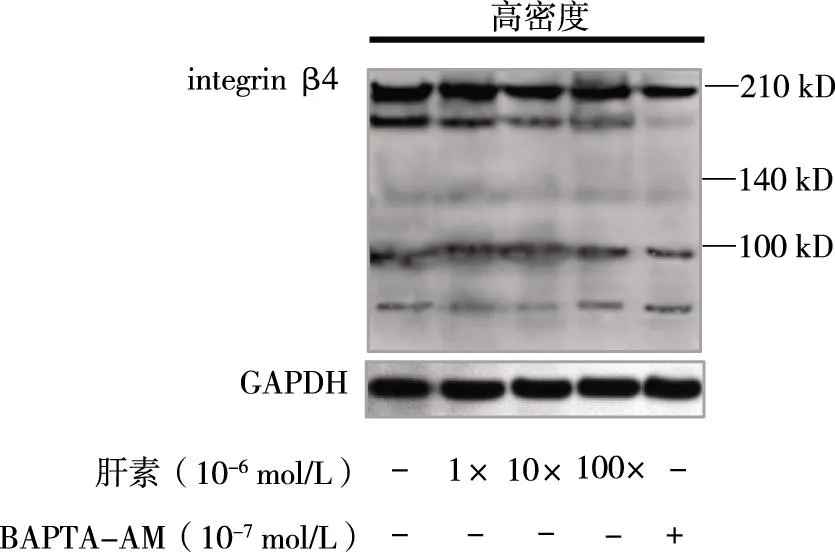
图4 肝素对 MCF7乳腺癌细胞integrin β4水解的影响Fig.4 The role of antagonist of IP3R in the proteolysis of integrin β4 in MCF7 breast cancer cells
2.4肝素对高密度培养 MCF7细胞integrin β4水解的影响10-6mol/L的肝素能够减少MCF7细胞200 kD水解片段的增多,而且随着肝素浓度的增高,抑制效果有所增强。10-5mol/L 和10-4mol/L肝素对200 kD integrin β4 生成的抑制效应没有明显增强。相对于BAPTA-AM,10-4mol/L肝素的抑制效应较弱。见图4。
3讨论
本实验中,低密度培养的MCF7细胞密度为70%,细胞处于指数增长期,培养液较为新鲜,pH值为中性;而高密度培养时,MCF7细胞密度达到100%,而且培养液在酚红的指示下,显示为黄色,pH值3~4。表明在高密度培养时,肿瘤细胞产酸增多,而且由于细胞竞争性的需求,培养液已经陈旧,营养补给不足,这种培养情形有些类似于体内肿瘤的生长。当肿瘤体积还小时,血液和组织液的供给相对充足;随着肿瘤体积不断增大,其无序生长的结构使得血供和组织液的渗透不够,肿瘤组织内部的细胞处于缺氧和缺营养的状态,从而发生应激变化[4]。
本实验对MCF7细胞integrin β4水解情况进行检测,发现高密度培养情况下,200 kD integrin β4水解片段产生增多,而200 kD integrin β4水解片段的产生与calpain 2有关[3]。表明在高密度培养条件下,calpain 2的活性有所增强,导致200 kD integrin β4水解片段增多。毫摩尔级的钙离子是calpain 2的激活剂[5],提示在高密度培养的条件下,肿瘤细胞胞浆的钙离子浓度是增高的。钙离子在细胞内的分布多数集中于内质网、线粒体和细胞核等钙库中,在细胞受到刺激时,钙离子可以从钙库中释放出来,进入胞浆,影响胞浆内钙离子调控的蛋白质或酶的功能;另外,也可以导致细胞外的钙离子内流,使胞浆钙离子浓度增高[6]。本课题组用激光共聚焦扫描对细胞内的钙离子浓度进行检测,结果发现不同培养密度的MCF7细胞中,钙离子分布不一样,在低密度培养的细胞中,指示钙离子的探针的绿色荧光呈颗粒状聚集,聚集的位置与指示质膜的探针的红色荧光有重叠,除此之外,钙离子还大量聚集于细胞核中。相反,在高密度培养的细胞中,钙离子的聚集现象不明显,所以细胞内钙离子的显示不够突出,说明高密度培养的细胞中,钙离子散在分布于细胞质中;而低密度培养的细胞中,钙离子大多数聚集于钙库,胞浆反而分布少。
本实验进一步用钙离子的螯合剂BAPTA-AM处理,结果发现高密度培养的MCF7细胞200 kD的integrin β4减少到几乎看不出。BAPTA是钙离子的螯合剂,BAPTA-AM是BAPTA的乙酰甲酯衍生物,通过AM法,使其容易进入细胞内,螯合胞浆内的钙离子,使得游离的钙离子减少[7];而且,BAPTA-AM还可以进入内质网等钙库中螯合钙离子,使得钙离子很难释放,胞浆内游离的钙离子减少,从而导致calpain 2酶活性降低,200 kD的integrin β4减少。1,4,5-三磷酸肌醇受体(1,4,5-triphosphate receptor,)位于内质网膜上,是内质网内钙离子流出到胞浆的通道,受1,4,5-三磷酸肌醇(IP3)激活打开。肝素是IP3R的抑制剂,可有效抑制内质网等钙库的钙离子释放[8]。本实验发现肝素可抑制MCF7细胞200 kD integrin β4水解片段的产生,而且呈浓度依赖方式。但是,肝素的处理浓度达到一定的量后,抑制效应达到饱和,不再增强,说明细胞还通过胞外钙离子内流来激活calpain 。这些结果说明,高密度培养的MCF7细胞中,钙离子从钙库中释放,从细胞外内流增多,激活了calpain 2, 导致integrin β4相应水解片段增多。
参考文献4
[1] Dellambra E, Prislei S, Salvati AL, et al. Gene correction of integrin beta4-dependent pyloric atresia-junctional epidermolysis bullosa keratinocytes establishes a role for beta4 tyrosines 1422 and 1440 in hemidesmosome assembly[J]. J Biol Chem, 2001(44):41336-41342.
[2] Guo W, Pylayeva Y, Pepe A, et al. Beta 4 integrin amplifies ErbB2 signaling to promote mammary tumorigenesis[J]. Cell, 2006(3):489-502.
[3] 胡晓霞, 霍建云, 张金娟, 等. 钙激活中性蛋白酶-2对整合素β4水解的影响[J].贵阳医学院学报, 2015(1): 1-5.
[4] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011(5):646-674.
[5] Storr SJ, Carragher NO, Frame MC, et al. The calpain system and cancer[J]. Nature Reviews Cancer, 2011(5):364-374.
[6] 郭静,蒲咏梅,张东才.钙离子信号与细胞凋亡[J].生物物理学报, 2005(1): 1-18.
[7] Balino P, Monferrer L, Pastor R, et al. Intracellular calcium chelation with BAPTA-AM modulates ethanol-induced behavioral effects in mice[J]. Experimental Neurology, 2012(2):446-453.
[8] Tsao LI, Su TP. IP3 receptor antagonist heparin uncompetitively inhibits [3H](+)-SKF-10047 binding to sigma receptors[J]. European Journal of Pharmacology, 1996(1):R1-R2.
(2014-12-01收稿,2015-01-05修回)
中文编辑: 文箐颍; 英文编辑: 周凌
Cell is Affected by Cell Density in Culture
YAN Lisha1, HE Jianyun1, DONG Yuhua2, PAN Ya1,WANG Jingxingyi1, CHEN Ni1,
ZANG Guiyong3, HU Xiaoxia1, CHEN Tengxiang1
(1.DepartmentofPhysiology,GuiyangMedicalCollege,Guiyang550004,Guizhou,China; 2.FunctionalLaboratory,
GuiyangMedicalCollege,Guiyang550004,Guizhou,China; 3.DepartmentofAnatomy,
GuiyangMedicalCollege,Guiyang550004,Guizhou,China)
[Abstract]Objective: To investigate the role and it's mechanism of cell density in culture on the proteolysis of integrin β4. Methods: MCF7 was cultured to reach 70% (sparse) and 100% (dense) and then treated with calcium ion chelator and heparin. Western blot was utilized to detected the proteolysis of integrin β4, and Fluo-3 AM was used as fluorescence probe for calcium ion to observe its localization inside cell. Results: As Western blot results showing, the proteolysis profile of integrin β4 was different between cells cultured as sparse and dense. In dense, 200 kD integrin β4 fragment was increased, which could be attenuated by BAPTA-AM (calcium ion chelator) and heparin. However, the inhibitor effects of heparin was dose-dependent, but reached to its platform as 10-5mol/L, which was less than BAPTA-AM even if heparin reached to10-4mol/L. Conclusions: In MCF7 cells with high density, calcium ion release from ion bank inside and inflow from outside of cells, leading to activation of calpain 2 and increase of product of integrin β4 fragment with 200 kD.
[Key words]calcium ion; density of cell culture; integrein β4;calcium-activated neutral proteases 2; heparin
[中图分类号]R737.9; R73-37
[文献标识码]A
[文章编号]1000-2707(2015)01-0006-04
通信作者**E-mail:gzctxin@qq.com网络出版时间:2015-01-13
[基金项目]*国家自然科学基金资助项目(NO. 81060176);贵阳医学院院基金(院基金合同字第2012005号);贵州省高层次人才科研条件特助经费(TZJF-2009年38号)



