张丽娟, 高晓明
(苏州大学 生物医学研究院, 江苏 苏州 215123)
钙网蛋白片段cDNA克隆、蛋白表达及免疫学活性研究*
张丽娟, 高晓明*
(苏州大学 生物医学研究院, 江苏 苏州 215123)
目的: 研究钙网蛋白(CRT)发挥免疫生物学活性的主要功能区域。方法: 采用PCR法从CRT基因cDNA全长中扩增第150-230位编码氨基酸所对应的核苷酸序列片段,利用分子生物学方法构建原核重组表达质粒,采用大肠杆菌表达系统进行原核表达;通过亲和纯化得到目的蛋白,分析目的蛋白特性;并通过体内、体外实验对蛋白的免疫学活性进行分析。结果: 成功构建了表达CRT150-230片段(rCRT/150-230)的原核表达质粒,并从细菌裂解液上清中纯化得到目的蛋白,蛋白单体通过分子间二硫键形成二聚体,天然状态下形成多聚体;体外研究表明rCRT/150-230促进小鼠脾细胞的分裂,活化巨噬细胞产生一氧化氮(NO),诱导人外周血单个核细胞产生TNF-α;体内研究表明,rCRT/150-230刺激小鼠产生高滴度抗体,该特异性抗体能识别rCRT/150-230与rCRT。结论: rCRT/150-230蛋白具有与rCRT相似的免疫活性,因此推测该蛋白片段是全长CRT发挥免疫学活性的区域。
免疫学; 钙网蛋白; 蛋白片段; 生物学活性
钙网蛋白(calreticulin,CRT)是一个维持机体Ca2+稳态的钙连蛋白,CRT存在于多种生物体中,包括脊椎动物、无脊椎动物乃至高等植物[1-3]。CRT的分子量为46 kDa,由N-domain、P-domain和C-domain[4-6]3个结构域组成。CRT属于多功能蛋白,参与了细胞中多种生物学过程,如分子伴侣、Ca2+平衡、细胞黏附、基因表达、凋亡细胞清除、抗肿瘤免疫应答等。由于CRT特殊的结构组成,研究人员对其中一些结构域或片段进行了功能研究[7-10],但关于CRT免疫学活性的研究并未见报道。本课题组其他研究人员已经证明了CRT中存在一段高保守性片段39-272片段,在CRT中发挥免疫调节作用[11]。为了找到CRT发挥免疫调节功能更为核心的区域,本研究利用分子生物学实验技术从CRT基因cDNA全长中扩增出从150-230位编码氨基酸所对应的核苷酸序列片段(CRT/150-230),并对该蛋白的免疫生物学活性进行了分析。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 菌株E.coliDH5α与E.coliBL21(DE3)来源于天根生化公司,质粒pGEM-T来源于Promega,质粒pET28a、pET28a-CRT为本室保存。
1.1.2 细胞 脾细胞取自6~8周龄的雌性BALB/c小鼠,体重约18~20 g;腹腔巨噬细胞来源于硫代乙醇酸钠(3%)处理3 d后的雌性C57BL/6小鼠,每只注射体积2 mL, 6~8周龄,体重18~20 g。实验动物均由上海斯莱克动物有限公司提供。
1.1.3 酶与主要试剂 限制性内切酶、T4 DNA连接酶、T4 DNA聚合酶来源于Promega公司,质粒抽提试剂盒、DNA回收试剂盒来源于AXYGEN公司,Ni-NTA凝胶购自Novagen公司,PCR引物来源于Invitrogen公司合成。
1.2 方法
1.2.1 原核表达质粒构建 以pET28a-CRT质粒为模板,以P1(5′CGGATCCTACAAGGGCAAGAATGTGCTGAT3′)、P2(5′CCCAAGCTTCTAATCTGTGGGGTCATCGATCTTG3′)为引物通过PCR扩增CRT片段150~230序列,将片段连接至pGEM-T Vector,转化至克隆菌DH5α中,从正确的克隆菌中抽提质粒进行酶切,将酶切出的目的片段连接至pET28a质粒中,转化至克隆菌DH5α中,鉴定正确后,抽提质粒转化至表达菌BL21中。
1.2.2 rCRT/150-230蛋白表达 将携带目的基因序列的重组质粒转化至BL21感受态中,从卡那霉素(Kana,100 mg/L)琼脂糖平板上筛选阳性克隆,挑取平板上单克隆接种于Kana培养基LB中,37 ℃培养6~8 h,转接一次新鲜的LB,37 ℃培养至OD600为0.6~0.8,以终浓度0.1 mmol/L的IPTG为诱导条件,培养5 h即可。
1.2.3 蛋白亲和纯化 扩增培养重组表达菌,收集菌体并将其悬浮于1×缓冲液(5 mmol/L咪唑缓冲液)中,冰水中超声破碎(工作时间与间歇时间各3 s,功率为200 W,每次时间为20 min,共3次),离心收集裂解液上清,纯化前用0.000 45 mm 滤膜过滤,并与Ni-NTA柱室温颠倒孵育2 h,重新装柱,用1×binding buffer将杂蛋白冲洗净,用300 mmol/L咪唑缓冲液将目的蛋白洗脱出来。
1.2.4 脾细胞增殖实验 引颈处死BALB/c,于超净台取脾并研磨成单细胞悬液,ACK裂解红细胞,用RPMI-1640培养液(10%胎牛血清)将单细胞悬液调为5×106cell/mL细胞数加入96孔细胞培养板中,实验孔中加入一定浓度的蛋白样品,对照孔加入等体积的培养基, 37 ℃ 5% CO2培养,48 h后无菌加入0.02 mL 噻唑蓝(浓度为5 mg/mL),反应4 h后离心弃上清,加入0.15 mL DMSO,振荡10 min,检测OD 492 nm吸光度值。
1.2.5 腹腔巨噬细胞活化实验 取C57BL/6小鼠,每只小鼠腹腔注射2 ml 3%硫代乙醇酸钠,第3 天将小鼠引颈处死,无菌PBS灌洗小鼠腹腔,提取腹腔巨噬细胞(一般情况下不需使用ACK裂解红细胞),用培养液将细胞浓度调至1.5×106/mL,置于96孔培养板中,实验组中加入一定浓度的蛋白样品,对照组加入等体积的培养基,于恒温培养箱中培养24 h后取上清液,测定其NO含量。
1.2.6 人外周血单个核细胞刺激实验 取正常人外周血,用淋巴细胞分离液无菌分离出单个核细胞,将细胞浓度调为5×106/mL加入96孔培养板中,实验组为一定浓度的蛋白样品,对照组为等体积的培养基,恒温培养箱中培养,12 h后取细胞培养上清,测定其TNF-α含量。
2 结果
2.1 rCRT/150-230原核表达载体构建
以pET28a-CRT质粒为模版,PCR法扩增rCRT/150-230 CDNA(图1A),将该片段与pGEM-T Vector连接并测序成功后,经BamHI和HindⅢ 双酶切鉴定(图1B),将酶切产物连接至pET28a,并转化至克隆菌DH5α中,挑取单克隆进行菌体PCR鉴定,得到大小与预期一致片段(图1C),提取质粒并转化到表达菌株BL21中,经菌体PCR鉴定,重组质粒构建成功。
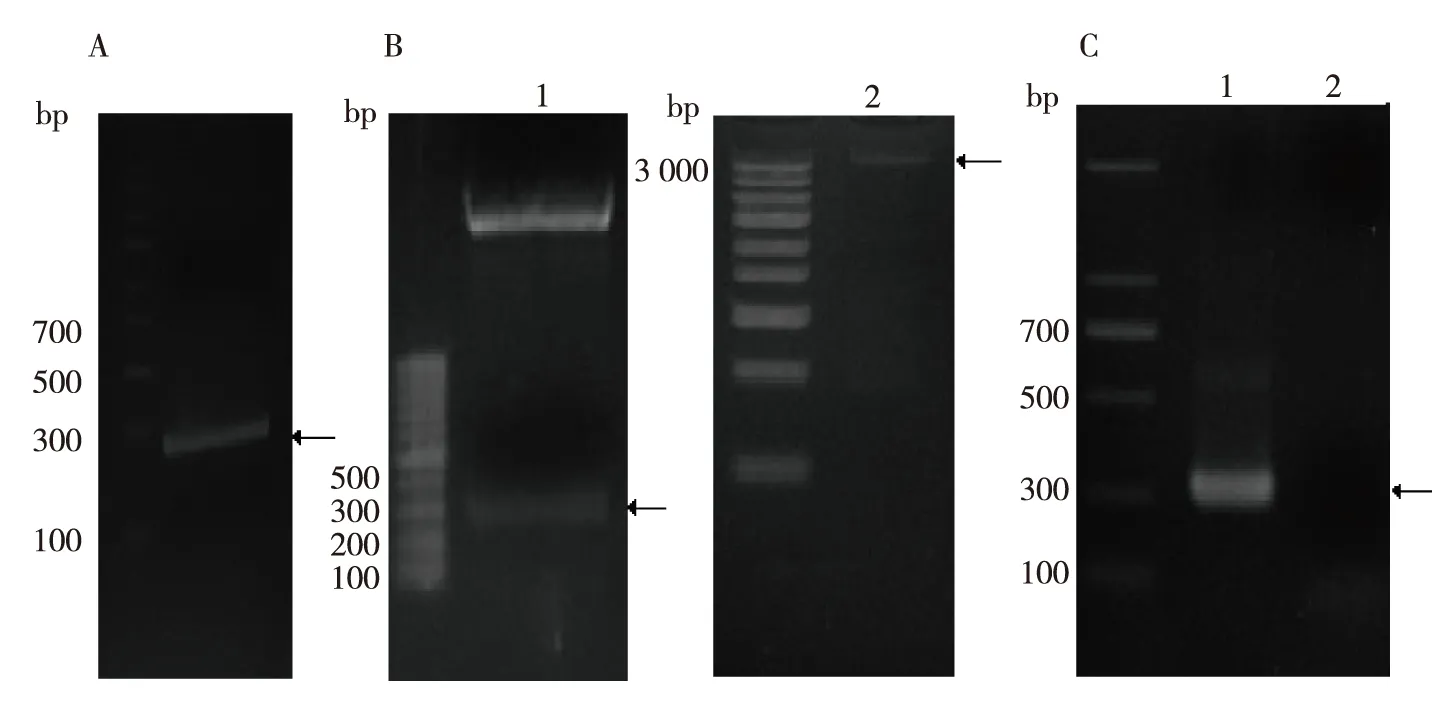
注:A为PCR扩增产物,B为双酶切鉴定结果(1为酶切质粒,2为未酶切质粒),C为菌体PCR鉴定(1为rCRT/150-230菌PCR,2为空白对照)
2.2 rCRT/150-230蛋白表达及纯化
将构建好的原核重组表达菌株,于37 ℃,0.1 mmol/L IPTG条件下进行大量扩增及诱导表达,从细菌裂解液上清中检测到目的蛋白(图2A),采用亲和层析法,提取目的蛋白(图2B)。
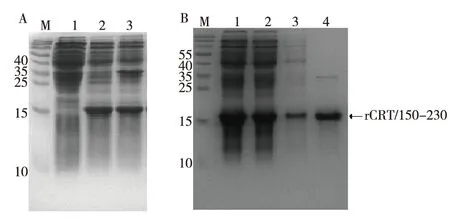
注:A为蛋白表达(1为未诱导菌液,2为诱导菌液上清,3为诱导菌液包涵体),B为蛋白纯化(1为裂解上清液,2为流穿液,3为洗涤液,4为洗脱液)
2.3 rCRT / 150-230理化特性分析
对rCRT / 150-230及实验室原有的原核表达的CRT片段蛋白(rCRT/39-272,rCRT/120-250)进行理化特性分析,结果表明,CRT片段150-230蛋白纯度不低于90%。 Native-PAGE及SDS-PAGE跑胶结果显示,在自然状态下rCRT/150-230以多聚体的形式存在(图3A),在没有还原剂2-ME存在的条件下,rCRT/150-230以二聚体形式存在(图3B)。标签蛋白部分并无半胱氨酸存在,排除重组蛋白rCRT/150-230两端的标签蛋白对蛋白理化性质的影响,说明蛋白存在分子间二硫键。
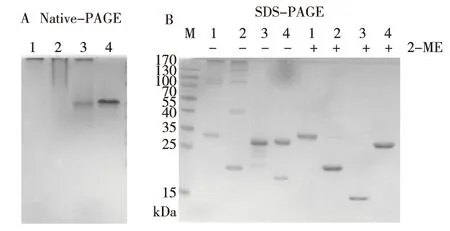
注:A为非变性胶鉴定(1为rCRT,2为rCRT/120-250,3为rCRT/150-230,4为rEGFP), B为SDS-PAGE胶鉴定(1为rCRT/39-272,2为rCRT/120-250, 3为rCRT/150-230,4为 rEGFP)
2.4 rCRT/150-230免疫学活性
细胞实验鉴定目的蛋白的免疫学活性,结果表明,rCRT/150-230可有效促进脾细胞增殖(图4A),还能够刺激小鼠腹腔巨噬细胞分泌NO(图 4B),并且能够刺激正常人外周血单个核细胞(PBMC)分泌TNF-α(图4C),并且刺激效果与全长CRT无显着差异。rCRT/150-230、rCRT组与rEGFP及空白对照组相比差异有统计学意义。
2.5 rCRT/150-230免疫原性
通过体内实验鉴定原核蛋白的免疫原性。结果显示,rCRT/150-230可使小鼠体内产生高滴度的抗rCRT/150-230特异性抗体(图 5A),并且该抗体能够识别rCRT蛋白(图 5B),说明该蛋白具有良好的免疫原性。
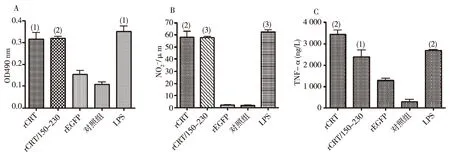
注:A为小鼠脾细胞增殖实验,B为小鼠腹腔巨噬细胞刺激实验,C为人外周血单个核细胞刺激实验;与对照组比较,(1)P<0.05,(2)P<0.01,(3)P<0.001
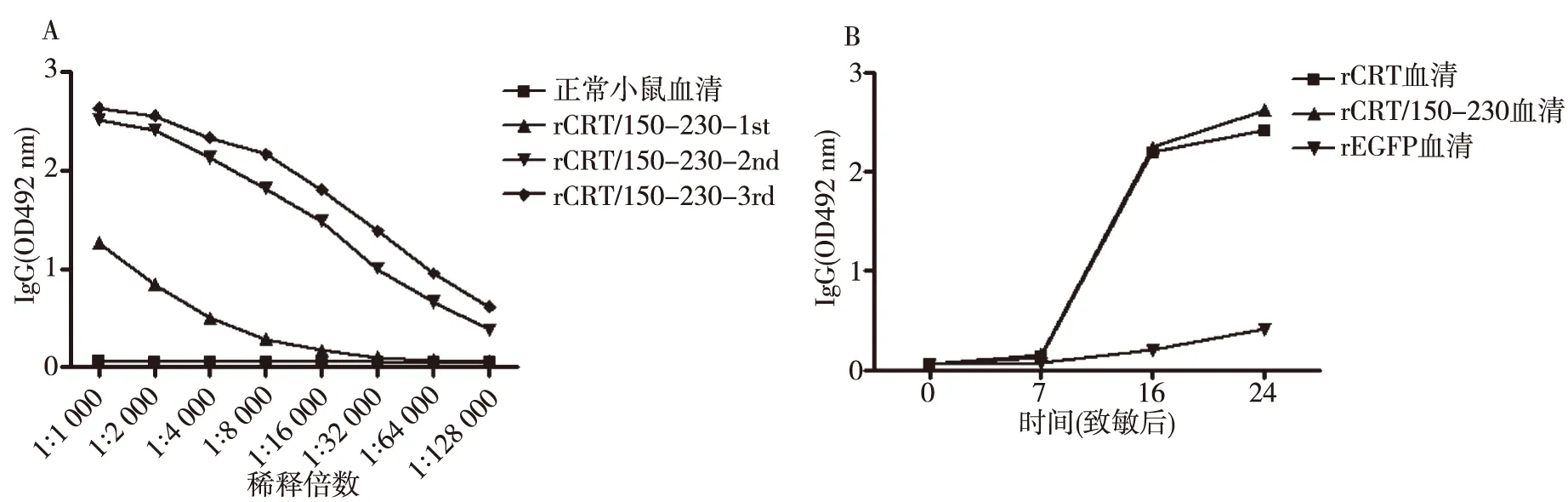
注:A为rCRT/150-230免疫血清抗体效价测定,B为rCRT/150-230血清抗体识别rCRT
3 讨论
CRT最早是从肌浆网中分离得到的一种Ca2+结合蛋白,在维持Ca2+稳态中发挥重要作用。随着研究不断深入,有学者发现CRT是一个多功能保守蛋白,广泛存在于生物体中,不仅存在内质网中发挥作用,在细胞膜及胞外都参与了生物学过程,膜型CRT在清除机体内凋亡的细胞及抵御肿瘤的免疫过程都发挥了重要作用[12-13]; 胞外也检测到可溶性CRT,尤其在类风湿性关节炎(RA)患者的血清和关节液中检测到了可溶性CRT的存在,而健康人中未检测到CRT[11]。Tarr等[14]研究发现,RA患者的血清及关节液中可溶性CRT与疾病活动度指标相关,提示了可溶性CRT在临床应用中可作为一个新的诊断指标或药物靶标。由于CRT具有与热休克蛋白相似的免疫学活性[15],被认为是广义热休克蛋白家族的一员,参与机体的固有免疫系统和适应性免疫系统。本研究前期结果证实了可溶性CRT的免疫学活性,并且将CRT发挥免疫学活性的功能片段确定为39-272[11], 在实验室前期研究基础之上,本研究对CRT的功能片段进行更精确的研究。
本研究通过分子生物学方法,经PCR扩增出CRT片段150-230,成功构建rCRT/150-230原核表达质粒。结果表明,rCRT/150-230在原核表达菌中大部分以可溶性形式存在,不易降解,便于纯化。根据rCRT/150-230的氨基酸组成,分子内存在一个半胱氨酸,理论上可形成分子间二硫键,在维持二硫键自然存在的情况下,该蛋白是以二倍体的形式存在,与预期相符。对纯化得到的蛋白进行体内、体外实验检测其免疫生物学活性,体外细胞实验显示150-230片段蛋白促进了脾细胞分裂、诱导巨噬细胞产生NO、诱导人外周血单个核细胞产生细胞因子TNF-α。rCRT/150-230,这些生物学特性与Hong等[11]报道的rCRT/39-272的生物学活性相似。Huang等[16]研究表明,CRT的生物学活性受到蛋白寡聚化或多聚化程度的影响,多聚体形式的rCRT比单体形式的rCRT有更强的生物学活性,而自然状态下,Native-PAGE则显示rCRT/150-230是以多聚体的形式存在,其表现出较强的免疫生物学活性。本研究体内实验表明,150-230片段蛋白诱导小鼠发生体液免疫应答,产生高滴度的抗150-230片段蛋白与全长CRT抗体,即蛋白150-230片段具有很强的免疫刺激效果,与全长CRT相当。
本研究结果表明rCRT/150-230区域是CRT的主要免疫学活性区域,能否找到CRT更小的功能区域还有待进一步研究。
[1] Chen F. Identification and characterization of cDNA clones encoding plant calreticulin in barley[J]. Plant Cell, 1994(6):835-843.
[2] Mazzarella RA.Determination of the sequence of an expressible cDNA clone encoding ERp60/calregulin by the use of a novel nested set method[J]. Gene, 1992(2):217-225.
[3] Smith MJ, AC. elegans gene encodes a protein homologous to mammalian calreticulin[J]. DNA Seq, 1992(4):235-240.
[4] Smith MJ,Koch GL.Multiple zones in the sequence of calreticulin (CRP55, calregulin, HACBP), a major calcium binding ER/SR protein[J]. EMBO J, 1989(12):3581-3586.
[5] Fliegel L. Molecular cloning of the high affinity calcium-binding protein (calreticulin) of skeletal muscle sarcoplasmic reticulum[J]. J Biol Chem, 1989(36):21522-21528.
[6] Michalak M.Calreticulin[J].Biochem J, 1992(Pt 3):681-692.
[7] Pike SE.Vasostatin, a calreticulin fragment, inhibits angiogenesis and suppresses tumor growth[J]. J Exp Med, 1998(12):2349-2356.
[8] Pike SE.Calreticulin and calreticulin fragments are endothelial cell inhibitors that suppress tumor growth[J]. Blood, 1999(7):2461-2468.
[9] Ling S.Identification of the rheumatoid arthritis shared epitope binding site on calreticulin[J]. PLoS One, 2010(7):e11703.
[10]Liu C.Suppression of MHC class I surface expression by calreticulin's P-domain in a calreticulin deficient cell line[J]. Biochim Biophys Acta, 2010(5):544-552.
[11]Hong C.Functional analysis of recombinant calreticulin fragment 39-272: implications for immunobiological activities of calreticulin in health and disease[J]. J Immunol, 2010(8):4561-4569.
[12]Obeid M.Calreticulin exposure dictates the immunogenicity of cancer cell death[J]. Nat Med, 2007(1):54-61.
[13]Gardai SJ.Cell-surface calreticulin initiates clearance of viable or apoptotic cells through trans-activation of LRP on the phagocyte[J]. Cell, 2005(2):321-334.
[14]Tarr JM.Extracellular calreticulin is present in the joints of patients with rheumatoid arthritis and inhibits FasL (CD95L)-mediated apoptosis of T cells[J]. Arthritis Rheum, 2010(10):2919-2929.
[15]Basu S,Srivastava PK. Calreticulin, a peptide-binding chaperone of the endoplasmic reticulum, elicits tumor- and peptide-specific immunity[J]. J Exp Med, 1999.(5):797-802.
[16]Huang SH. Self-oligomerization is essential for enhanced immunological activities of soluble recombinant calreticulin[J]. PLoS One, 2013(6):e64951.
(2015-04-18收稿,2015-05-26修回)
中文编辑: 刘 平; 英文编辑: 赵 毅
A Study of cDNA Cloning, Protein Expression and Immunological Activity of Calreticulin Fragment
ZHANG Lijuan, GAO Xiaoming
(InstituteofBiologyandMedicineSciences,SoochowUniversity,Suzhou215123,Jiangsu,China)
Objective: To investigate the major functional areas of calreticulin (CRT) that exerts immunobiological activity. Methods: Amplified a 150-230 fragment of rCRT and constructed a prokaryotic expression vector by molecular biology method. Then adopted E.Coli to express the protein which was purified by affinity purification. The biochemical property of rCRT/150-230 was tested. Analyzing the immunobiological activity of this proteininvitroandinvivo. Results: rCRT/150-230 protein was purified from the bacterial lysate supernatant, and it had good solubility and existed as polymer in nature. rCRT/150-230 could effectively stimulate the proliferation of mice spleen cells, and activate the secretion of NO of mice macrophage, and stimulate human peripheral blood mononuclear cells to secrete TNF-α, and has strong immunogenicity that induces the process of humoral immune response in mice. Conclusion: rCRT/150-230 appears similarity immunobiologic functions with rCRT, it could be inferred that it might be the major functional area of rCRT.
immunology; calreticulin; protein fragment; biological activity
时间:2015-08-07
http://www.cnki.net/kcms/detail/52.5012.R.20150807.2241.014.html
R34-33
A
1000-2707(2015)09-0954-05
*通信作者 E-mail:xmgao@suda.edu.cn



