张 禹, 严志凌, 史 荔, 杨宏英, 杨家方, 俞建昆, 张新文, 刘舒媛, 李传印, 姚宇峰**
(1.中国医学科学院&北京协和医学院 医学生物学研究所, 云南 昆明 650118; 2.云南省重大传染病疫苗研发重点实验室, 云南 昆明 650118; 3.昆明医科大学附属第三医院, 云南 昆明 650106)
·基础研究·
云南汉族人群脂联素基因启动子区多态性与宫颈癌的相关性*
张禹1,2, 严志凌3, 史荔1,2, 杨宏英3, 杨家方1,2, 俞建昆1,2, 张新文1,2, 刘舒媛1,2, 李传印1,2, 姚宇峰1,2**
(1.中国医学科学院&北京协和医学院 医学生物学研究所, 云南 昆明650118; 2.云南省重大传染病疫苗研发重点实验室, 云南 昆明650118; 3.昆明医科大学附属第三医院, 云南 昆明650106)
[摘要]目的: 探讨脂联素基因启动子区单核苷酸多态(SNP)与宫颈癌的相关性。方法: 选取云南地区汉族女性人群中宫颈癌患者395例组为癌症组、癌前病变者131例为癌前病变组,正常健康体检者685例作为对照组,采用TaqMan探针基因分型方法对3组人群外周血DNA中脂联素基因启动子区的3个SNP位点rs266730(G>A)、rs266729(C>G)和rs16861194(A>G)进行基因分型,并构建单倍型,评估上述3个SNP位点及单倍型与宫颈癌的相关性。结果: 癌症组、癌前病变组及对照组间脂联素基因启动子区的3个SNP位点rs266730(G>A)、rs266729(C>G)和rs16861194(A>G)的基因频率和等位基因频率比较,差异均无统计学意义(P>0.05); rs266730(G>A)、rs266729(C>G)和rs16861194(A>G)构建的单倍型频率在癌症组、癌前病变组和对照组中的差异无统计学意义(P>0.05)。结论: 在云南汉族女性群体中,脂联素基因启动子区的rs266730(G>A)、rs266729(C>G)和rs16861194(A>G)3个SNP位点多态性与宫颈癌的发生无关。
[关键词]宫颈肿瘤; 癌前状态; 多态性,单核苷酸; 基因型; 脂联素
女性肿瘤中宫颈癌的发病率仅次于乳腺癌,每年约有超过500 000的新发病例,病死率为50.36%,有近90%的宫颈癌发生在发展中国家,而中国每年约有13.5万新发病例,占世界新发病例的30%[1]。现已证实许多单核苷酸多态性(single nucleotide polymorphisms,SNP) 位点可能会引起基因功能的改变,与宫颈癌的发生、发展密切相关[2]。脂联素是一种主要由白色脂肪组织分泌的多肽类激素,与代谢密切相关,可抑制炎症因子的产生,对抗氧化应激,从而阻止恶性肿瘤的进展[3]。研究表明体内循环脂联素水平与结直肠癌[4]、胃癌[5]、乳腺癌[6]、前列腺癌[7-8]等癌症的患病风险存在负相关。Harak和Vasseur等[9-10]对在日本和法国人群检测脂联素基因组时发现,脂联素基因启动子区有三个高频的SNP位点分别为-11426A>G(rs16861194)、-11391G>A(rs17200539)和-11377C>G(rs266729)。Laumen 等[11]发现脂联素基因启动子区的SNP-11426A>G(rs16861194)和-11377C>G(rs266729)可以调控启动子的活性,这些变异会影响脂联素水平,本课题组前期研究发现,云南汉族人群脂联素基因启动子区位点-11426A>G(rs16861194)、-11377C>G(rs266729)和-12140G>A(rs266730)的变异频率均大于1%。有研究报道肺癌患者中rs266730(G>A)的分布与正常人存在差异,A基因是肺癌的保护性基因[12]。本研究选取脂联素基因启动子区3个SNP位点rs266730(G>A)、rs266729(C>G)和rs16861194(A>G)进行基因分型及单倍型构建,以正常人群作为对照,对癌前病变与宫颈癌患者进行分层分析,探讨脂联素基因启动子区SNP位点在宫颈癌发生发展中的作用。
1材料与方法
1.1标本来源
根据“知情同意”原则,随机选取2012年10月~2016年2月住院确诊为宫颈癌患者及癌前病变患者526例作为病例组。宫颈癌患者395例作为癌症组,鳞癌344例,腺癌46例,鳞腺癌5例;癌前病变患者131例作为癌前病变组。诊断标准依据《临床诊疗指南-妇产科学分册》,年龄30~75岁,采用FIGO分期系统对宫颈癌进行临床分期。排除术前接受放化疗等抗肿瘤治疗的病例,排除患有其他恶性肿瘤或合并心血管疾病、糖尿病、肝炎、肾病等疾病的患者及资料不全者。2013年10月~2015年10月685例正常体检者作为对照组,30~75岁,HPV检测为阴性无宫颈病变的健康女性。病例组与对照组年龄比较,差异无统计学意义(t=-1.557,P>0.05)。所有被检者均为居住于云南地区,彼此无血缘关系的汉族个体。
1.2方法
1.2.1基因组DNA提取采集所有被检者空腹静脉血5 mL,用EDTA 或肝素抗凝,使用QIAGEN血基因组DNA 小量试剂盒提取DNA,并以超微量紫外可见分光光度计(ND-2000,美国ThermoScientific公司)检测DNA的浓度和纯度。
1.2.2标准品以3个已知基因型(野生纯合子、突变纯合子、杂合子)的样品作为标准对照(均为本课题组经基因测序样本验证),SNP-rs266730(G>A)样本的野生纯合子、突变纯合子、杂合子的基因型分别是GG、AA及AG, rs266729(C>G)为CC、GG及CG ,rs16861194为(A>G)AA、GG及AG。在每次进行TaqMan探针荧光定量PCR检测SNP位点的基因分型时,标准对照样品与待分型样品统一进行检测并分型。
1.2.3基因分型检测采用TaqMan探针荧光定量PCR方法检测SNP位点的基因分型(罗氏LightCycler 480 实时荧光定量PCR 仪),TaqMan探针、引物和SNP分型试剂(TaqMan Genotyping Master Mix)均购自美国ABI公司,针对每个SNP 位点所设计的2 条探针分别用VIC 和FAM 荧光标记。rs266730(G>A)、rs266729(C>G)及rs16861194(A>G)引物序列根据在美国ABI公司网站(http://www.appliedbiosystems.com)的ID号(AHZAH26、 C_2412786_10及C_33187775_10)合成。PCR 反应体积为10 μL,反应条件95 ℃预变性10 min,92 ℃变性15 s、60 ℃退火1 min,共40 个循环,40 ℃长延伸5 min。以3 个已知基因型的标准样品作为对照。结果采用罗氏LightCycler 480 基因分型软件(LCS480 1.5.1.62)进行分析和基因分型。对部分TaqMan 分型结果进行测序验证。
1.3统计学方法
Hardy-Weinberg平衡检验样品的代表性。对照组和病例组年龄采用t检验,癌症组、癌前病变组和对照组性别差异以及脂联素基因启动子区SNP 位点基因型和等位基因频率差异采用χ2检验。SHEsis 软件程序计算连锁不平衡,用D'表示,D'值为0时,连锁完全平衡;D'值为1 时,连锁完全不平衡;D'>0.8时,认为存在连锁。构建脂联素基因启动子区域的3个SNP位点的单倍型[13-14],并用χ2检验检测单倍型频率在癌症组、癌前病变组与对照组之间的差异,P<0.05为差异有统计学意义。
2结果
2.1脂联素基因SNPs 位点的等位基因与基因型频率
Hardy-Weinberg平衡检验结果表明,脂联素基因启动子区3个SNP 位点在病例组和对照组中的基因型分布全部符合Hardy-Weinberg平衡(表1),提示所用样本具有群体代表性。癌症组、癌前病变组和对照组中rs266730(G>A)、rs266729(C>G)及rs16861194(A>G)3个SNPs等位基因分别以G、C及 A为主,基因型以GG、CC 及AA为主;脂联素基因3个SNPs 位点等位基因和基因型频率在癌症组、癌前病变组和对照组间比较,差异无统计学意义(P>0.05);见表2。
2.2脂联素基因SNPs 位点连锁不平衡检测
连锁不平衡分析显示,癌症组与对照组比较,rs266729(C>G)与rs266730(G>A)、rs266729(C>G)与rs16861194(A>G)间存在强连锁(D’=0.870、0.903),rs266730(G>A)与rs16861194(A>G)关联不明显(D′=0.665);在癌症组与癌前病变组的比较中,rs266729(C>G)与rs266730(G>A)、rs266729(C>G)与rs16861194(A>G)及rs266730(G>A)与rs16861194(A>G)间存在强连锁(D’=0.906、0.822、0.803);癌前病变组与对照组比较,rs266729(C>G)与rs266730(G>A)、 rs266729(C>G)与rs16861194(A>G)存在强连锁(D’= 0.901、0.999),rs266730(G>A)与rs16861194(A>G)关联不明显(D’=0.668)。
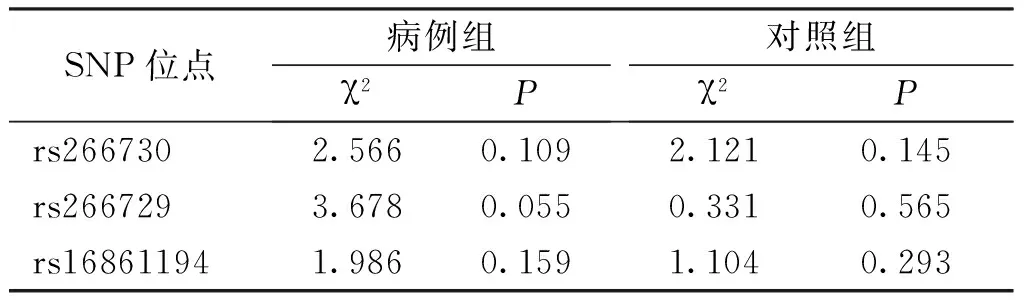
表1 病例组与对照组本3个SNP位点Hardy-Weinberg平衡检验
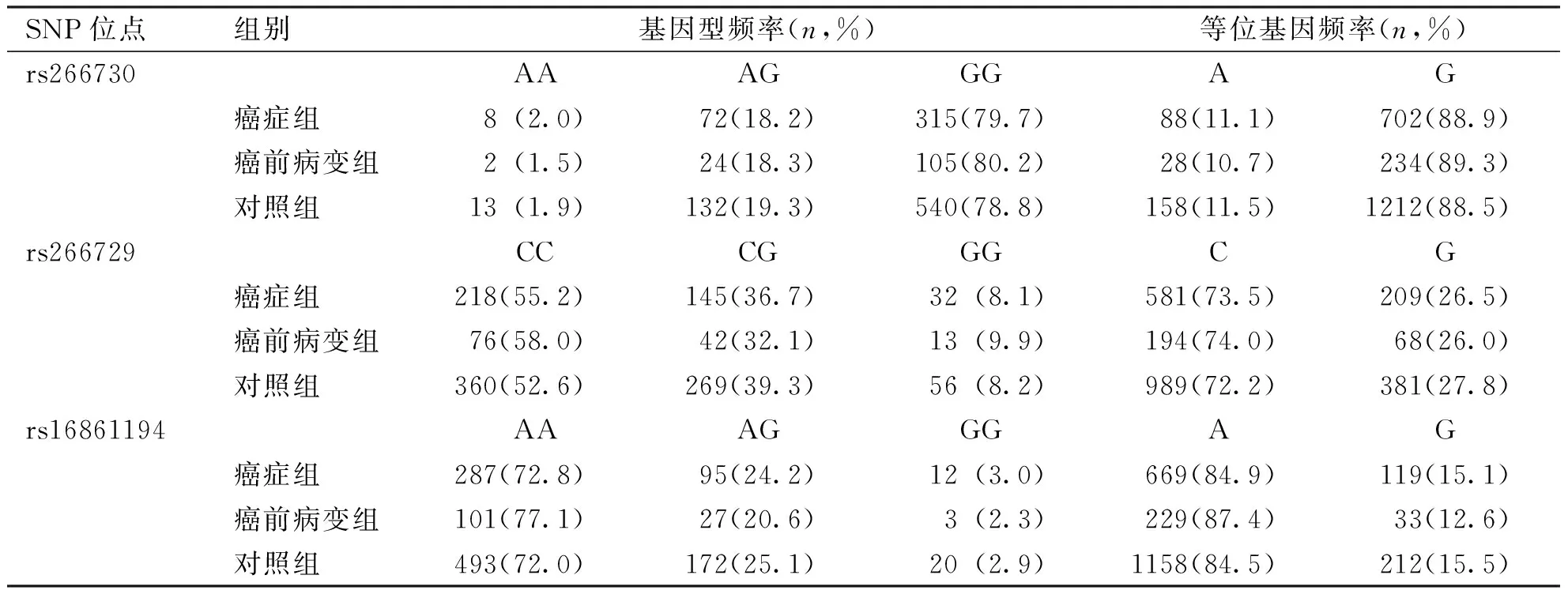
表2 癌症组、癌前病变组和对照组脂联素基因启动子区3个SNP位点的基因频率及等位基因频率分布
2.3脂联素基因启动子区SNPs位点单倍型构建及频率
根据连锁不平衡结果构建脂联素基因启动子区3个SNP位点的单倍型。构建单倍型是仅选择强连锁的SNP位点进行构建,结果显示,构建的单倍型频率在癌症组、癌前病变组和对照组中的分布差异无统计学意义(P>0.05),见表3和表4。
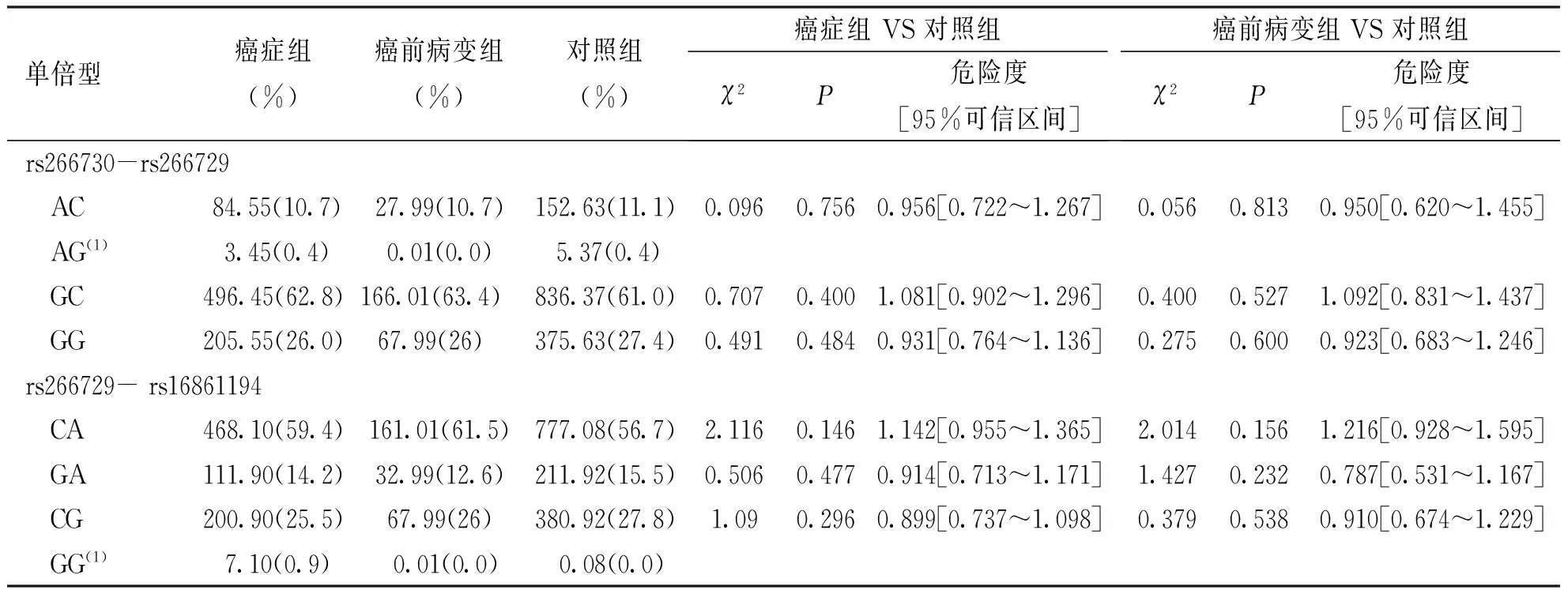
表3 构建的脂联素基因启动子区3个SNP位点的单倍型在癌症组与癌前病变组中的分布
(1)代表群体单倍型出现频率<3%时,不进行统计学分析
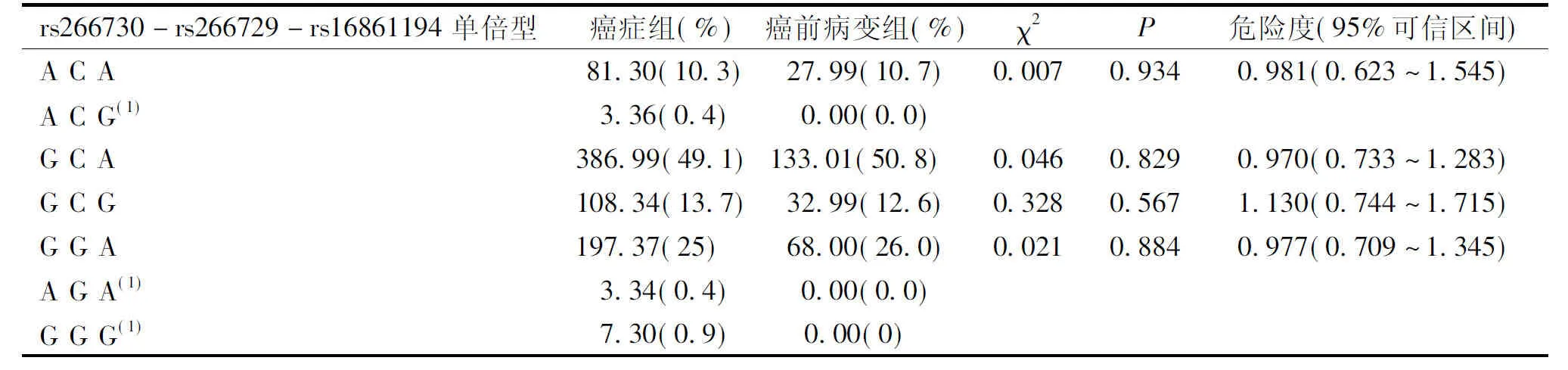
表4 脂联素基因启动子区3个SNP位点单倍型在癌症组和癌前病变组的分布
(1)群体单倍型出现频率<3%时,不进行统计学分析
3讨论
宫颈癌的发生发展与高危型HPV感染密不可分。然而,尽管95%以上的宫颈癌患者中均发现了HPV病毒的癌蛋白表达,但不是每一个感染高危型HPV的患者均发展为宫颈癌。宫颈癌的发生除与外部环境有关,宿主自身的遗传背景对宫颈癌的发生发展也起着重要的作用。研究表明,血浆脂联素水平与一些恶性肿瘤的发生发展密切相关[15]。肿瘤患者血浆脂联素水平偏低,并且肿瘤细胞表达脂联素受体,脂联素与肿瘤的发生存在某种联系[16]。脂联素可与脂联素受体结合,并激活受体和下游的信号转导通路。脂联素还可以选择性地抑制多种促有丝分裂因子(如血小板衍生生长因子BB、碱性成纤维生长因子等)来抑制肿瘤的增殖[17]。直接作用于肿瘤细胞,或者通过诱导血管内皮细胞凋亡,可抑制血管生成[18-19]。血清脂联素水平与恶性肿瘤密切相关。脂联素基因在转录水平上受到多种转录因子的调控,可通过其启动子区的顺式作用元件或第一个内含子区而调控脂联素基因的表达[11, 20]。推测位于脂联素基因启动子区域的SNP可能影响脂联素基因的表达。近年来,大量的研究证明脂联素基因SNP与癌症的发生密切相关。Preet K.Dhillon等[7]在美国男性中检测了13个脂联素基因SNP位点,发现脂联素基因SNP位点rs266729、rs182052、rs822391及rs2082940与前列腺癌的发生相关,同时发现SNP位点与血浆脂联素水平相关。在中国汉族男性中,脂联素的3个SNP(rs3774262、rs266729和rs182052),除rs3774262与前列腺癌的发生(P=0.04)及血浆脂联素水平密切相关外,rs266729和rs182052与前列腺癌的发生和血浆脂联素水平无关[8]。课题组前期研究证实肺癌组织中脂联素基因启动子区的SNP-rs266730G>A的A基因是肺癌的保护性基因[12]。本研究应用Taqman assay进行基因分型,研究脂联素基因启动子区域的SNPs与宫颈癌发生发展的关系,结果发现在云南汉族女性人群中,脂联素基因启动子区SNP-rs266729(C>G)、rs266730(G>A)和rs16861194(A>G)基因频率及等位基因频率与宫颈癌发生无关(P>0.05)。原因可能为上述三个SNP在不同个体的单倍型组合并未影响到转录因子与脂联素基因启动子的结合能力,进而未影响脂联素基因的表达,也可能是在云南汉族的遗传背景下,上述3个SNP在云南汉族女性人群中的遗传易感性相同,或相同的SNP位点对于不同的癌症类型的作用不尽相同。
综上所述,在云南汉族群体中,脂联素基因启动子区SNP-rs266729C>G、rs266730G>A和rs16861194A>G与宫颈癌的发生无关。课题组将进一步对宫颈癌患者的血清脂联素水平进行测量,完成从脂联素基因启动子区SNP到血清脂联素水平再到宫颈癌发生发展的研究,从各方面验证脂联素与宫颈癌发生发展的联系。为宫颈癌的早期诊断寻找重要的分子靶标,也为宫颈癌的早发现和早治疗提供依据。
4参考文献
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012 [J]. CA cancer J Clin, 2015(65): 87-108.
[2] Mehta AM, Spaans VM, Mahendra NB, et al. Differences in genetic variation in antigen-processing machinery components and association with cervical carcinoma risk in two Indonesian populations [J]. Immunogenetics, 2015(67): 267-275.
[3] Xing SQ, Zhang CG, Yuan JF, et al. Adiponectin induces apoptosis in hepatocellular carcinoma through differential modulation of thioredoxin proteins [J]. Biochem Pharmacol, 2015(93): 221-231.
[4] Ahn KY, Lee MK, Kim DI, et al. Cardiopulmonary fitness, adiponectin, chemerin associated fasting insulin level in colorectal cancer patients [J]. Supporti Care Cancer, 2016 (7):2927-35.
[5] Diakowska D, Markocka-Maczka K, Szelachowski P, et al. Serum levels of resistin, adiponectin, and apelin in gastroesophageal cancer patients [J]. Dis Markers, 2014(2014): 619-649.
[6] Ahmed SD, Khanam A, Sultan N,et al. Serum adiponectin level association with breast Cancer risk: evidence from a Case-Control Study [J]. Asian Pac J Cancer Prev, 2015(16): 4945-4948.
[7] Dhillon PK, Penney KL, Schumacher F, et al. Common polymorphisms in the adiponectin and its receptor genes, adiponectin levels and the risk of prostate cancer [J]. Cancer Epidemioc Biomarkers Prev, 2011(20): 2618-2627.
[8] Gu CY, Li QX, Zhu Y, et al. Genetic variations of the ADIPOQ gene and risk of prostate cancer in Chinese Han men [J]. Asian J Androl, 2014(16): 878-883.
[9] Hara K, Boutin P, Mori Y, et al. Genetic variation in the gene encoding adiponectin is associated with an increased risk of type 2 diabetes in the Japanese population [J]. Diabetes, 2002(51): 536-540.
[10]Vasseur F, Helbecque N, Dina C, et al. Single-nucleotide polymorphism haplotypes in the both proximal promoter and exon 3 of the APM1 gene modulate adipocyte-secreted adiponectin hormone levels and contribute to the genetic risk for type 2 diabetes in French Caucasians [J]. Hum Mol Genet, 2002(11): 2607-2614.
[11]Laumen H, Saningong AD, Heid IM, et al. Functional characterization of promoter variants of the adiponectin gene complemented by epidemiological data [J]. Diabetes, 2009(58): 984-991.
[12]Li Y, Yao Y, Qian X, et al. The association of adiponectin gene promoter variations with non-small cell lung cancer in a Han Chinese population [J]. PloS one, 2015(10): e0127751.
[13]Li Z, Zhang Z, He Z, et al. A partition-ligation-combination-subdivision EM algorithm for haplotype inference with multiallelic markers: update of the SHEsis (http://analysis.bio-x.cn) [J]. Cell research, 2009(19): 519-523.
[14]Shi YY, He L. SHEsis, a powerful software platform for analyses of linkage disequilibrium, haplotype construction, and genetic association at polymorphism loci [J]. Cell Res, 2005(15): 97-98.
[15]Nagaraju GP, Rajitha B, Aliya S, et al. The role of adiponectin in obesity-associated female-specific carcinogenesis [J]. Cytokine Growth Factor Rev, 2016.
[16]Sakellariou S, Fragkou P, Levidou G, et al. Clinical significance of AGE-RAGE axis in colorectal cancer: associations with glyoxalase-I, adiponectin receptor expression and prognosis [J]. BMC Cancer, 2016(16): 174.
[17]Wang Y, Lam KS, Xu JY, et al. Adiponectin inhibits cell proliferation by interacting with several growth factors in an oligomerization-dependent manner [J]. J Biol Chem, 2005(280): 18341-18347.
[18]Shimano M, Ouchi N, Shibata R, et al. Adiponectin deficiency exacerbates cardiac dysfunction following pressure overload through disruption of an AMPK-dependent angiogenic response [J]. J Mol Cell Cardiol, 2010(49): 210-220.
[19]Motoshima H, Wu X, Mahadev K, et al. Adiponectin suppresses proliferation and superoxide generation and enhances eNOS activity in endothelial cells treated with oxidized LDL [J]. Biochem Biophys Res Commun, 2004(315): 264-271.
[20]Ong KL, Li M, Tso AW, et al. Association of genetic variants in the adiponectin gene with adiponectin level and hypertension in Hong Kong Chinese [J]. Eur J Endocrinoc, 2010(163): 251-257.
(2016-03-15收稿,2016-05-26修回)
中文编辑: 吴昌学; 英文编辑: 刘华
*基金项目]国家自然基金项目(31270030; 81573206); 协和青年基金(3332015149); 云南省科技厅-昆明医科大学应用基础研究联合专项(2013FB169); 云南省妇科肿瘤内设研究机构中心(2014NS032); 中国医学科学院病原生物学研究所基本科研业务费项目(2012IPB107)
[中图分类号]R737.33
[文献标识码]A
[文章编号]1000-2707(2016)07-0770-05
DOI:10.19367/j.cnki.1000-2707.2016.07.006
Study of Correlation Between SNPs in Adiponectin Gene Promoter Region and Occurrence and Development of Cervical Cancer in Yunnan Han Population
ZHANG Yu1,2, YAN Zhiling3, SHI Li1,2, YANG Hongying3, YANG Jiafang1,2, YU Jiankun1,2,ZHANG Xinwen1,2, LIU Shuyuan1,2, LI Chuanyin1,2, YAO Yufeng1,2
(1.InstituteofMedicalBiology,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Kunming650118,Yunnan,China; 2.YunnanKeyLaboratoryofVaccineResearch&DevelopmentonSevereInfectiousDisease,Kunming650118,Yunnan,China; 3.TheThirdAffiliatedHospitalofKunmingMedicalUniversity,Kunming650106,Yunnan,China)
[Abstract]Objective: To evaluate the association of single nucleotide polymorphisms (SNPs) in the adiponectin gene promoter region with the occurrence and development of cervical cancer in Yunnan Han population. Methods: 395 patients with cervical cancer were enrolled as cancer group, 131 patients of precancerous lesion as CIN III group and 685 healthy individuals as control group. Three SNPs in the promoter region of adiponectin gene including rs266730(G>A), rs266729(C>G) and rs16861194(A>G) were genotyped by TaqMan method. The haplotypes were constructed and the association of these three SNPs and haplotypes with the occurrence and development of cervical cancer was analyzed. Results: In terms of both the allelic and genotypic frequency, these three SNPs (rs266730, rs16861194 and rsr266729) showed no statistically significant difference between cancer group, CIN III group and control group(P>0.05). The frequencies of haplotypes constructed by rs266730(G>A), rs266729(C>G) and rs16861194(A>G) also showed no statistically significant difference between cancer group, CIN III group and control group(P>0.05). Conclusion: These three SNPs in the adiponectin gene promoter region are not associated with the occurrence and development of cervical cancer in the Han population in Yunnan province.
[Key words]cervical cancer; precancerous condition; polymorphisms,single nucleotide; genotype; adiponectin
**通信作者 E-mail:leoyyf@gmail.com
网络出版时间:2016-07-17网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160717.1318.008.html



