向洁, 曾晓晓, 曹坤, 董阳婷, 徐毅, 冉龙艳, 邓婕, 官志忠,**
(1.贵州医科大学附院 病理科, 贵州 贵阳 550004; 2.贵州医科大学 地方病与少数民族疾病教育部重点实验室, 贵州 贵阳 550004; 3.贵州医科大学 贵州省医学分子生物学重点实验室, 贵州 贵阳 550004)
阿尔兹海默病(alzheimer’s disease,AD),又称老年性痴呆,在全球的发病率日益增加,但由于AD复杂的发病因素与分子机制,到目前为止,所有治疗AD的药物仅能在一定程度上改善患者症状,但不能改变患者的发病进程[1-2]。AD的主要神经病理学特征为β淀粉样蛋白(β-amyloid protein,Aβ)形成的老年斑及tau蛋白磷酸化导致的神经元纤维缠结[3-4],Aβ来源于β-淀粉样前体蛋白(β-amyloid precursor protein,APP),由β及γ分泌酶进行分解而来[5]。当Aβ的产生和降解处于失衡状态时,过量的Aβ在人脑中堆积[6],而Aβ的异常沉积对神经元的毒性作用在AD发病中具有重要影响[7-8]。锂被发现用于临床研究及治疗已超过60年,特别是在治疗躁狂发作、双相障碍等精神疾病中被广泛应用、且效果良好[9-10]。近年来,针对锂治疗作用的研究越来越多,特别在神经疾病方向研究中也有了新的突破。现在已经肯定锂作为糖原合成激酶-3β(glycogen synthetic kinase-3β,GSK3β)的经典抑制剂,对GSK3β活性的调节具有重要作用[11],对蛋白磷酸化导致的神经纤维缠结有显着的减轻作用[12-13]。尽管锂在AD等神经退行性疾病防治中的潜在用途被众人关注,但其对神经系统的保护作用机制研究报道较少。本研究以APP/突变型人早老素1(PS1)双转基因小鼠作为类AD动物模型,以野生型小鼠作为对照,采用氯化锂(lithium chloride,LiCl)灌胃小鼠2个月,观察LiCl是否能降低小鼠脑组织中的Aβ含量,观察小鼠脑组织中老年斑含量,分析LiCl是否能减少Aβ对神经系统的毒性作用,发挥神经保护作用,报告如下。
1 材料与方法
1.1 实验动物及试剂
实验动物为上海南方模式生物科技发展有限公司提供的20只,C57BL/6J雌性野生型小鼠5只,B6.Cg-Tg(APPswe, PSEN1dE9)85Dbo/Mmjax种鼠,体质量均为20~30 g,生产许可证编号为SCXK(沪)2014-0002。主要试剂:LiCl(美国 Sigma公司),小鼠Aβ42ELISA 试剂盒(美国 Invitrogen公司),ABC免疫组织化学试剂盒、DAB显色试剂盒、SG显色试剂盒、中性树胶封片剂(美国 Vectorlabs公司),2×PCRTagMix(日本 TaKaRa公司),DL2000DNA Marker(北京天根生物公司), Anti-Aβ6E10(美国 Govance公司)。
1.2 方法
1.2.1AD动物模型的制备 5只4月龄B6.Cg-Tg(APPswe,PSEN1dE9)85Dbo/Mmjax种鼠与20只雌性野生型C57BL/6J小鼠(20~30 g)在SPF级的动物房中以30%~50%湿度、22~25 ℃温度条件下适应喂养1周,以1∶4的比例将种鼠与雌鼠合笼交配,仔鼠出生第10天时进行鉴定,分选出野生型及APP/PS1双转基因小鼠;喂养至1月龄时,进行雌雄分笼,饲养于光照与黑暗各12 h的恒温独立通风笼内,每笼5只,自由摄食及饮水。将小鼠分为4组(每组6只),分别为野生型 (wild type,WT组) 组、WT+Li组、APP/PS1组及APP/PS1+Li组,各组小鼠均自由摄食及饮水,WT组及APP/PS1组小鼠在4月或8月龄时,对其进行生理盐水灌胃处理,1次/d,为期2个月;WT+LiCl组及APP/PS1+LiCl组小鼠在4月或8月龄时,用LiCl(100 mg/kg)灌胃处理,1次/d,为期2个月[14]。
1.2.2小鼠DNA提取 剪取1周龄以上小鼠0.2~0.4 cm尾端,将鼠尾放入已编号的1.5 mLEppendorf(Epp)管中;每管加入裂解液0.5 mL及蛋白酶K贮存液0.05 mL,混匀后放入56 ℃水浴箱中过夜;以12 000 r/min离心10 min,取上清入新的1.5 mL Epp管中,加入无水乙醇1 mL,12 000 r/min离心10 min,弃上清,加70%乙醇1 mL,12 000 r/min离心10 min,弃上清,倒扣风干15 min,加ddH2O 200 μL轻轻吹打使之完全溶解;在室温中放置到DNA完全溶解后定量,直接进行PCR处理。
1.2.3APP及PS1基因检测 采用PCR法,按照表1所示APP及PS1基因的引物序列合成相应引物;取出已制备好的小鼠模板DNA,按照ddH2O 8.5 μL、2×PremixTag 12.5 μL、APP上游0.5 μL、APP下游0.5 μL、PS1上游0.5 μL PS1下游0.5 μL、GenomicDNA 2 μL配制总反应体系(共25 μL),进行PCR扩增,扩增条件:94 ℃预变性3 min,94 ℃变性30 s、60 ℃退火30 s、72 ℃延伸1 min,30个循坏,72 ℃最后延伸5 min。同时制备1.5%琼脂糖凝胶,待PCR产物扩增完成后,进行凝胶电泳,于凝胶成像分析系统Gene Sys进行曝光分析。

表1 APP及PS1引物序列Tab.1 Primer sequences used for genotyping mouse APP and PS1 genes
1.2.4小鼠脑组织中老年斑含量 采用免疫组织化学法检测,取小鼠右侧大脑半球正矢状面脑组织,4%多聚甲醛固定24 h,常规脱水、石蜡包埋、切片(4 μm)。老年斑检测:常规脱蜡(二甲苯10 min×3次)、酒精水化(100%、95%、75%、50%、双蒸水,各10 min),柠檬酸盐修复(pH 6.0,高压锅修复2.5 min),3%双氧水去除内源性过氧化物酶(10 min),1×PBST洗涤切片(5 min×3次),10%马血清封闭1 h,一抗孵育4 ℃过夜(Anti-Aβ6E10 1∶50),l×PBST洗涤(5 min×3次),按照ABC免疫组化试剂盒说明书进行二抗孵育(1∶50),l×PBST洗涤(5 min×3次),显微镜下DAB显色(阳性为棕色),蒸馏水终止显色,酒精上行脱水(75%、95%、100%,各10 min)、二甲苯透明,中性树胶封片,镜检。
1.2.5小鼠脑组织中不可溶性Aβ含量测定 按照小鼠Aβ42ELISA 试剂盒说明书配置所需试剂。取0.1 g脑组织,用配置好的裂解液进行组织匀浆,制备样品。确定8连管数量,向空白孔中加入标准品稀释液100 μL,作为空白对照;向孔中加入标准品、样品或对照样品100 μL,混合均匀,室温孵2 h,吸出液体,清洗液洗4次;每孔加入Aβ42检测抗体100 μL,除空白对照孔外,液体为蓝色,轻轻敲打板侧面进行混合;室温孵育1 h,吸出液体,清洗液洗4次;加入抗兔IgG-HRP工作液(二抗)100 μL,空白对照孔不加;室温孵育30 min,吸出液体,清洗液洗4次;每孔加入稳定着色剂100 μL,液体开始变蓝,每孔中加入StopSolution液100 μL,轻轻敲打板侧面,24 h内读板;绘制标准曲线,从标准曲线中读取未知样品和对照Aβ42浓度。
1.3 统计学处理

2 结果
2.1 APP/PS1双转基因小鼠基因鉴定
如图1所示,以新生小鼠DNA为模板扩增,可见在 9只小鼠中有 3 只小鼠(1、4、7)基因组 DNA 扩增出400 bp及600 bp大小的目的片段,与所设计的APP及PS1基因扩增片段大小一致。证实该小鼠为APP/PS1双转基因小鼠。
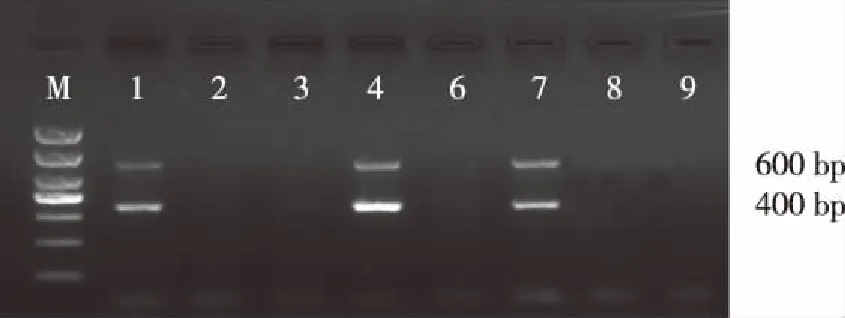
注:M 为DL2000DNAMarker,1、4、7号是APP/PS1双转基因阳性小鼠,其余为野生型小鼠图1 APP/PS1双转基因小鼠基因鉴定Fig.1 The genotype pattern of the APP gene and PS1 gene in APP/PS1 double transgenic mice
2.2 小鼠脑组织老年斑数量
如图2所示,与WT组小鼠相比, APP/PS1组小鼠脑组织有不同程度的老年斑生成,两组数量比较,差异有统计学意义(P<0.05),10月龄小鼠更明显;而对APP/PS1双转基因小鼠给予LiCl灌胃处理后,其脑组织内老年斑数量较未经LiCl处理的同龄APP/PS1小鼠显着减少,差异具有统计学意义(P<0.05);WT+Li组小鼠与WT组小鼠比较,差异无统计学意义(P>0.05)。

(1)与WT组比较,P<0.05;(2)与APP/PS1组比较,P<0.05图2 6月龄和10月龄小鼠脑组织中老年斑数量(DAB染色)Fig.2 Senile plaques in the brains of Wt mice and APP/PS1 mice at 6 and 10 months old
2.3 小鼠脑组织内不可溶性 Aβ含量
由图3所示,与WT组小鼠比较, APP/PS1组小鼠脑组织内不可溶性Aβ含量显着增加(P<0.05),10月龄小鼠更明显;而对APP/PS1双转基因小鼠给予LiCl灌胃处理后,其脑组织内不可溶性Aβ含量较未经LiCl处理的同龄APP/PS1小鼠显着减少(P<0.05);WT+Li组小鼠与WT组小鼠比较,差异无统计学意义(P>0.05)。

(1)与WT组比较,P<0.05;(2)与APP/PS1组比较,P<0.05图3 6月龄及10月龄小鼠脑组织内不可溶性Aβ含量(ELISA)Fig.3 The content of Aβ42 of 6 and 10 months-old mouse brains
3 讨论
到目前为止,有关AD发病机制方面报道得最多是淀粉样肽瀑布假说,该学说主要指出了脑内Aβ产生和清除的不平衡导致了Aβ增多,结果引起脑组织神经元退行性变而发生AD[15-16]。Aβ可通过干扰钙稳态使线粒体功能障碍,诱导皮质和海马神经元变性,并可直接损伤突触可塑性及记忆功能[17],在 AD 发病机制中起着核心作用[18]。APP/PS1双转基因小鼠表达嵌合小鼠/人淀粉样前体蛋白(Mo/HuAPP695swe)和PS1,中枢神经系统神经元内这2种突变都与早发性AD有关。研究发现,5月龄的APP/PS1双转基因小鼠脑组织内即可出现明显的淀粉样斑块,且年龄越大的双转基因小鼠其脑中β淀粉样蛋白含量及老年斑沉积越多[19]。本实验选用4月龄小鼠开始灌胃处理,探究LiCl是否能够预防双转基因小鼠脑组织中β淀粉样蛋白的过多生成。另外,对8月龄双转基因小鼠灌胃处理2个月,研究LiCl在β淀粉样蛋白产生过多、老年斑生成后,能否减少其含量,逆转痴呆模型鼠的病理学改变。
锂作为一种情绪稳定剂,自被发现以来一直被用于治疗精神疾病,对其改善神经系统功能,对AD的潜在治疗作用等方面已经进行了研究[20]。有报道指出,锂作为GSK-3β有效抑制剂,通过调控GSK-3β下游多条信号通路,发挥其抗氧化、抗炎和维持蛋白质稳态的特性[21]。同时LiCl对突触萎缩可以有良好的治疗作用,能逆转冈田酸造成的突触损害[22]。Cisternas等[23]指出,锂通过调节Wnt/β-catenin信号通路改善AD患者糖代谢紊乱,从而发挥改善学习记忆功能的有益作用。锂作为一种多方向治疗药物,在对抗复杂的痴呆分子病理学方面具有优势。在本研究结果显示,与WT型小鼠相比,6月龄及10月龄APP/PS1双转基因小鼠脑组织中有较多数量的老年斑,不可溶性Aβ含量显着增加。与此同时,本研究还分别对4月及8月龄的APP/PS1双转基因小鼠给予LiCl灌胃处理2个月,结果发现这些APP/PS1双转基因小鼠脑组织中老年斑数量及不可溶性Aβ含量与未经LiCl处理的同龄APP/PS1小鼠比较显着降低,差异有统计学意义,提示LiCl能预防及逆转APP/PS1双转基因小鼠脑组织中Aβ含量的增多及老年斑的生成,可能降低Aβ在AD发病过程中的毒性作用。Pan等[24]最新研究也发现LiCl处理使APP/PS1双转基因小鼠脑微血管LRP1蛋白表达增加及并促进脑脊液循环整体流通,从而能促进脑组织中可溶性Aβ的清除。
综上所述,LiCl处理可减少APP/PS1双转基因小鼠脑组织Aβ含量,可能是通过预防其产生或者加速其清除完成的,对AD的药物治疗有一定的参考意义。



