张鹏, 舒莉萍, 周艳华**, 范安然**
(1.贵州医科大学 细胞工程生物医药技术国家地方联合工程实验室, 组织工程与干细胞实验中心, 贵州省再生医学重点实验室, 贵州 贵阳 550004; 2.中国医学科学院 成体干细胞转化研究重点实验室, 贵州 贵阳 550004)
Tau蛋白是一种微管相关蛋白,在微管聚集和稳定方面发挥重要的作用。正常状态下,Tau蛋白自身几乎不表现出聚集的倾向,但是Tau蛋白聚集形成的双螺旋纤维以及神经纤维结节是一系列神经退行性疾病的主要特征,这些神经退行性疾病被称为Tau蛋白病,其中包括阿尔茨海默综合征(alzheimer disease,AD)和亨廷顿病额颞叶痴呆等[1]。虽然Tau蛋白的聚集是导致这些神经退行性疾病的原因,但是Tau蛋白在神经退行性疾病形成聚集物的机制以及Tau蛋白的病理学传播机制仍然存在争议[2-3]。外泌体是后期胞内体向内出芽形成多泡体、是一类纳米级别的生物膜封闭囊泡,随后在多泡体与细胞膜融合后被释放到胞外环境,这种起源过程赋予了外泌体具有与起源细胞类似的膜结构,它们富含胆固醇脂阀、鞘磷脂和神经酰胺[4-5]。研究认为外泌体不仅仅是一种消除了多余蛋白或分子的垃圾处理囊泡,还可能是促进胞间交流的重要信使,不仅在正常的生理学过程中发挥作用,它们还与许多疾病的病理学相关[6-8],在中枢神经系统细胞之间的信息传递中也发挥重要作用[9]。最近一项研究发现,外泌体可能是Tau蛋白在细胞之间传递的方式[10];研究发现在AD病人中,其外泌体的Tau蛋白水平显着升高[11]。因此本研究通过经典的超速离心结合超滤法分离获得HEK293-Tau细胞的外泌体,采用Western blot鉴定外泌体特异性标记物(HSP70、CD63及CD9)及外泌体和细胞培养液中Tau蛋白表达,报告如下。
1 材料与方法
1.1 主要材料
DMEM-F12基础培养基、细胞培养用血清(FBS)、磷酸盐缓冲液(PBS)、0.25%胰消化酶、100×非必需氨基酸(NEAA)、L-谷氨酰胺、β-巯基乙醇和100 000 U/L青链霉素均购自Gibco公司,外泌体鉴定抗体和无外泌体血清购自ABI公司,蛋白预染marker 购自Biorad公司,羊抗鼠IgG购自北京索莱宝科技有限公司,24孔板、T25培养瓶和25 cm培养板购自Corning公司产品,超速离心用离心管和100 KD超滤管购自Millipore 公司。
1.2 方法
1.2.1细胞培养 HEK293-Tau细胞培养于T75的细胞培养瓶,并使用DME-F12完全培养基进行培养。完全培养基组成包括10%胎牛血清、1%非必需氨基酸、10 mmol/L β-巯基乙醇、1%谷氨酰胺及1%青链霉素。每天观察细胞生长状态,3 d换液1次,细胞生长融合度为90%时进行传代培养。
1.2.2外泌体分离 HEK293细胞培养在25 cm的细胞培养皿中,每皿加完全培养基液20 mL,收集前48 h换成无外泌体血清配制的培养基。48 h后收集细胞上清液200 mL(10块细胞培养皿),3 462 r/min离心10 min收集上清液,将上清液6 924 r/min继续离心20 min去除细胞;再取上清液15 482 r/min 离心60 min去除细胞碎片。取上清液用Millipore 100 KD的超滤管浓缩至10 mL,浓缩后48 958 r/min离心90 min,取沉淀用PBS重悬,48 958 r/min离心90 min,PBS重悬沉淀,0.22 μm针头式过滤器过滤,-80 ℃保存。
1.2.3外泌体标志物鉴定及Tau蛋白检测 采用Western blot方法,配制10%的分离胶10 mL,分离胶凝好后配制4 mL浓缩胶。细胞裂解液以及上清的上样体积为20 μL,将其分别于2×上样缓冲液混匀后,置于100 ℃水浴煮10 min即可上样;指示带泳至胶底部时停止电泳,4 ℃转膜过夜;转膜完成后,取出PVDF膜,用5%的脱脂牛奶室温封闭1 h,加入相应一抗4 ℃过夜;次日取出PVDF膜用双蒸水漂洗3次,10 min/次。然后加入二抗窒温孵育1 h,双蒸水漂洗3次,10 min/次;用ECL液室温避光孵育,暗室显影。
1.2.4外泌体测定 采用Sigma公司的BCA蛋白浓度测定试剂盒测定,按照试剂盒说明进行操作,在第1孔添加标准品20 μL,2~8孔添加1% SDS 20 μL。然后在第2孔添加蛋白标准品20 μL,混匀后转移20 μL到第3孔进行倍比稀释,通过这种倍比稀释的方法将样品进行稀释逐孔、共7孔,第7孔混匀后取20 μL丢弃。每孔加入BCA工作液200 μL,37 ℃孵育30 min。根据吸光度值绘制标准曲线,再根据各个样本孔的吸光度值求得其实际浓度。
2 结果
2.1 外泌体形态
收集HEK293-Tau细胞培养液,超速离心结合超滤离心法,分离外泌体,分离的外泌体稀释后在透射电镜下进行形态观察;外泌体生理状态下是球状结构,但是由于脱水的原因会造成中间内陷,使内部折射变弱,电镜下外泌体会呈现杯状结构。所以本研究所分离获得的外泌体在电镜下呈典型的杯状结构(图1箭头所示)。
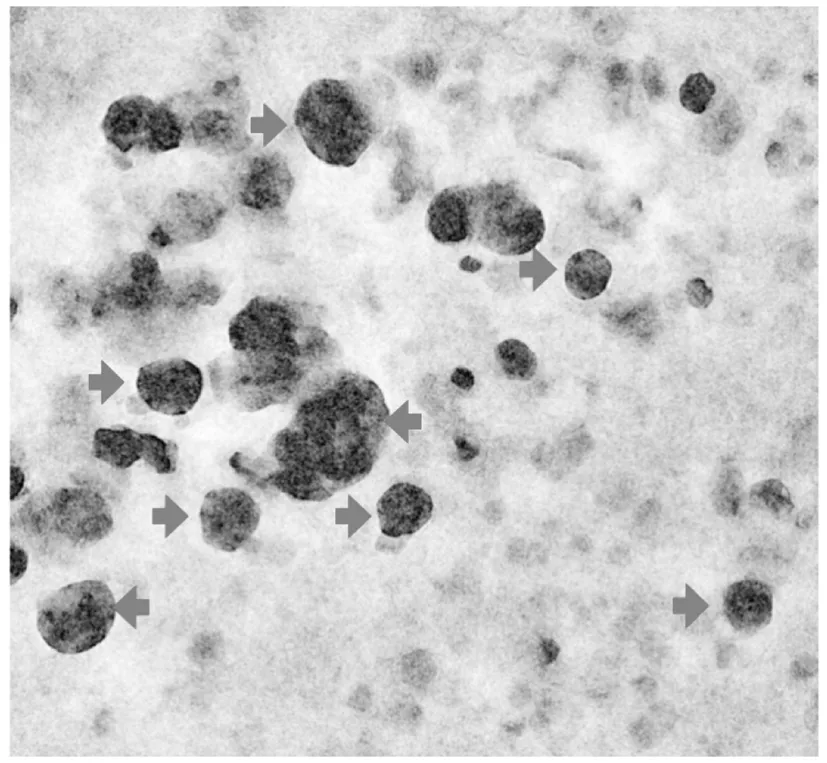
图1 透射电镜下外泌体形态Fig.1 The morphology of isolated exosomes under transmission electron microscopy
2.2 外泌体表达特异性标记物
通过细胞裂解液获取外泌体总蛋白,然后使用Western blot方法,用外泌体中特异性高表达的蛋白标记物进行鉴定。结果显示,外泌体的特异性标记物HSP70(图2A)、CD63(图2B)和CD9(图2C)都呈现阳性,与电镜结果相结合,更进一步证明了所分离的外泌体的可靠性。
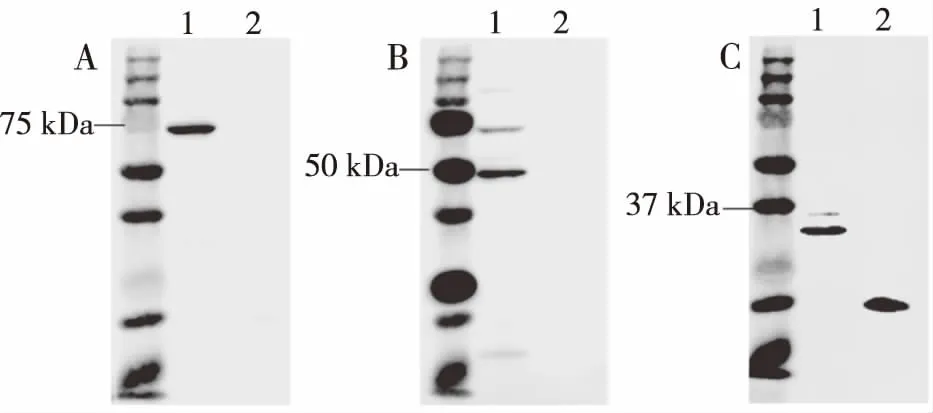
注:A为Hsp70、B为CD63、C为CD91,泳道1为外泌体蛋、2为细胞总蛋白图2 外泌体标志物鉴定(Western blot)Fig.2 The expression of exosome markers on isolated exosomes
2.3 细胞裂解液、外泌体及细胞培养上清液中Tau蛋白表达
使用Tau12抗体对细胞培养上清液、细胞裂解液及外泌体进行Western blot分析,结果显示,在细胞培养上清液、细胞裂解液及外泌体中都可以检测到Tau蛋白表达(图3)。
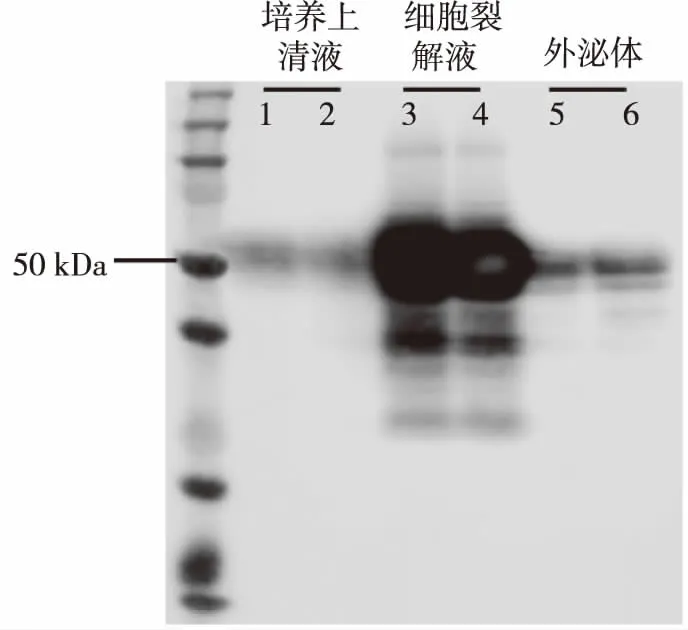
图3 细胞、外泌体及细胞培养液中Tau蛋白表达(Western blot)Fig.3 Tau protein in isolated exosomes and supernatants derived culture media with HEK293-Tau cells
3 讨论
Tau蛋白是一种微管相关蛋白,在微管聚集和稳定方面发挥重要的作用。正常状态下,Tau蛋白自身几乎不展现出聚集的倾向。但是在AD中,Tau蛋白会超磷酸化,导致其错误折叠以及聚集形成神经纤维结节(neurofibromatosis,NFT)[12]。NFT沉积的出现是以一种独特的可预测的时空特异性方式发生。Braak等[13]将Tau的传播分为6阶段,前两个阶段的主要特点是Tau先在旁嗅皮层然后在嗅皮层沉积,所以该阶段也别称为旁嗅皮层阶段。这一阶段,病人的绝大多数认知是正常的;在III、IV阶段,NFT密集的出现在嗅皮层的前alpha区以及CA1区,海马下托区也开始出现NFT;在IV阶段CA4区、杏仁区、屏状体、扣带、丘脑核都受到影响。由于IV阶段主要影响大脑的边缘系统,所以该阶段也叫边缘期;这一阶段病人开始表现出轻度认知障碍,但是仍可以进行日常工作;在第V、VI阶段,病原性的Tau几乎在海马区的所有区域出现,病人表现出大规模的神经元损失,也被称为岛旁区阶段[13]。在AD进程中,Tau在大脑中的传播多数情况下可以用突触间传播解释,但是其侧向传播以及长距离传播仍不能解释,但Tau的这种传播方式如果是通过大脑的外泌体传播方式就可以解释。最近已经有研究开始探索AD中外泌体作用于错误折叠的Tau传播的可能性[3]。
外泌体是一类纳米级别的生物膜封闭囊泡,其存在于生物体液中,直径在50~150 nm之间[14]。本研究获得的外泌体在电镜下直径绝大多数位于这个范围。外泌体通常可通过差速离心方法获得,但是各个实验室的获得方法又有所不同。本研究采用超速离心结合超滤的方法非常有效的分离获得了外泌体。外泌体生理状态下是球状结构,但是由于脱水的原因会造成中间内陷,使内部折射变弱,电镜呈现杯状结构[15]。本研究获得的外泌体具有典型的杯状结构。并且外泌体由于其起源于多泡体,所以腔内体的蛋白标记物被用来作为外泌体鉴定的标记,比如CD81、CD9、CD63和TSG102等[16]。本研究分离的外泌体经鉴定HSP70、CD63和CD9均呈现阳,进一步证明本研究获得的外泌体的可信度。
最近,有研究发现外泌体参与了Tau的病理学过程[17],来源于小胶质细胞的外泌体中的Tau参与大脑中Tau的病理学传播,使用GW4869清除小胶质细胞和抑制外泌体的合成能够限制Tau在病人大脑中的传播[18]。该研究认为小胶质细胞能够吞噬含有Tau蛋白病变的神经元,随后将Tau释放到外泌体中来传递病变神经元,小胶质细胞来源的外泌体可以将Tau从嗅皮层(Tau病理学的最早位点之一)传播到齿状回区域(Tau晚期影响的区域,但是也在早期受到影响),封闭nSMase2 抑制外泌体生物合成后可显着减少Tau的传播[18]。研究还发现外泌体中含有AD的典型生物标记Tau和Aβ[19]。本研究也发现外泌体中确实存在Tau蛋白,说明了外泌体在Tau蛋白的传播中可能发挥作用,在后期胞内体内陷形成多泡体的时候,在细胞中表达的Tau蛋白会随之被分选到多泡体的腔内体中,当多泡体与细胞膜融合后释放外泌体,此时tau蛋白会随之被释放到胞外空间。释放的外泌体可以与相邻以及不相邻的细胞膜融合,并将其包含的外泌体再释放到受体细胞中,从而造成Tau蛋白在不同细胞之间的传播。
此外,外泌体中的蛋白质的分选机制仍不清楚,但是似乎是被特异性分选的,因为它们与其亲本细胞的组成不同[20],并且外泌体中装载的分子还会根据亲本细胞的状态而改变[21]。关于外泌体中的蛋白分子分选机制有3种途径被提出。第1种是利用胞浆体系,比如ALIX和ESCRT蛋白以及LBPA[22-23],ESCRT途径可以募集ILV中单泛素化的蛋白进行胞内溶酶体降解;第2种途径是以富含鞘磷脂的细胞膜结构为基础,将细胞膜镶嵌蛋白进行分离以及将脂阀上的flotilins和Tetraspanins蛋白及其结合蛋白共同分离到ILV中[24-25];第3种途径是由凝集素等因子在胞内体腔内发起的装载,这一途径主要是招募糖基化蛋白到外泌体中。但是Tau蛋白具体是通过什么方式被分选到外泌体中去的,其机制仍然不清楚,这也是下一步外泌体在Tau蛋白传播中需要进一步研究的内容。
综上,神经元可能在外泌体中分泌Tau的病原性形式,这种装载有病原性蛋白的外泌体可以被神经元摄取。这些证据表明包含Tau的外泌体在神经元之间相互传递Tau,可能是大脑中Tau传播的一个重要组成途径。本研究通过经典的超速离心结合超滤法成功分离获得外泌体,并验证了HEK293-Tau细胞的外泌体中存在Tau蛋白,但Tau蛋白是否能够在细胞间通过外泌体传播,有待进一步研究。



