刘芳, 王彩霞, 綦廷娜, 吴芳草, 文学琴, 陈峥宏*, 崔古贞*
(1.贵州医科大学 基础医学院 微生物学教研室, 贵州 贵阳 550025; 2.贵州省普通高等学校病原生物学特色重点实验室, 贵州 贵阳 550025; 3.贵州医科大学 医学检验学院, 贵州 贵阳 550004)
幽门螺杆菌(Helicobacterpylori,H.pylori)是由澳洲医师Warren和Marshall从胃黏膜组织样本中培养并分离获得的一种定植于胃黏膜上皮细胞表面的微需氧、革兰阴性螺旋杆菌[1]。已有研究表明,慢性活动性胃炎、消化性溃疡、胃黏膜相关淋巴组织淋巴瘤(MALT)的主要病因与H.pylori感染相关,胃癌的发生亦与其有密切联系[2-3]。有研究表明,H.pylori的致病作用及所致疾病和进展与多种因素有关,包括细菌的毒力因子、细菌黏附与定植、宿主炎症与免疫反应、氧化应激、细胞增殖与凋亡及细菌自身的基因多态性等[4-5]。目前诊疗指南均推荐确诊为H.pylori感染者采用质子泵抑制剂(proton pump inhibitor,PPI)或(和)铋剂联合两种抗生素的三联或(和)四联疗法进行根除治疗,常用抗生素有克拉霉素、阿莫西林、甲硝唑等。随着抗生素的广泛应用,H.pylori对常用抗生素的耐药性日趋严重,导致H.pylori的根除效果不佳[6],如果能明确H.pylori致病及耐药的分子机制,则有望实现精准治疗。开发快速简便的分子生物学检测方法是研究H.pylori感染机制的先决条件,菌落PCR检测是一种从大量样品中快速鉴定和分析目标基因型的实用方法,已应用于分子生物学的许多领域[7-8],如基因扩增[9]、质粒构建、菌株鉴定[10-11]、分子诊断[12-13]等。菌落PCR方法只需要少量的菌细胞,不需要使用试剂盒提取基因组DNA作为PCR反应模板,既方便又经济,已经被广泛用于细菌[14-15]、真菌[16-17]和微藻[7]的鉴定。H.pylori生长缓慢,通常需要3~5 d才能形成典型的针尖状菌落,使用常规菌落PCR方法扩增H.pylori基因,其效率低、不稳定、重复性差。因此,为了提高H.pylori菌落PCR的扩增效率,本研究选择H.pylori大小不同的8种基因进行菌落PCR优化,拟在常规菌落PCR的基础上开发一种快速、高通量、经济且具有良好重复性的分子诊断方法。
1 材料与方法
1.1 材料
1.1.1菌株、试剂及引物H.pyloriATCC 26695由山东大学病原生物学研究所馈赠,贵州医科大学微生物学教研室传代保存。无菌新鲜脱纤维绵羊血由鼎国生物技术有限公司代购,脑心浸液琼脂(brain heart infusion agar,BHI)、H.pylori选择性添加剂购自英国OXOID公司,细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司,2×Taq PCR Master MIX购自北京天根生化科技有限公司,琼脂糖购自生工生物(上海)有限公司],8对引物[16SrDNA[18]、cagA-U(细胞毒素蛋白基因A[19]的上游片段)、cagA-D(细胞毒素蛋白基因A的下游片段)、iceA[20- 21](表皮细胞接触诱导基因A)、ureA[22-23](编码尿素酶亚基基因A)、hetA(鞭毛合成相关基因)、ropN[24](σ54转录调控因子)和Hp0792(Fis家族转录调节因子)]由生工生物(上海)有限公司合成,见表1。

表1 8种基因引物序列Tab.1 Primer sequences
1.1.2主要仪器 PCR扩增仪(日本,BIO-Rad 10213型),琼脂糖凝胶电泳仪(北京市六一仪器制造厂, DYY-8C型),凝胶成像分析仪(北京市六一仪器制造厂,WD-9413B型),台式高速离心机(上海安亭,TGL-16B),超纯水机(成都艾柯,DZG-303A)。
1.2 方法
1.2.1H.pylori26695的培养 接种H.pylori26695于BHI血琼脂平板(含10%无菌脱纤维绵羊血),37 ℃微需氧条件(10% CO2、5% O2、85% N2)培养2~3 d。
1.2.2细菌基因组DNA的提取及PCR扩增 用接种环刮取培养2~3 d的H.pylori的菌落于去离子水100 μL中,参照细菌基因组DNA提取试剂盒步骤制备基因组DNA。PCR反应体系为模板DNA 0.5 μL,2×Taq PCR Master MIX(12.5 μL),正向和反向引物(各1.25 μL),去离子水9.5 μL。PCR反应条件:94 ℃预变性3 min,94 ℃变性30 s、55 ℃退失30 s、72 ℃延伸1 min 30个循环;最后72 °C终延伸5 min。
1.2.3菌落PCR反应的优化 (1)将去离子水(10 μL)加入PCR管或96孔板中、使用无菌接种针或牙签从血琼脂平板上挑取培养2~3 d的单菌落、并重悬于去离子水中,(2)将PCR管或96孔板(含有10 μL幽门螺杆菌悬浮液)置于沸水中煮沸10 s,(3)将PCR管或96孔板快速转移至冰上冷冻5 min,(4)将正向和反向引物(各1.25 μL)及2×Taq PCR Master MIX(12.5 μL)加入到PCR管或96孔板中、总反应体积为25 μL,(5)混匀后按基因组DNA的PCR反应条件进行扩增,(6)1%琼脂糖凝胶电泳检测PCR产物。步骤如图1。
2 结果
如图1所示,PCR扩增幽门螺杆菌的8个基因均未显示清晰条带,阳性对照组(基因组DNA作为模板,泳道2)显示单一清晰条带,试验组(菌落经煮沸裂解速冻作为模板,泳道3~6)条带与阳性对照组一样显示单一透明条带。
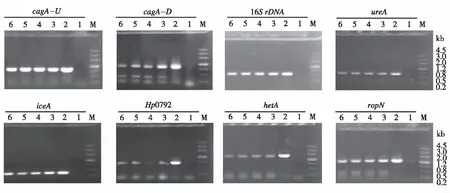
注:M为Trans2K Plus II DNA Marker,泳道1为阴性对照(菌落未经任何处理),泳道2为阳性对照 (基因组DNA作为模板),泳道3~6为试验组(菌落经煮沸冷冻作为模板)图1 菌落PCR扩增电泳图Fig.1 PCR products for colony PCR amplification
3 讨论
菌落PCR可从大量转化子或平板样本中方便、快速获得目标基因,是一种常规分子诊断技术。对于决大多数革兰氏阴性细菌(如大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌),PCR过程中的预变性步骤可以快速破坏细菌细胞壁,使细菌染色体释放到胞外,从而可用于PCR扩增的模板;对于多数革兰氏阳性细菌(如金黄色葡萄球菌、蜡样芽胞杆菌),虽然其细胞壁较厚,有多层肽聚糖组成,但PCR过程中预变性的高温条件仍然足以破坏其细胞壁,其染色体释放到胞外用于PCR扩增的模板[25]。然而,对于多数真菌(细胞壁含几丁质、壳多糖等)和放线菌,因其特殊的细胞壁结构或生长特性,利用常规菌落PCR方法进行分子鉴定仍存在一定的困难,需要对常规菌落PCR方法进行特定改造或优化[26]。
尽管H.pylori属于常规的革兰氏阴性细菌,然而,常规菌落PCR方法在H.pylori中应用时效果不明显、稳定性较差,这可能与H.pylori的特殊生长环境(强酸环境)或特殊的细胞结构有关[27-28],其具体原因尚不清楚。在本研究中,我们随机选择8个大小不同的基因,利用常规菌落PCR方法进行扩增,不能获得扩增条带,尽管在阴性对照组中可以看到一些基因(例如ropN或16SrDNA)的模糊扩增条带,但亮度较弱不能用于进一步分析。而将H.pylori菌落进行煮沸裂解速冻后作为PCR模板,均可显示出与阳性对照组相似的清晰条带,表明煮沸裂解速冻法可以应用于H.pylori的菌落PCR扩增。
综上所述,本研究优化的菌落PCR技术对于H.pylori的鉴定效果较好,有助于快速进行H.pylori的高通量分类,转化体筛选和分子诊断。



