康小红,王艺明*
(贵州医科大学附属医院 精神科,贵州 贵阳 550004)
阿尔茨海默病(Alzheimer's desease,AD)是以进行性记忆损伤和认知障碍为主要表现的中枢神经退行性疾病[1-3],在海马、前额叶皮质等处沉积于神经元细胞周围的β-淀粉样蛋白(amyloid beta,Aβ)可引起胶质细胞活化、神经炎症等,进而引起细胞内微管相关蛋白-Tau蛋白过度磷酸化,形成神经纤维缠结[4],导致神经元死亡和突触性坏死,最终引发严重的神经精神症状[5-8]。研究表明,白藜芦醇(resveratrol,Res)可激活沉默信息调节因子2相关酶I(silencing information regulator 2 related enzyme Ⅰ,SIRT1),再经维甲纬酸受体β(retinoic acid receptor beta,RARβ)间接或直接激活含有解整合素和金属蛋白酶结构域的蛋白10(a disintegrin and metalloproteinase domain-containing protein 10,ADAM10),减少Aβ的产生[9],但Res能否通过上调SIRT1/RARβ/ADAM10信号通路表达降低Tau蛋白磷酸化水平的报道尚未见到。因此,本研究拟通过SIRT1受体唯一激动剂Res干预AD模型小鼠,观察小鼠前额叶皮质SIRT1、RARβ、ADAM10蛋白表达水平及Tau蛋白丝氨酸396位点[phosphorylated Tau Ser396,p-tau(S396)]磷酸化水平,现将结果汇报如下。
1 材料与方法
1.1 实验材料
1.1.1动物来源 选取6月龄C57BL/6雄性小鼠6只,6月龄APP/PS1双转基因雄性小鼠12只,均购自南京大学-南京生物医药研究院[SCXK(苏)2018-0008]。
1.1.2主要仪器 动物通用活动箱(上海吉量),台式高速冷冻离心机(美国Beckman Coulter),超声波细胞/组织破碎仪(上海利闻),生物安全柜和分光光度计NanoPhotometer®(美国Thermo Fisher Scientific),7500聚合酶链式反应基因扩增仪和普通聚合酶链式反应(polymerase chain reaction,PCR)仪(美国ABI),多功能酶标仪和小型垂直电泳系统(美国Bio-Rad),化学发光成像仪(上海勤翔)。
1.1.3主要药物和试剂 Res粉末(西安格林),TRIZOL RNA提取液(美国赛默飞),反转录试剂盒和SYBR® Premix Ex TaqTM试剂盒(日本TAKARA),引物(上海生物),高效RIPA组织/细胞裂解液、蛋白酶抑制剂(phenylmethanesulfonyl fluoride,PMSF)、蛋白磷酸酶抑制剂混合物、彩虹marker、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白加样缓冲液(5×)及SDS-PAGE凝胶快速配置试剂盒(北京索莱宝),2,2-联喹啉-4,4-二甲酸二钠(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(上海碧云天),Tau phospho S396单克隆抗体和Tau蛋白单克隆抗体(英国Abcam),SIRT1、ADAM10/MADM、RAR β及β-actin多克隆抗体(北京博奥森)。
1.2 研究方法
1.2.1实验动物造模和分组 C57BL/6小鼠设为空白对照组(blank control,BC组),APP/PS1双转基因小鼠参考文献[10]制备的AD小鼠模型随机均分为AD组和AD+Res组;称取Res粉末32 mg,加生理盐水3.9 mL,再加二甲基亚砜0.1 mL混合均匀,现用现配,每日于同一时间对AD+Res组小鼠予800 mg/kg Res溶液灌胃3个月,其余组小鼠予相应量生理盐水灌胃3个月。
1.2.2Morris水迷宫实验(morris water maze,MWM) 取直径40 cm的圆柱体玻璃水缸,加25 ℃清洁水至25 cm,中央放置一个高于水面5 cm的平台,将各组小鼠依次放入水缸,引导小鼠找到水中平台,训练4次/d、共4 d;训练结束后将小鼠从原来进入水缸位置的对侧放入水缸,记录小鼠在非引导状态下找到水中平台的时间,以测试小鼠的学习、记忆及空间探索能力,即认知能力[11]。所有小鼠9月龄时再次测试,第2次MWM前不再进行训练。MWM期间各组小鼠饲养于温度21 ℃、湿度50%的适宜环境,自由进食,每组3只小鼠分笼饲养。
1.2.3荧光实时定量PCR(real-time fluorescent PCR,RT-qPCR)检测小鼠前额叶皮质SIRT1、ADAM10 mRNA表达水平 各组小鼠于9月龄再次完成MWM后适时麻醉处死,冰上快速取脑,分离出前额叶皮质,称取前额叶皮质5 mg,Trazol法提取总RNA,按照反转录试剂盒操作说明书合成cDNA,再按照SYBR® Premix Ex TaqTM试剂盒操作说明书进行RT-qPCR反应,引物序列见表1。

表1 RT-qPCR引物序列及目的片段大小Tab.1 RT-qPCR primer sequence and target fragment size
1.2.4免疫蛋白印迹(Western blot)检测小鼠前额叶皮质SIRT1、RARβ、ADAM10蛋白表达及Tau蛋白磷酸化水平 将高效RIPA组织/细胞裂解液、蛋白磷酸酶抑制剂混合物、蛋白酶抑制剂PMSF以100 ∶1 ∶1配置裂解液,称取各组小鼠前额叶组织10 mg,加裂解液200 μL,超声研磨均匀,冰上裂解30 min、混匀1次/5min,14 000 r/min于4 ℃离心15 min。吸取上清液后按照BCA蛋白浓度测定试剂盒操作说明书测定总蛋白浓度,剩余样品与5×SDS-PAGE蛋白加样缓冲液以4 ∶1混合均匀后100 ℃加热5 min。以每孔定量蛋白样品30 μg进行电泳,90 V恒压电泳30 min,120 V恒压电泳1.5 h,200 mA恒流转膜1.5 h,5%牛奶或BSA封闭液封闭1 h,相应一抗4 ℃孵育过夜,次日进行二抗孵育、洗膜及曝光。
1.3 统计学分析

2 结果
2.1 MWM
与同组6月龄比较,9月龄AD组和AD+Res组小鼠找到水中平台的时间均明显延长(P<0.01),BC组小鼠6月龄时与9月龄时MWM指标比较,差异无统计学意义(P>0.05);与9月龄BC组比较,AD组小鼠找到平台的时间明显延长(P<0.01),但AD+Res组小鼠与AD组组间差异则无统计学意义(P>0.05)。见表2。
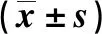
表2 各组小鼠MWM中找到水中平台的时间Tab.2 Time to find water platform in MWM of mice in each
2.2 SIRT1和ADAM10 mRNA表达
与BC组比较,AD组小鼠前额叶皮质SIRT1和ADAM10 mRNA表达均下降(P<0.01);与AD组比较,AD+Res组小鼠前额叶皮质ADAM10 mRNA表达水平升高(P<0.01),但SIRT1 mRNA表达差异无统计学意义(P>0.05)。见表3。
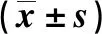
表3 各组小鼠前额叶组织SIRT1和ADAM10 mRNA的表达Tab.3 SIRT1 and ADAM10 mRNA expression
2.3 SIRT1、RARβ、ADAM10蛋白表达及p-tau(S396)水平
与BC组比较,AD组小鼠前额叶皮质SIRT1、ADAM10蛋白表达水平降低(P<0.01);与AD组比较,AD+Res组小鼠前额叶皮质SIRT1、ADAM10表达水平升高(P<0.05)。与BC组比较,AD组小鼠前额叶皮质RARβ表达水平降低(P<0.05);与AD组比较,AD+Res组小鼠前额叶皮质RARβ表达水平升高,差异无统计学意义(P>0.05)。与BC组比较,AD组小鼠前额叶皮质p-tau(S396)磷酸化水平升高(P<0.001);与AD组比较,AD+Res组小鼠前额叶皮质p-tau(S396)磷酸化水平降低(P<0.01)。见图1。
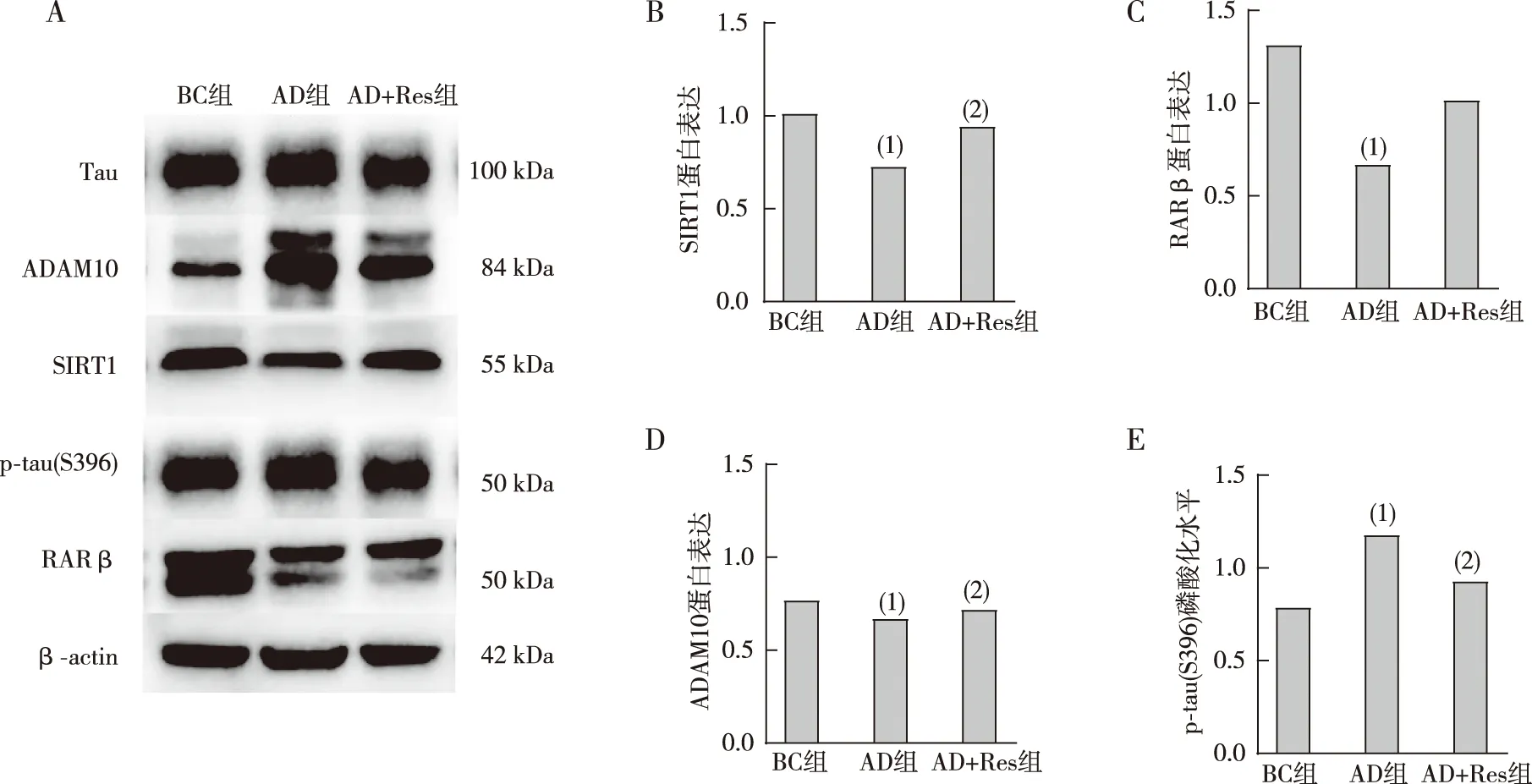
注:A为免疫印迹条带,B~E分别为SIRT1蛋白、RARβ蛋白、ADAM10蛋白及p-tau(S396)磷酸化定量结果;(1)与BC组比较,P<0.01;(2)与AD组比较,P<0.05。图1 各组小鼠前额叶皮质SIRT信号通路相关蛋白的表达和p-tau(S396)磷酸化水平Fig.1 Expression of SIRT signaling pathway related proteins and phosphorylation level of p-tau (S396) in prefrontal cortex of mice in each group
3 讨论
有研究报道,6~7月龄的APP/PS1小鼠脑内Aβ开始沉积并逐渐形成老年斑[12]。因此本研究采用6月龄小鼠作为研究对象,通过对比BC组、AD组、AD+Res组小鼠前额叶皮质处的p-tau(S396)磷酸化程度和认知水平的改变,评估AD小鼠和经Res治疗后的AD小鼠前额叶神经纤维缠结程度以及与SIRT1/RARβ/ADAM10信号通路的转导的相关性。
MWM是常见的用于评估神经、精神疾病模型动物认知功能的实验方法,通过观察小鼠训练后找到水中平台的时间评估小鼠的学习、记忆能力及空间探索能力,也可在一定程度上反映实验小鼠的行为活动能力[13]。本研究中,BC组小鼠在6月龄和9月龄时的MWM测试中,找到平台的时间无差异,而AD组小鼠与AD+Res组小鼠则在9月龄时表现出搜索潜伏期明显延长、直游及圈游次数减少,迷宫周边停留时间显着增加,表明APP/PS1双转基因处理所导致的小鼠大脑病理改变损害了小鼠的认知能力以及运动功能,同时,经Res干预的小鼠与同月龄BC组和AD组小鼠组间比较MWM测试时间均无差异,由此推测Res干预可能在一定程度上改善了APP/PS1双转基因处理所导致的认知损害,对AD的认知能力以及运动功能下降有一定治疗作用但并不能完全缓解,这与前期相关研究报道结果一致[14-15]。因此,本课题将在后续研究中扩大样本量,应用更加全面的认知能力与运动功能的测试方法,进一步深入探究Res干预APP/PS1双转基因AD模型小鼠的效果评价。
关于AD发生发展的机制虽然尚未研究清楚,但Aβ级联假说与Tau蛋白过度磷酸化假说却得到了相当一部分研究成果的支持,证明Aβ可以诱导Tau蛋白的过度磷酸化,进而引起中枢神经纤维扭曲、缠结[16-19]。Aβ代谢分为有β-分泌酶和γ-分泌酶参与的淀粉样代谢途径和有α-分泌酶参与的非淀粉样代谢途径,β淀粉样前体蛋白可被蛋白水解作用产生Aβ,起到神经毒性作用,Aβ分布于大脑多个皮质层区域,以海马、额颞叶等处尤其明显,α-分泌酶ADAM10则参与β淀粉样前体蛋白的非淀粉样代谢途径,产生可溶性片段sAPPa,竞争性降低Aβ水平,sAPPa在一定范围内的升高有利于神经保护作用[20-25]。
SIRT1可直接激活ADAM10,也可通过RARβ间接地增加ADAM10的表达,减少毒性Aβ的生成与沉积,由此推测Res激活SIRT1也可减轻小鼠前额叶皮质Tau蛋白磷酸化水平,并改善小鼠的认知功能、探索能力、活动能力及记忆力[26]。本研究中,在基因水平,SIRT1、ADAM10在AD组小鼠表达较BC组降低,SIRT1在AD+Res组与AD组无差异,AD+Res组小鼠ADAM10表达高于AD组。在蛋白水平,APP/PS1转基因使AD组小鼠SIRT1、RARβ、ADAM10水平均低于BC组,并且AD组小鼠Tau蛋白磷酸化程度明显高于BC组,Res处理则使上述信号通路上调,并且降低Tau蛋白磷酸化程度,说明AD发生发展的机制之一可能是该信号通路的下调。最终本研究证明,AD小鼠的SIRT1/RARβ/ADAM10信号通路下调,Tau蛋白磷酸化水平升高,Res则上调了上述信号通路中相关蛋白的表达水平,降低了小鼠前额叶皮质Tau蛋白的磷酸化水平,改善了实验小鼠的认知功能。
综上所述,AD 小鼠前额叶信号通路中SIRT1、RARβ及ADAM10表达降低,Tau蛋白磷酸化程度升高;Res可改善AD小鼠认知功能,与AD小鼠前额叶SIRT1、RARβ、ADAM10表达上调及Tau蛋白磷酸化程度降低有关。



