张宇菲, 罗红, 肖红, 陶玲, 沈祥春*, 常楚瑞*
(1.贵州医科大学 天然药物资源优效利用重点实验室, 贵州 贵阳 550025; 2.贵州医科大学 贵州省特色天然药物资源高效利用工程中心, 贵州 贵阳 550025)
心肌纤维化(myocardial fibrosis,MF)是糖尿病心肌病(diabetes cardiomyopathy,DCM)的一个重要特征,是糖尿病患者心脏的特异性病理性改变,导致患者心功能下降和心律失常等心血管意外事件[1]。也是指当受到病理条件的刺激时,心脏组织中的心肌成纤维细胞(cardiac fibroblasts,CFBs)异常增殖,从而促进CFBs向肌成纤维细胞转分化(fibroblast-to-myofibroblast transformation,FMT)[2]。FMT是一种细胞分化和再生的复杂病理生理学过程,具体而言,糖尿病人体内的高糖(high glucose,HG)等环境,诱导CFBs的激活和分化,主要是表达肌成纤维细胞标志物、间质细胞产物Ⅰ型与Ⅲ型胶原[3],产生过量的细胞外基质(extracellular matrix,ECM)蛋白从而获得肌成纤维细胞表型[4]。引起ECM的过度沉积、合成和代谢比例失调,胶原蛋白含量显着增加[5],从而导致糖尿病患者的心室壁发生硬化,心肌的收缩功能下降,引起心脏供血不足,导致心室的顺应性减退,严重时甚至造成心衰[6]。因此,寻找能够有效抑制CFBs增殖、迁移、胶原沉积和促纤维化细胞因子表达的新型潜在药物,对于预防MF的发生发展非常重要,对加强心血管疾病的治疗,降低心血管疾病的病死率,提高心血管疾病患者的生活质量也具有重要的意义。氧化苦参碱(oxymatrine,OMT)又名苦参素,是从豆科属植物苦参中分离出来的生物碱,具有抗肿瘤、抗炎、抗纤维化、心脏保护、改善心力衰竭的作用[7-11],此外,它还保护人体组织和器官,如肝脏、肠道及心脏等[12-13]。本课题组前期从动物、细胞、分子水平实验分别探讨了OMT的抗MF作用及相关机制,结果表明OMT可减少心肌细胞肥大和凋亡,抑制CFBs增殖与转分化,并可减少MF的发生[14-15]。基于此,本研究在CFBs增殖模型基础上,观察OMT对HG诱导CFBs转分化的影响及其是否可能通过缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)信号对HG诱导的CFBs转分化产生抑制作用。
1 材料与方法
1.1 实验材料
1.1.1动物来源 日龄1~2 d的健康Sprague-Dawley(SD)乳鼠20只,7~10 g,雌雄不限,由学校实验动物中心提供[SCXK(湘)2019-0014]。本研究已获学校动物伦理委员会批准(No.2000132),且遵守了动物伦理学的相关规定。
1.1.2主要试剂 OMT(南京泽郎医药科技有限公司,20080210),D-葡萄糖(1102A0939)、D-甘露醇(1123F038)、噻唑蓝(117X0516)、苏木素伊红(hematoxylin-eosin,HE)染色试剂盒(G1121)、天狼星红苦味酸染色试剂盒(G1472)及蛋白定量(bicinchoninic acid,BCA)试剂盒(PC0020,北京Solarbio公司),Lificiguat(YC-1;170623-47-0,美国MCE公司),细胞培养基(dulbecco's modified eagle medium,DMEM;1717154,美国Gibco公司),羟脯氨酸(hydroxyproline,Hyp)试剂盒(A0310-1-1,中国南京建成生物工程研究所),HIF-1α(20960-1-AP)、VEGFA(19003-1-AP)、Vimentin(12789-1AP)、平滑肌肌动蛋白(alpha smooth muscle Actin,α-SMA;14395-1-AP)、Ⅰ型胶原(Collagen Ⅰ,14695-1-AP)、Ⅲ型胶原(Collagen Ⅲ,22734-1-AP)及纤粘蛋白(fibronectin,FN;15613-1-AP,中国武汉三鹰生物技术有限公司),结缔组织生长因子(connective tissue growth factor,CTGF;MD5912-50,北京百奥思科生物医学技术有限公司)和磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(美国Bioworld Technology公司,AB2243)。
1.1.3主要仪器 倒置显微镜XDS-2B型(日本尼康公司);酶标仪VARIOSKANLUX型(美国Thermo Fisher Scientific 公司);5810R型冷冻离心机(德国Eppendorf公司);SW-CJ-2F型单人操作净化台(中国苏州净化设备有限公司);细胞培养箱HF240型(中国上海力申科学仪器有限公司)。
1.2 研究方法
1.2.1原代CFBs的分离与培养 取SD乳鼠20只,参考文献[16]方法取心尖部份,置于4 ℃预冷磷酸缓冲盐溶液(phosphate buffer saline,PBS)培养皿中清洗;眼科剪剪成约1 mm3组织块,PBS清洗,加胰酶于4 ℃过夜;次日弃上清液,加胰酶消化液,胶头滴管吹散组织,加含血清的培养基,1 000 r/ min离心5 min,弃上清,加含血清的细胞培养基,混匀接种于培养瓶,培养箱中贴壁60~90 min,弃培养基,加含胎牛血清的培养基于培养箱中培养待后续实验使用。
1.2.2噻唑蓝比色法[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]法检测细胞的增殖能力及OMT保护浓度的确定 取“1.2.1”项下对数生长期CFBs细胞,按50个/L密度接种培养,分为空白(Control)组、40 mmol/L甘露醇(Mannitol)组、不同浓度(30、35、40、45及50 mmol/L)HG组及不同浓度(25、50、100、200及400 mg/L)OMT组,每组6个复孔,各组按上述药物处理24 h,加5 g/L MTT,20 μL/孔,37 ℃孵育4 h,吸取上清液,加二甲基亚砜(dimethyl sulfoxide,DMSO)150 μL,酶标仪于490 nm检测吸光度;根据浓度效应的结果,选取最佳浓度HG分别作用于24和48 h,计算细胞存活率并确定后续实验OMT的保护浓度。实验均重复3次。
1.2.3细胞分组及HE染色观察细胞形态 取“1.2.1”项下对数生长期CFBs细胞接种于6孔板,待细胞密度长到80%左右,结合“1.2.2”项下OMT的保护浓度结果,分为空白(Control)组、40 mmol/L甘露醇(Mannitol)组、40 mmol/L HG(HG)组、40 mmol/L HG+50 mg/L OMT(OMT低剂量)组、40 mmol/L HG+100 mg/L OMT(OMT中剂量)组及40 mmol/LHG+200 mg/L OMT(OMT高剂量)组,各组按上述处理结束后,弃培养基,PBS洗3次;加 4%多聚甲醛1 mL固定15 min,弃固定液,PBS洗3次;0.5%TritonX×100破膜20 min,PBS洗3次;苏木素染色15 min,自来水洗掉多余染液;分化液分化5 s,自来水洗涤;返蓝液返蓝1 min,自来水洗洗涤;伊红染液染色1 min,于显微镜下观察各组细胞的形态变化。
1.2.4天狼星红染色法观察细胞的胶原纤维表达 取“1.2.3”项下苏木素染色前的各组CFBs细胞,天狼星红染液染1 h,自来水洗涤;苏木素染液染5 min,于显微镜下观察各组细胞的纤维表达情况。
1.2.5Hyp试剂盒法检测细胞中Hyp的分泌情况 取“1.2.1”项下对数生长期CFBs细胞接种于6孔板,待细胞密度长到80%左右,按“1.2.3”分组给药,24 h后吸取培养液上清500 μL,检测各组细胞中Hyp的分泌。
1.2.6免疫荧光染色法检测α-SMA的表达 取“1.2.1”项下对数生长期CFBs细胞接种于12孔板,待细胞生长到70%左右时,按照分组进行24 h的给药处理。4%多聚甲醛固定,0.5%TritionX×100固定;5%牛血清白蛋白(bovine serum albumin,BSA)封闭60 min,加一抗(α-SMA∶一抗稀释液=1∶500),4 ℃下孵育过夜;次日加荧光二抗[异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)∶5% BSA=1∶500]孵育60 min;DAPI(DAPI∶PBS=1∶1 000)染核5 min;显微镜下观察并拍照。
1.2.7流式细胞术测定CFBs的周期分布比例 取“1.2.1”项下对数生长期CFBs细胞,以1×105的密度接种培养,根据“1.2.3”项下实验分组给药,置于培养箱培养24 h后弃培养液,胰蛋白酶消化细胞,1 000 r/min离心5 min,沉淀细胞;弃上清,PBS 1 mL润洗细胞,1 000 r/min离心5 min收集;将细胞沉淀与70%乙醇混匀,4 ℃过夜;次日,取沉淀细胞1 000 r/min离心5 min,PBS重新悬浮细胞;1000 r/min离心5 min,获得细胞沉淀;每份细胞样品中加混合液[染料缓冲液0.5 mL、碘化丙啶储液10 μL及核糖核酸酶A(ribonuclease A from bovine pancreas,RNAse A)溶液10 μL混合均匀]0.5 mL,37 ℃避光孵育30 min;最后用流式细胞仪上机检测。
1.2.8Western blot检测α-SMA、CTGF、Collagen Ⅰ、Collagen Ⅲ、FN、VEGFA及HIF-1α蛋白的表达 取“1.2.1”项下对数生长期CFBs细胞,按“1.2.3”分组给药,加radio immunoprecipitation assay(RIPA)裂解液和苯甲磺酰氟(benzylsulfonyl fluoride,PMSF)按比例(RIPA∶PMSF=99∶1)裂解细胞,按说明书步骤提取蛋白,定量分装蛋白,电泳操作,湿转法转膜90 min,5%BSA封闭液封闭90 min,加一抗α-SMA(1∶400)、CTGF(1∶1 000)、Collagen Ⅰ(1∶2 000)、Collagen Ⅲ(1∶1 000)、FN(1∶1 000)、VEGFA(1∶2 000)、HIF-1α(1∶5 000)及GAPDH(1∶10 000),置摇床上30 min,4 ℃孵育过夜;次日加二抗(1∶10 000)孵育2 h;避光,采用Bio-Rad蛋白质印迹成像系统显影,采集相应的蛋白图像,ImageLab软件对蛋白条带进行分析。
1.3 统计学分析
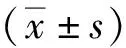
2 结果
2.1 细胞增殖活性及OMT保护浓度的确定
MTT实验结果显示(图1),不同浓度的HG作用24 h后对细胞的增殖作用较48 h明显,并呈剂量依赖性,其中40 mmol/L的HG浓度下细胞增殖率达116.20%(P<0.05);给予不同浓度OMT能够不同程度抑制HG诱导的细胞增殖,HG组CFBs存活率较Control组升高(P<0.05);与HG组相比,当OMT浓度<25 mg/L及>400 mg/L时,细胞存活率无明显影响(P>0.05);当OMT浓度分别为50 mg/L、100 mg/L及200 mg/L时,细胞存活率不同程度的下降(P<0.05);与Control组相比,Mannitol组无明显差异(P>0.05)。因此将50、100 及200 mg/L OMT分别作为OMT低、中及高剂量组作用于后续实验。
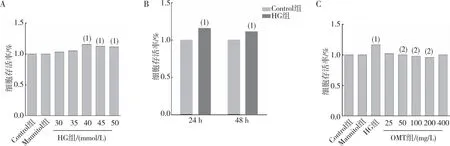
注:A、B为CFBs增殖的浓度-时间效应结果,C为OMT的保护浓度;(1)与Control组相比,P<0.05;(2)与HG组相比,P<0.05。
2.2 细胞形态学特征
与Control组比较,HG组的CFBs细胞数量增多,细胞核增大,细胞间隙变小;与HG组比较,OMT低、中及高剂量组细胞数量明显减少,细胞形态不同程度的恢复。上述结果表明OMT可以改善HG诱导的CFBs数量及形态病理的改变。见图2。
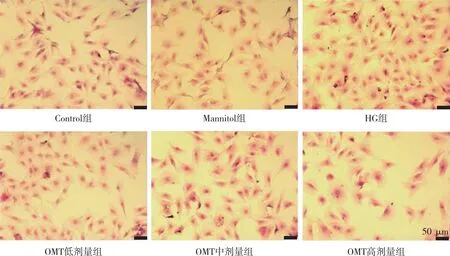
注:蓝紫色为CFBs细胞核,粉红色为CFBs细胞浆。
2.3 细胞胶原纤维的表达
天狼星红苦味酸染色结果如图3所示,与Control组比较,HG组CFBs细胞数量增多,且红色的胶原面积增加;与HG组相比,OMT低、中及高剂量组细胞数量和红色胶原面积都呈减少的趋势,提示OMT可以改善HG诱导的CFBs胶原沉积。
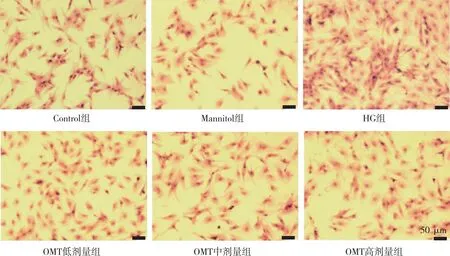
注:红色为CFBs胶原纤维,紫红色为CFBs细胞核。
2.4 Hyp含量的分泌
HG作用24 h后,Hyp检测结果显示(图4),与Control组比较,HG组培养基上清中的Hyp含量升高(P<0.05);与HG组比较,OMT低、中及高剂量组培养基上清中的Hyp含量不同程度的降低(P<0.05);与Control组相比,Mannitol组无明显差异(P>0.05)。
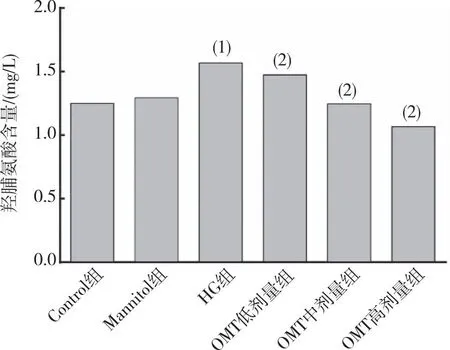
注:(1)与Control组相比,P<0.05;(2)与HG组相比,P<0.05。
2.5 细胞α-SMA的表达
荧光显微镜观察结果显示(图5),与Control组相比,HG组CFBs细胞数量显着增加,绿色荧光强度增强;与HG组比较,OMT低、中及高剂量组CFBs细胞数量减少,绿色荧光强度减弱。
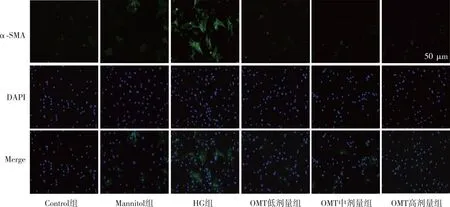
注:绿色荧光表示α-SMA,蓝色荧光表示细胞核。
2.6 细胞周期
流式细胞仪检测结果表明(图6),与Control组相比,HG组CFBs细胞在S期的分布比例增加(P<0.05);与HG组相比,OMT低、中及高剂量组CFBs细胞在S期的分布比例有所减少(P<0.05);与Control组相比,Mannitol组无差异(P>0.05)。
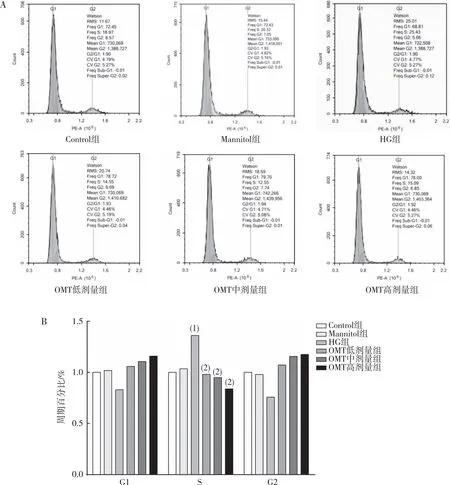
注:A为流式细胞仪检测结果,B为定量结果;(1)与Control组相比,P<0.05;(2)与HG组相比,P<0.05。
2.7 细胞HIF-1α和VEGFA蛋白的表达
Western bolt实验结果表明(图7),与Control组相比,HG组CFBs中HIF-1α、VEGFA蛋白的表达升高(P<0.05);与HG组相比,OMT低、中及高剂量组CFBs中HIF-1α和VEGF蛋白表达减少(P<0.05);与Control组相比,Mannitol组HIF-1α和VEGF蛋白表达无差异(P>0.05)。
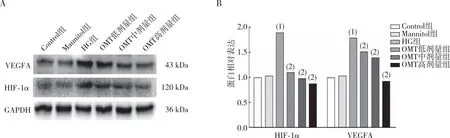
注:A为电泳结果,B为蛋白定量结果;(1)与Control组相比,P<0.05;(2)与HG组相比,P<0.05。
2.8 细胞α-SMA、CTGF、CollagenⅠ、CollagenⅢ及FN蛋白的表达
Western bolt实验结果表明(图8),与Control组相比,HG组CFBs中α-SMA、CTGF、Collagen Ⅰ、Collagen Ⅲ及FN蛋白表达升高(P<0.05);与HG组相比,OMT低剂量、中剂量及高剂量组CFBs中α-SMA、CTGF、CollagenⅠ、Collagen Ⅲ及FN蛋白表达减少(P<0.05);与Control组相比,Mannitol组上述蛋白表达无差异(P>0.05)。
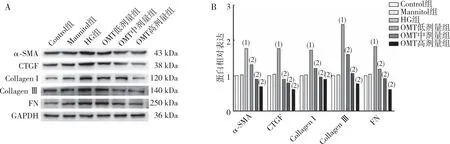
注:A为电泳结果,B为蛋白定量结果;(1)与Control组相比,P<0.05;(2)与HG组相比,P<0.05。
2.9 细胞VEGFA、HIF-1α、α-SMA、CTGF、Collagen Ⅰ及Collagen Ⅲ蛋白的表达
蛋白质免疫印迹法检测HIF-1α信号相关蛋白以及MF相关蛋白的表达,结果提示(图9),与Control组比较,HG组CFBs中HIF-1α、VEGF及MF相关蛋白表达升高(P<0.05);与HG组比较,OMT组(200 mg/L)和YC-1组(1 mg/L)CFBs中HIF-1α、VEGF及MF相关蛋白表达减少(P<0.05)。
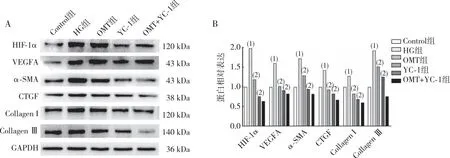
注:A为电泳结果,B为蛋白定量结果;(1)与空白组(Control)组相比,P<0.05;(2)与HG组相比,P<0.05。
3 讨论
糖尿病引起的心血管并发症已成为全球发病率和死亡率的主要原因,这些疾病包括冠心病、风湿性心脏病、外周血管疾病、心力衰竭、先天性心脏病及心肌病,病理性MF几乎参与了心血管病的所有病理生理过程,DCM在进展的早期阶段没有临床症状,主要表现为各种形式的心脏代谢异常,这可能与MF和僵化的增加有关,这些有害的变化进一步导致心房充盈功能障碍和左心室舒张末期压力升高,后期DCM演变为心力衰竭,随后是心脏重塑、左心室肥厚、心肌间质纤维化及舒张功能障碍,进一步导致射血分数降低的心力衰竭[17-18]。由于DCM发病机制的复杂性和临床特征,临床管理面临着巨大的挑战。尽管过去10年进行了大量的研究,但DCM的治疗仍然是一个医学难题。2008年,美国食品和药物管理局(Food and Drug Administration,FDA)也提出,仅仅控制血糖对糖尿病引起的心血管并发症是不够的,需要深入研究DCM的病理基础和发病机制,以降低患者的死亡率[19]。DCM病变导致心肌供血不足,心脏的舒张功能也下降,加重纤维化的形成,最终导致MF[20]。间质心肌中含有大量的胶原蛋白,这可能导致心脏依从性受损,心脏功能的收缩和舒张能力也将下降[21],DCM的发生会引起心肌能量代谢紊乱,毛细血管基底膜增厚[22],胶原结构改变,心脏自主神经病变,导致微循环障碍,这会引起心肌广泛的坏死、纤维化,心脏的收缩功能下降,从而导致心脏扩大、心律失常、甚至猝死等[23]。此外,胰岛素抵抗和葡萄糖的高毒性会在一定程度上破坏心肌组织,加剧心肌无力及心肌组织的纤维化[24]。当DCM病症持续严重时,患者的心室扩张,左心室壁厚度增大,心脏结构将发生改变,引发心功能不全[25]。DCM是由糖尿病引起的一种特异性心肌病,是高血压的早期症状,但也伴随着舒张心功能受损和收缩,随着疾病的发展,会逐渐导致心力衰竭,死亡率和临床致残率均较高[26]。随着时间的推移,越来越多研究发现,高血糖的存在已经被证实对心脏结构和心功能会产生不良的影响[27]。因此,为了明确介导FMT的新机制开展深入的研究,寻找可以改善CFBs转分化的天然药物非常重要。
MF的特征是CFBs的积累和ECM的过度沉积,CFBs转分化出来的肌成纤维细胞是导致心脏纤维化的主要原因,这些病变是DCM的起始和进展[28]。因此,控制CFBs异常增殖和向肌成纤维细胞转分化对于减轻心脏纤维化至关重要。而寻找抑制人类心脏纤维化的新分子靶点一直是一个重要的研究热点。OMT是苦参中重要且有效的成分,其独特的药理作用可以改善心血管疾病[29];有研究表明,OMT可以调节多种参与糖尿病MF的关键基因[30],因此可以作为糖尿病MF研究的阳性药物,确认发生MF的真实性和药物药效作用的有效性。本研究结果表明,HG可促进CFBs的转分化,从而引起CFBs病理形态的改变,同时也会上调MF蛋白的表达,OMT则能够有效地逆转上述现象,因此表明OMT对HG诱导的CFBs转分化具有一定的抑制作用。
DCM中CFBs大量增殖,不仅面临更多的氧气消耗,而且还会出现表皮肥厚的现象,最终导致氧供应的障碍[31-32];大量研究还显示,转录因子HIF-1α在缺氧的组织或细胞可以被有效地储存,从而调控及影响其下游多种因子的转录和表达[33-34];其中,包括TGF-β1、VEGFA等具有促纤维化功能的分子[35-36]。HIF-1α在纤维化发生机制中扮演者重要的角色,鉴于HIF-1α的特殊功能,其可能参与了MF过程,并有可能成为有效的治疗靶点。YC-1作为一种特异的HIF-1α抑制剂,它在抑制纤维化方面发挥着重要作用,不仅能够有效地抑制HIF-1α的转录活性,而且能抑制其下游分子的转录和表达[37-38]。YC-1能否通过抑制HIF-1α,从而减轻MF程度,目前还没有相关的研究报道。有研究表明,HIF-1α是一种核转录因子,介导哺乳动物细胞对缺氧的反应。广泛表达于哺乳动物的各种组织和细胞中,促进机体和细胞对缺氧的适应[39-40]。因此,HIF-1α作为使机体耐受缺氧、维持氧稳态的重要因素,并且为纤维化疾病的诊断和治疗带来了全新的视角。本研究中,采用体外实验培养HG诱导的大鼠CFBs增殖模型,旨在深入探讨HIF-1α在HG情况下如何加重MF程度的分子机制,以及其抑制剂YC-1对HG诱导的MF的抑制作用,最终提供一种有效的抗糖尿病MF的治疗策略。
综上,OMT通过调控HIF-1α信号可以有效地改善HG诱导的CFBs转分化,减少胶原的沉积以及MF相关蛋白的表达,同时也减弱了相关信号分子的表达,进一步表明OMT通过影响HIF-1α信号发挥抑制CFBs转分化的作用及机制,减少MF的发生和发展,为预防和治疗MF奠定良好的基础。



