孙治霞,王丽辉,索红亮,陈乾
机械通气相关性肺损伤(ventilation-induced lung injury,VILI)是呼吸机应用过程中由于机械通气等诸多因素导致的肺组织损伤,其临床病理特征为肺浸润、血管内皮细胞通透性增加、肺水肿、缺氧等[1-2]。中医学认为VILI 存在热结肠腑、血瘀、肺气内闭等表现,治疗应从泻腑通便、活血化瘀、宣通肺气入手[3]。桃仁承气汤源于《伤寒论》,具有破血祛瘀的功效。加味桃仁承气汤是在桃仁承气汤中加入黄芪、地黄、玄参、麦冬而成,其具有降糖、降脂、抑制炎症等作用[3]。加味桃仁承气汤为泻腑通便、活血化瘀的重要方剂,有通腑气、利肺气的功效,但加味桃仁承气汤对VILI 的预防作用鲜有报道。腺苷酸活化蛋白激酶(AMP activated protein kinase,AMPK)参与机体对炎症反应的调控,也与细胞自噬过程相关。研究发现AMPK 与哺乳动物雷帕霉素靶蛋白(mTOR)的信号通路存在交叉,mTOR是细胞自噬过程中的重要细胞因子之一[4]。mTOR 具有mTORC1和mTORC2 两种复合体,活化的AMPK 会使mTORC1 表达下调,诱导细胞自噬[5]。本研究通过建立大鼠VILI 模型,并予以加味桃仁承气汤及AMPK 抑制剂Compound C,观察加味桃仁承气汤通过AMPK/mTOR信号通路对大鼠VILI的调节作用。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠60只,体质量250~300 g,购自广东至远生物医药科技有限公司,动物生产许可证号:SCXK(粤)2021-0057。动物分笼饲养,饲养环境温度22~25 ℃,相对湿度40%~60%,12 h昼夜交替,动物自由摄食、饮水。适应性饲养7 d后用于实验。本实验已得到河南省中医院动物伦理委员会的批准(批号:2022-0148)。
1.2 主要试剂与仪器 加味桃仁承气汤由桃仁12 g、大黄15 g、赤芍12 g、丹皮12 g、桂枝6 g、当归9 g、芒硝4 g、炙甘草6 g、黄芪30 g、地黄12 g、玄参12 g、麦冬12 g 组成,购于河南省中医院中药房,已经鉴定均为正品,由河南省中医院中药制剂室煎制,于4 ℃储存。AMPK 抑制剂Compound C 购自Sigma Aldrich 公司;戊巴比妥钠购自西安沃尔森生物技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-18 酶联免疫吸附试验(ELISA)试剂盒购自上海西唐生物科技有限公司;Trizol 试剂、RIPA裂解液购自Thermo Fisher公司;逆转录试剂盒、PCR试剂盒购自天根生化科技有限公司;PCR引物由上海捷瑞生物工程有限公司设计合成;AMPK、p-AMPK、mTOR、pmTOR、Beclin-1、LC3 兔抗鼠一抗和相应羊抗兔二抗购自美国Santa Cruz 公司。小动物呼吸机购自Harvard Apparatus 公司;Image图像分析仪购自美国Bio-Rad公司;RT-qPCR仪购自美国Thermo Fisher公司;倒置显微镜购自上海蔡康光学仪器厂;透射电子显微镜购自日本JEOL公司。
1.3 方法
1.3.1 大鼠VILI 模型的构建与分组 参照文献[6]方法,对48 只大鼠构建VILI 模型。实验前大鼠禁食12 h,自由饮水。腹腔注射2%戊巴比妥钠(50 mg/kg)麻醉大鼠,将其仰卧位固定,颈部皮肤备皮,碘伏消毒,在颈部正中切口,止血钳分离切口下皮肤与肌肉,暴露大鼠气管。将气管切开,插入气管导管并固定,接小动物呼吸机进行机械通气,股动脉插管进行采血与动脉压监测,股静脉插管建立液体通道,保持经脉通畅。呼吸机参数设置:呼吸频率40 次/min,潮气量为40 mL/kg,吸呼比(I∶E)1∶1,呼气末正压为0,吸入氧浓度(fraction of inspiration O2,FiO2)为21%。通气时大鼠保持仰卧位,室温维持26~28 ℃。
采用随机数字表法将造模成功的48只大鼠分成4组,分别为模型组(Model 组)、加味桃仁承气汤低剂量组(中药-L组,2.85 g/kg[7])、加味桃仁承气汤高剂量组(中药-H 组,8.55 g/kg[8])和加味桃仁承气汤高剂量+AMPK 抑制剂Compound C 组(中药-H+CC 组,加味桃仁承气汤8.55 g/kg+Compound C 250 μg/kg[7]),每组12只。另取12只大鼠作为假手术组(Sham组),Sham组不作机械通气,仅行气管切开和插管操作。中药-L组、中药-H组和中药-H+CC 组机械通气前7 d 灌胃相应剂量的加味桃仁承气汤,Model 组机械通气前7 d灌胃等量生理盐水,1次/d,共7次;Compound C 采取尾静脉注射,每2 d注射1次,共3次。
1.3.2 动脉血氧合指数(oxygenation index,OI)测定 各组大鼠在机械通气插管即刻,机械通气1 h、2 h、4 h(结束通气)时采集动脉血,进行血气检测,记录动脉血氧分压[p(O2)],根据FiO2计算OI,OI=p(O2)/FiO2。
1.3.3 ELISA 法检测肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中TNF-α、IL-1β、IL-18 水平 机械通气4 h 后处死大鼠,结扎大鼠右主支气管,用预冷的生理盐水5 mL灌洗左肺,收集BALF,4 ℃下3 000 r/min离心10 min,取出上清液,于-80 ℃保存。按照ELISA试剂盒说明书操作,检测各组大鼠BALF中TNF-α、IL-1β、IL-18水平。
1.3.4 肺湿/干重(wet/dry lung weight,W/D)比值测定 处死大鼠后摘取其右肺,称其质量即为湿重;将其置于80 ℃恒温箱干燥24 h,再次称质量计为干重。W/D=湿重/干重。
1.3.5 HE染色观察大鼠肺组织病理学变化并评分 收集大鼠肺组织,使用4%多聚甲醛进行固定,经常规石蜡包埋、切片、HE染色,封片。于光镜下观察各组大鼠肺组织病理学变化。参照文献[9]方法,对肺损伤程度进行评分。根据损伤程度由轻到重,计为0、1、2、3、4分。观察指标为:肺泡水肿情况、出血、中性粒细胞浸润、肺泡壁增厚或透明膜形成。
1.3.6 透射电镜观察自噬体情况 在低温状态下,从左肺门附近取约1 mm3组织块,浸入2.5%的戊二醛固定液,混匀后于4 ℃固定2 h,并依次经1%锇酸固定、1%醋酸铀块染、梯度乙醇脱水、丙酮浸泡、包埋聚合,制作半薄切片和超薄切片,透射电镜下观察肺组织上皮细胞的形态并进行拍照。
1.3.7 RT-qRCR 测定肺组织中AMPK、mTORC1 mRNA 表达水平 取大鼠肺组织,加入Trizol 试剂进行组织RNA 的提取。根据逆转录试剂盒说明书将RNA 逆转录为cDNA。以cDNA为模板,进行PCR扩增反应。PCR反应条件:95 ℃预变性60 s;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s,进行40个循环。以GAPDH 为内参,使用2-ΔΔCt计算AMPK、mTORC1 mRNA的相对表达量。引物序列见表1。

Tab.1 Sequences of the primers表1 引物序列
1.3.8 Western blot 法检测肺组织中AMPK、p-AMPK、mTORC1、p-mTORC1 和自噬相关蛋白的表达 取出大鼠肺组织加入PIPA 裂解液,经高速低温组织研磨仪研磨后,4 ℃低温裂解,12 000 r/min 离心10 min 后,取上清液为肺组织总蛋白。BCA蛋白定量试剂盒对总蛋白进行定量。上样,12%SDS-PAGE,转膜后加入AMPK(1∶500)、p-AMPK(1∶500)、mTORC1(1∶500)、p-mTORC1(1∶500)、Beclin-1(1∶1 000)、LC3-Ⅰ(1∶1 000)、LC3-Ⅱ(1∶1 000)、GAPDH(1∶1 000)一抗,在4 ℃下孵育过夜。次日加入相应二抗(1∶1 000),在37 ℃下孵育2 h,以GAPDH为内参,Image图像分析仪分析目标蛋白条带的相对灰度值。
1.4 统计学方法 采用Graphpad Prism 7.0 软件分析数据,计量数据采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠各时间点OI 比较 机械通气2 h、4 h时,与Sham 组相比,Model 组OI 降低(P<0.05);与Model 组、中药-L 组相比,中药-H 组OI 升高(P<0.05);与中药-H 组相比,中药-H+CC 组OI 降低(P<0.05),见表2。
Tab.2 Comparison of OI at each time points between the five groups of rats表2 各组大鼠各时间点OI比较(n=12,mmHg,±s)

Tab.2 Comparison of OI at each time points between the five groups of rats表2 各组大鼠各时间点OI比较(n=12,mmHg,±s)
**P<0.01;a与Sham组比较,b与Model组比较,c与中药-L组比较,d与中药-H组比较,P<0.05;表3—5同;1 mmHg=0.133 kPa。
组别Sham组Model组中药-L组中药-H组中药-H+CC组F插管即刻566.23±34.35 572.36±32.62 568.40±33.14 563.83±30.15 568.36±31.07 0.114通气1 h 557.68±26.92 549.73±29.66 553.17±30.83 555.24±28.35 551.29±29.64 0.141通气2 h 548.44±28.48 265.52±20.31a 286.50±21.22 521.86±27.96bc 432.64±20.33d 357.164**通气4 h 546.35±25.87 208.94±15.47a 223.64±16.42 515.30±23.65bc 410.68±23.52d 658.911**
2.2 各组大鼠BALF中TNF-α、IL-1β、IL-18水平比较 与Sham 组相比,Model 组大鼠BALF 中TNF-α、IL-1β 和IL-18 水平升高(P<0.05);与Model 组、中药-L 组相比,中药-H 组BALF 中TNF-α、IL-1β 和IL-18 水平降低(P<0.05),中药-L 组与Model 组比较差异无统计学意义(P>0.05);与中药-H组相比,中药-H+CC 组大鼠BALF 中TNF-α、IL-1β 和IL-18水平升高(P<0.05),见表3。
Tab.3 Comparison of levels of TNF-α,IL-1β and IL-18 in BALF between the five groups of rats表3 各组大鼠BALF中TNF-α、IL-1β、IL-18水平比较(n=12,ng/L,±s)
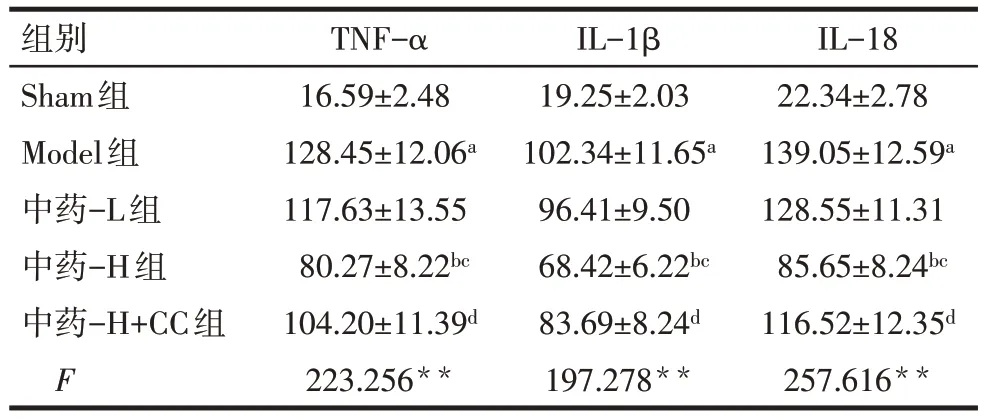
Tab.3 Comparison of levels of TNF-α,IL-1β and IL-18 in BALF between the five groups of rats表3 各组大鼠BALF中TNF-α、IL-1β、IL-18水平比较(n=12,ng/L,±s)
组别Sham组Model组中药-L组中药-H组中药-H+CC组F TNF-α 16.59±2.48 128.45±12.06a 117.63±13.55 80.27±8.22bc 104.20±11.39d 223.256**IL-1β 19.25±2.03 102.34±11.65a 96.41±9.50 68.42±6.22bc 83.69±8.24d 197.278**IL-18 22.34±2.78 139.05±12.59a 128.55±11.31 85.65±8.24bc 116.52±12.35d 257.616**
2.3 各组大鼠肺W/D 值比较 Sham 组、Model 组、中药-L组、中药-H组、中药-H+CC组大鼠肺W/D值分别为4.59±0.42、6.67±0.65、6.13±0.57、5.16±0.54、6.09±0.58,差异有统计学意义(n=6,F=13.521,P<0.01)。与Sham组相比,Model组大鼠肺W/D值升高(P<0.05);与Model 组、中药-L 组相比,中药-H 组大鼠肺W/D值降低(P<0.05),中药-L组与Model比较差异无统计学意义(P>0.05);与中药-H组相比,中药-H+CC组大鼠肺W/D值升高(P<0.05)。
2.4 各组大鼠肺组织病理学变化与肺损伤评分的比较 Sham 组肺组织形态完整,肺泡腔清晰,未见肺泡隔增厚、水肿;Model组肺组织结构缺失破坏,肺泡腔水肿、增厚,肺泡内有渗出,肺泡萎缩;与Model组相比,中药-H 组肺组织损伤明显改善,组织结构有所恢复,肺泡形态正常,肺泡隔增厚较轻微,肺泡壁水肿减轻,偶见肺泡腔水肿渗出。与中药-H组相比,中药-H+CC 组肺组织病理损伤加重,肺泡壁水肿明显,肺泡腔渗出增多,见图1。Sham 组、Model组、中药-L 组、中药-H 组、中药-H+CC 组肺损伤评分分别为(0.00±0.00)分、(9.83±1.17)分、(9.33±1.37)分、(6.17±0.75)分、(8.33±0.82)分,差异有统计学意义(n=6,F=108.024,P<0.05)。与Sham 组相比,Model 组肺损伤评分升高(P<0.05);与Model组、中药-L组相比,中药-H组肺损伤评分降低(P<0.05),中药-L 组与Model 组比较差异无统计学意义(P>0.05);与中药-H组相比,中药-H+CC组大鼠肺损伤评分升高(P<0.05)。
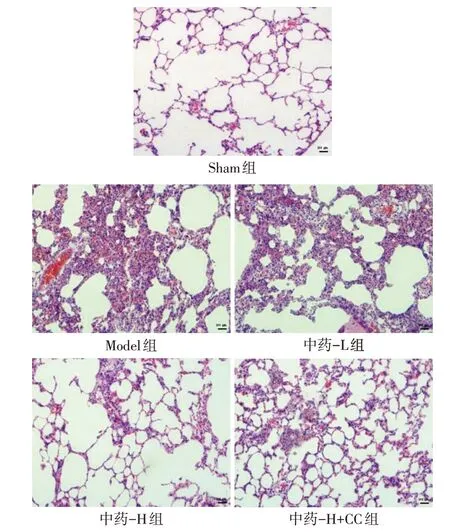
Fig.1 HE staining of rat lung tissue in each group(×100)图1 各组大鼠肺组织HE染色(×100)
2.5 各组大鼠肺组织超微结构表现 Sham 组肺泡组织结构完整,线粒体形态正常,无水肿,呈较扁状,嵴线分明,板层小体内容物丰富;Model 组线粒体高度水肿,嵴线溶解甚至消失,板层小体内容物减少,自噬体形成。与Model 组相比,中药-L 组、中药-H组的肺泡细胞损伤减轻,线粒体轻微肿胀,自噬小体增多;其中中药-H 组的损伤更轻,自噬小体较多。与中药-H 组相比,中药-H+CC 组肺泡细胞损伤加重,自噬小体减少,见图2。
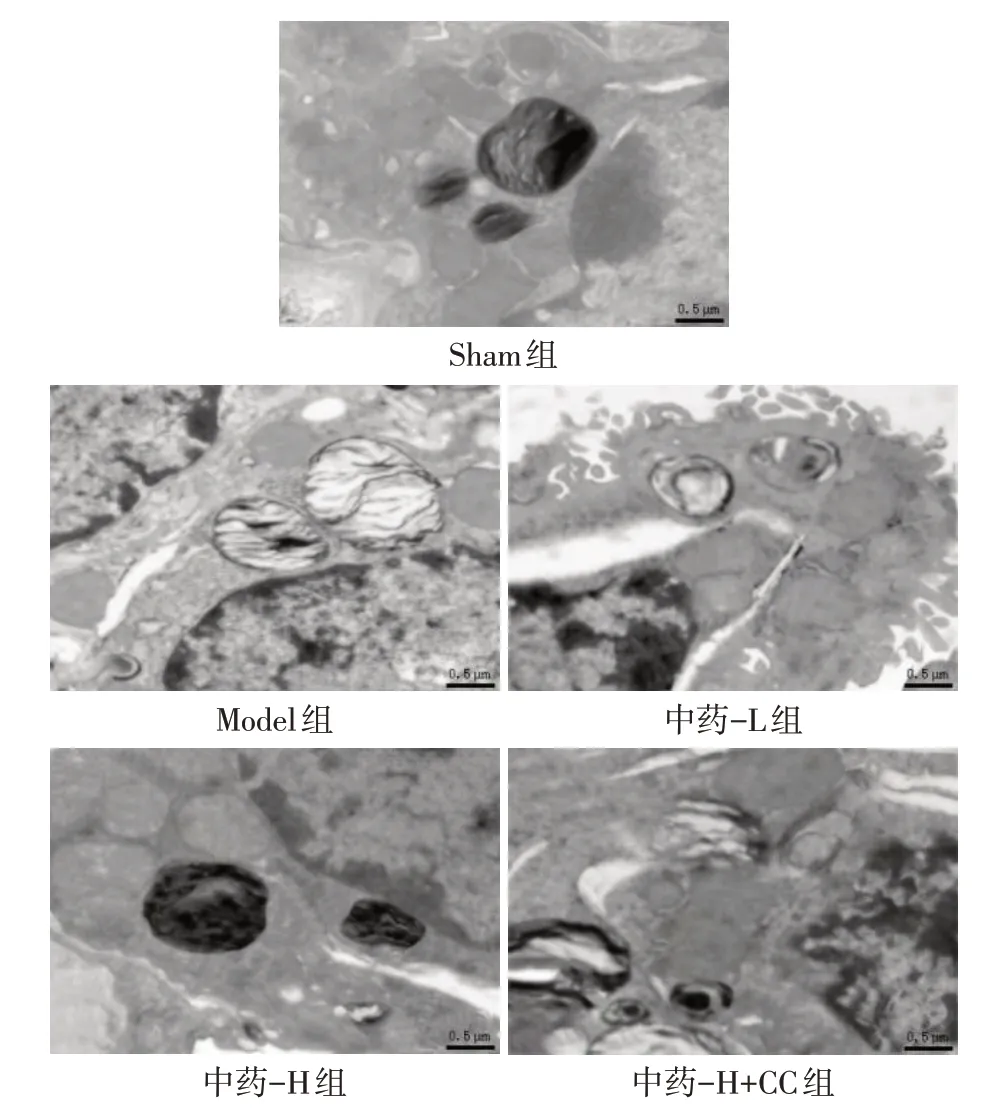
Fig.2 Observation of alveolar epithelial cells of rats in each group by transmission electron microscope(×15 000)图2 透射电镜观察各组大鼠肺泡上皮细胞(×15 000)
2.6 各组大鼠肺组织中AMPK、mTORC1 mRNA 的表达比较 与Sham 组相比,Model 组肺组织中AMPK mRNA表达水平降低,mTORC1 mRNA表达水平升高(P<0.05);与Model 组、中药-L 组相比,中药-H 组肺组织中的AMPK mRNA 表达水平升高,mTORC1 mRNA表达水平降低(P<0.05),中药-L组与Model 组比较差异无统计学意义(P>0.05);与中药-H组相比,中药-H+CC组肺组织中AMPK mRNA表达水平降低,mTORC1 mRNA 表达水平升高(P<0.05),见表4。
Tab.4 Comparison of AMPK and mTORC1 mRNA expression in lung tissue between the five groups of rats表4 各组大鼠肺组织中AMPK、mTORC1 mRNA表达比较(n=6,±s)
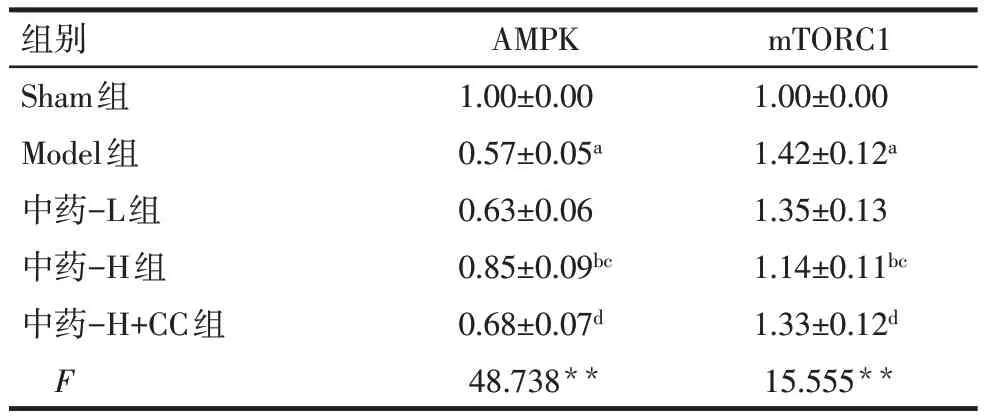
Tab.4 Comparison of AMPK and mTORC1 mRNA expression in lung tissue between the five groups of rats表4 各组大鼠肺组织中AMPK、mTORC1 mRNA表达比较(n=6,±s)
组别Sham组Model组中药-L组中药-H组中药-H+CC组F AMPK 1.00±0.00 0.57±0.05a 0.63±0.06 0.85±0.09bc 0.68±0.07d 48.738**mTORC1 1.00±0.00 1.42±0.12a 1.35±0.13 1.14±0.11bc 1.33±0.12d 15.555**
2.7 各组大鼠肺组织中AMPK/mTOR信号通路与自噬相关蛋白表达比较 与Sham 组相比,Model 组肺组织中p-AMPK、LC3-Ⅱ/LC3-Ⅰ、Beclin-1 表达水平降低,p-mTORC1 表达水平升高(P<0.05);与Model 组、中药-L 组相比,中药-H 组肺组织中p-AMPK、LC3-Ⅱ/LC3-Ⅰ、Beclin-1 表达水平升高,pmTORC1 表达水平降低(P<0.05),中药-L 组与Model 比较差异无统计学意义(P>0.05);与中药-H组相比,中药-H+CC 组大鼠肺组织中p-AMPK、LC3- Ⅱ/LC3- Ⅰ、Beclin-1 表达水平降低,pmTORC1表达水平升高(P<0.05),见表5、图3。
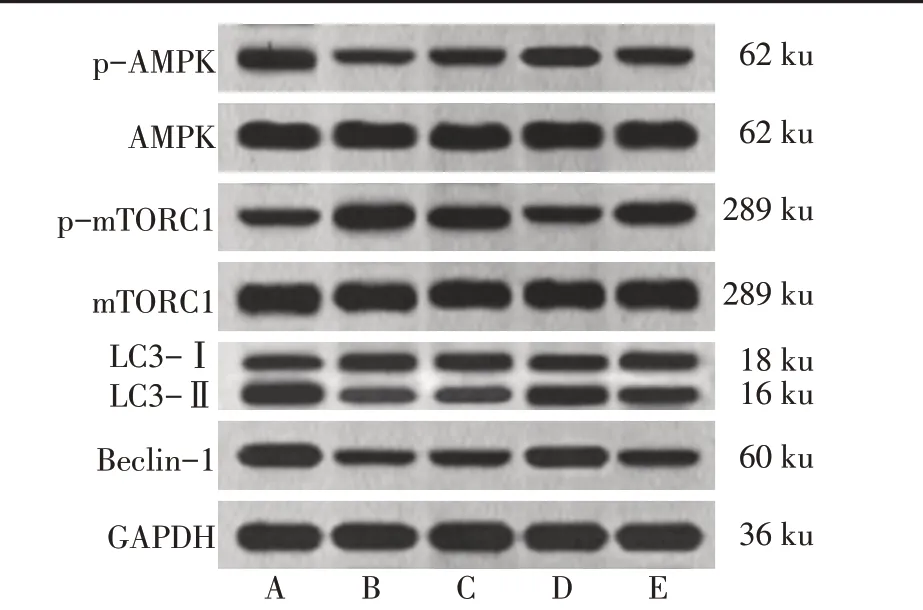
Fig.3 Expression of AMPK/mTOR pathway-related proteins and autophagy-related proteins in lung tissue of rats in each group图3 各组大鼠肺组织中AMPK/mTOR通路相关蛋白、自噬相关蛋白表达
Tab.5 Comparison of expression of AMPK/mTOR signaling pathway-related proteins and autophagy-related proteins in lung tissue between five groups of rats表5 各组大鼠肺组织中AMPK/mTOR信号通路相关蛋白与自噬相关蛋白表达比较 (n=6,±s)
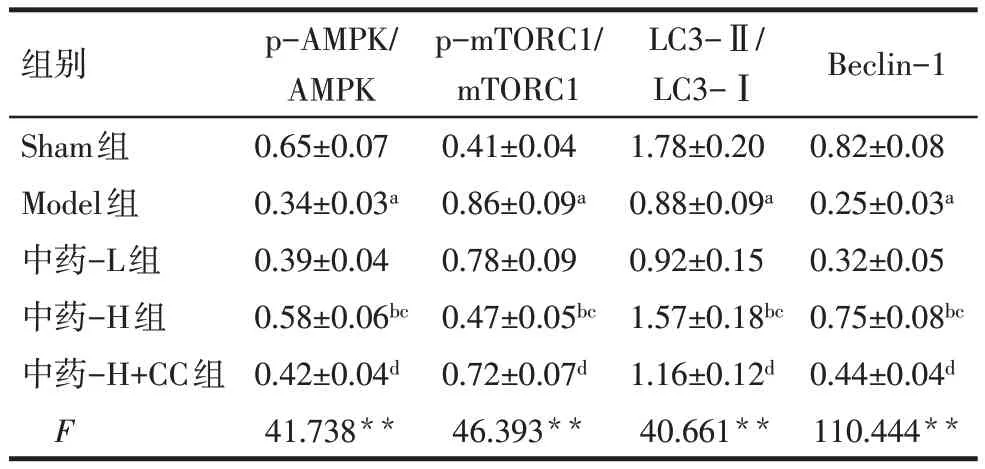
Tab.5 Comparison of expression of AMPK/mTOR signaling pathway-related proteins and autophagy-related proteins in lung tissue between five groups of rats表5 各组大鼠肺组织中AMPK/mTOR信号通路相关蛋白与自噬相关蛋白表达比较 (n=6,±s)
组别Sham组Model组中药-L组中药-H组中药-H+CC组F p-AMPK/AMPK 0.65±0.07 0.34±0.03a 0.39±0.04 0.58±0.06bc 0.42±0.04d 41.738**p-mTORC1/mTORC1 0.41±0.04 0.86±0.09a 0.78±0.09 0.47±0.05bc 0.72±0.07d 46.393**LC3-Ⅱ/LC3-Ⅰ1.78±0.20 0.88±0.09a 0.92±0.15 1.57±0.18bc 1.16±0.12d 40.661**Beclin-1 0.82±0.08 0.25±0.03a 0.32±0.05 0.75±0.08bc 0.44±0.04d 110.444**
3 讨论
VILI 是由于机械通气所致的肺损伤,而机械通气是维持急性呼吸衰竭患者生命的干预手段之一[10]。越来越多证据表明,VILI 的发生机制是由于机械过度刺激,诱导肺部发生炎症反应,引起肺组织水肿、炎性细胞浸润,炎性因子入血导致全身性炎症等严重后果[11]。临床缓解VILI 主要依靠抗感染药物、抗氧化药物、环氧化酶抑制剂和肌松药等[12]。本研究采用呼吸机对大鼠进行机械通气建立VILI 大鼠模型,HE染色结果显示机械通气导致Model 组大鼠肺组织结构紊乱、肺泡间隔增厚,肺泡腔水肿、增厚,肺泡内有渗出。与Sham 组相比,VILI 大鼠血液OI 降低,肺W/D、炎性因子水平及肺损伤评分升高,提示大鼠VILI 模型建立成功,与相关文献[2]报道一致。
加味桃仁承气汤是治疗伤寒太阳蓄血症的经典名方,以逐腑泄热为主,桃仁能够破血消瘀,大黄有攻下泄热的作用,芒硝软坚散结;当归、黄芪补气养血。诸药合用能达到更好活血散瘀、通腑泄热的功效[13]。黄耀明等[14]研究发现,桃仁承气汤内服与四黄膏加味外敷合用治疗脊柱压缩性骨折,可以提高疗效。马翠芹等[15]研究发现,加味桃仁承气汤联合护理干预能够有效缓解胸腰椎压缩性骨折后腹胀便秘症状。但加味桃仁承气汤在VILI 预防与治疗中的作用尚不清楚。通过参考相关文献[7-8]以及前期预实验结果,本研究确定了加味桃仁承气汤的低、高剂量,给予VILI 模型大鼠不同剂量的加味桃仁承气汤,观察各组疗效,以探究加味桃仁承气汤在VILI中的作用。本研究肺组织HE 染色和炎性因子检测结果显示,机械通气会使肺组织出现损伤,出现一系列炎症反应;加味桃仁承气汤干预后肺组织病理损伤减轻,肺损伤评分降低,肺泡腔渗出和炎症反应减少;机械通气使毛细血管内皮细胞和肺泡上皮细胞通透性增加,引起肺水肿,加味桃仁承气汤干预后肺水肿减轻。OI 是器官组织进行氧合作用获得能量的一个重要指数,在一定程度上可反映肺功能。本研究发现中药-H组相比Model组OI明显提高,说明肺功能有所恢复。以上结果提示加味桃仁承气汤可能具有减轻VILI的作用。
细胞自噬是一种机体自我调节形式,机体通过吞噬自身衰老细胞或细胞器,一定程度上减轻机体损伤[16]。Beclin1 是自噬启动因子,当自噬发生,胞质型LC3 转变为自噬体,即LC3-Ⅱ[17]。因此,本研究以Beclin1、LC3作为检测自噬水平的主要标志物。AMPK/mTOR 信号通路是细胞自噬的重要途径之一,AMPK 与mTOR 均是细胞自噬过程中的重要信号分子。当自噬发生时,AMPK被磷酸化激活,降低mTOR 磷酸化水平[18]。本研究结果显示,机械通气可通过抑制AMPK/mTOR 信号通路,使肺出现VILI,肺泡内皮细胞通透性增加,肺泡腔水肿增厚,肺泡内有渗出,肺泡萎缩;而加味桃仁承气汤可以减轻VILI。本研究结果显示,机械通气可降低肺组织中AMPK mRNA 表达和AMPK 磷酸化水平,从而负向调控使mTORC1 mRNA 表达、mTORC1 磷酸化水平升高。而加味桃仁承气汤可通过激活AMPK/mTOR信号通路,导致大鼠肺组织中AMPK mRNA 表达和AMPK 磷酸化水平上升,负向调节使mTORC1 mRNA 表达、mTORC1 磷酸化水平下降。随着AMPK/mTOR 信号通路的抑制或激活,在有无加味桃仁承气汤干预的大鼠肺组织中自噬相关蛋白的表达也发生一定变化。Western blot 结果显示,机械通气可抑制细胞自噬,使Model 组大鼠肺组织中LC3-Ⅱ/LC3-Ⅰ、Beclin-1 蛋白表达降低;而加味桃仁承气汤干预后的VILI 大鼠肺组织中自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ、Beclin-1 表达升高,且与低剂量加味桃仁承气汤相比,高剂量的中药对细胞自噬的促进作用更强。因此,笔者推测加味桃仁承气汤可能通过激活AMPK/mTOR 信号通路促进细胞自噬,减轻大鼠VILI,而透射电镜实验也得到相同的结果。以AMPK 抑制剂Compound C 干预高剂量中药处理的大鼠后,发现Compound C 可减弱高剂量中药对VILI大鼠的保护作用。
综上所述,加味桃仁承气汤可能通过激活AMPK/mTOR 信号通路促进细胞自噬,减轻大鼠VILI。本研究为VILI 临床治疗药物研发提供了参考。然而本研究还存在不足之处,加味桃仁承气汤减轻大鼠VILI 可能还存在其他信号通路和机制,同时,本研究仅初步说明加味桃仁承气汤对VILI 可能具有一定的缓解作用,而与临床肺保护性通气策略相比,何者更优或二者联用能否增强疗效,还需进一步观察。



