肖 月
国家卫生健康委卫生发展研究中心暨国家药品和卫生技术综合评估中心,北京,100191
英国卫生技术评估体系举世瞩目,特别是位于英格兰的英国国家卫生与服务优化研究院(National Institute for Health and Care Excellence, NICE),获得世界卫生组织的盛赞,成为世界各国卫生技术评估机构学习的典范。我国卫生智库国家卫生健康委卫生发展研究中心2008年与NICE建立合作,签署了2轮的合作谅解备忘录并开展合作研究课题。前期国内学界关于英国NICE经验介绍不少,但多数仅关注评估流程和方法[1-2],未结合其发展沿革看评估机制方法演变过程,且缺乏对其新型冠状病毒肺炎(以下简称“新冠肺炎”)疫情以来的转型发展的了解。本文旨在介绍NICE发展历程及卫生技术评估相关工作情况,力求从体系和机制角度分析英国卫生技术评估主要模式和经验,为我国持续建设国家卫生技术评估体系提供参考。
1 英国国家卫生与服务优化研究院简介
1.1 建立背景及目的
英国国家卫生与服务优化研究院(NICE)作为国家卫生技术评估(health technology assessment, HTA)机构,于1999年创立,2010年以前是隶属于英格兰卫生部门的公共机构,仅为国民卫生服务体系(national health service, NHS)作决策,2010年后升格为英国国会直接管理的公共机构,有关技术服务范围扩大到公共卫生和社会照护服务领域。英国政府创建NICE的初衷是解决NHS当时发展面临的瓶颈,即奉行全民免费医疗所带来的尖锐供需矛盾及临床诊治行为不规范产生的服务质量差异和资源浪费问题。1997年上台的英国新工党政府为了支持NHS转型和改革,投入千万英镑建立NICE,其职责是服务NHS的药械技术准入决策,开发临床指南规范NHS医疗机构人员行为,并支持卫生部门的医疗资源配置使用决策制定。彼时包括英国在内的发达国家正兴起“循证医学”的医学模式转型,为萌生循证卫生决策提供了原始动力,同时卫生经济学评价工具方法的发展,给卫生资源配置决策提供了科学工具。NICE建立恰逢其时,成为英国政府控制卫生预算调整决策、规范管理临床诊治行为的利器。
1.2 组织架构
NICE早期规模小,职责有限,人员不多,因此采取较为灵活的组织架构,人员方面主要借助英国医学会和大学有关专家教授开展工作,同时外包行政后勤服务,专职人员一岗多责,鼓励跨机构合作等。随着职能扩大、功能完善和职员增加,NICE逐步建立较为固定明晰的管理架构。总体看,NICE内部组织架构为直线-职能制组织架构。以直线为基础,董事会在行政管理部门和7个部门的主任支持下,负责机构战略设置和总体运营管理,协调推动各部门工作[3]。见图1。
NICE近年来不断强化内部运行管理,建立了运营管理、信息化和沟通传播部门,机构组织管理机制日趋成熟完善。同时,业务部门按专业化分工原则建立,不仅细化了传统评价和指南开发的功能,还增加了对于服务体系关注和基础方法学的关注。4个主要的业务部门中,指南中心开发面向医务人员和患者的临床诊疗指南、公共卫生服务指南和社会照护服务指南;卫生技术评估评价中心不仅负责临床药品、医疗器械、诊断技术、诊疗干预措施和技术实证的评估,参与卫生部门主题遴选,近年来还开展肿瘤药物基金药品评价、数字医疗技术评价,并针对企业建立了新技术市场准入咨询业务,指导英国医药企业创新研发有用的医药技术产品;卫生和社会照护服务部负责定义和衡量卫生、公共卫生和社会保健的质量;科学证据分析部专注于方法学分析,支持NICE科学使用方法工具,合理利用证据和临床数据开展业务工作。
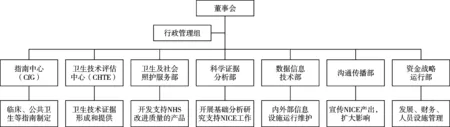
图1 NICE组织构架
NICE固定工作人员仅有200人,指南开发和评估工作主要依靠临床专家、大专院校学者、卫生经济学家、患者代表等开展。临床专家主要来自于皇家医学院各专委会的知名专家,伦敦政治经济学院、约克大学、谢菲尔德大学、南安普顿大学等知名院校的教授和卫生经济学家负责经济学评价工作,患者和公民代表及行业代表也有机会代表各自群体参与HTA过程或指南开发。
1.3 发展沿革
作为欧美国家首批建立的国家级卫生技术评估机构,NICE发展经历了3个阶段,围绕国家卫生治理和改革发展需要,其职能不断扩大、功能逐步完善。
第一阶段:初建探索阶段(1999-2009年)。 NICE建立之初恰逢循证医学和循证卫生决策早期兴起,NHS本身面临着改革和转型要求,希望通过NICE来开展医疗技术临床使用效果和成本效果,避免医疗资源浪费,并开发循证临床指南,支持NHS机构和临床人员规范行为并合理决策。建立初期,NICE着力理顺与其他相关机构的关系,包括行业学会协会、质量管理机构等,以新药评估为切入探索卫生技术评估工作,同时开发重大疾病临床指南并支持临床应用,逐步探索建立规范的评估流程、机制和方法。2004年,英国卫生部门立法规定,NHS需在3个月内为NICE推荐药物或治疗技术提供资金或资源,认定了NICE评估结果对医疗资源配置和筹资决策的直接影响,驱动临床推广应用有关指南和证据。同时,所有NICE指南会在1-3年内重新评审,不断更新证据基础以支持循证卫生决策理念的贯彻实施。NICE不仅将药品评价扩大到医疗器械和公共卫生干预评价,还独创了多技术评估(multiple technology assessment, MTA)和单一技术评估(single technology assessment, STA)流程,前者是对单一或多种药物、技术应用于多种适应症的评估,后者则是对单一药物、技术应用于单一适应症的评估。给部分国家设计HTA机制流程提供了可行模式。不少亚欧国家甚至直接引用NICE发布临床指南,规范本地临床行为,强化医疗服务质量问责。通过20年稳步发展,NICE以其透明可信的HTA流程、科学循证的临床指南和立法保障下的直接政策转化能力,成为全球HTA机构的典范。
第二阶段:全面发展阶段(2010-2020年)。 2010年NICE发布了新战略,按照英国NHS要求,参与医疗服务质量安全管理和NHS购买支付政策制定工作,推动评估和指南开发工作扩大循证决策应用场景。这个阶段正是全民健康覆盖(universal health coverage, UHC)在全球推动实施的高潮期,WHO大力推动HTA发展和应用以支持UHC的实现。NICE建立了全球发展部,将其模式和经验向全球传播,我国卫生智库国家卫生健康委卫生发展研究中心2009年起与NICE开展合作,学习NICE模式经验,组织高层决策者和学者参与多轮HTA研修班和培训交流,并参考其指南开发经验,开展临床路径及支付方式改革试点合作。此阶段,NICE进入全面发展阶段,从隶属于部门的行业技术机构,提升到直接向政府汇报工作的公共机构。NICE逐步从第一阶段专注于证据生产集合的功能,扩大到支持决策者、医患和社会公众科学决策阶段。它不仅负责制定全科医生质量框架帮助决策者开展社区医疗质量优化管理,还在线提供科学证据供医患临床决策使用。顺应健康融入所有社会政策趋势,按照2012年英国卫生立法要求,NICE增加了社会照护服务评估和指南开发职责。在全面发展阶段,NICE人员建制逐步完善发展,随着职责增加其运行经费也不断扩大,达到每年6-8千万英镑,直接由英国卫生部从年度财政预算中拨付。随着英国经济下行预算紧张,2019年起, NICE根据卫生部门法规修订结果开始向企业收取评估费用,调整了工作经费的筹资来源。管理机制不断完善的同时,NICE逐步细化评估标准和路径,结合实际需求不断优化评估机制和方法。NICE对证据分析方法进行了调整,并允许独立专家委员会在证据难以获取情况下做出灵活决策,并于2017年建立了6个月完成的快速技术评估(fast technology assessment, FTA)。较之前7-9个月的STA和14个月的MTA,FTA较大程度上提升了评估工作的效率。在成本效果价值判断时,NICE增加了对重症、罕见病、终末期救治等特殊考量权重,并对成本效果阈值进一步做出分层调整。最重要的变化是,NICE不断融合发展药械和干预技术等流程和方法,希望建立适用性更佳、更严谨的通用路径和标准方法[4-5]。
第三阶段:转型变革阶段(2021-2026年)。 新冠肺炎疫情给全球带来深远影响,英国NICE作为国际知名HTA机构,在英国疫情应对中发挥中坚作用,开展20余项新冠肺炎诊治或常规患者疫情下救治的快速评估[6],发布10余条临床诊治建议,并无偿为医药企业提供新冠肺炎防治产品的创新研发建议,支持政府、医疗机构、企业等各方基于科学证据及时做出疫情应对决策。2021年恰逢NICE发布其五年规划,提出机构转型的建议,将从4个方面开展重点改革,即:开展快速、严谨、针对性技术评估;提供动态调整完善的指南和临床诊治指导;协同利益相关方应用评估证据和决策指导意见,以改善群体健康和消除不公平性的作用;成为数据、科研和学术领域的领军机构,应用真实世界数据支持患者快速获得适宜的卫生健康创新产品。
2 NICE评估模式及特点
英国NICE是政府建立HTA机构,具有开展证据综合评估和临床质量安全规范研究的法定职责,其评估结果依法支持NHS资源配置和经费使用决策。与英国国家医学研究院(National Institute of Health Research, NIHR)设立的HTA研究项目不同[7],NICE注重评估程序的规范合法性、评估证据的科学系统性、评估结果的政策转化及影响。
2.1 方法介绍
NICE技术评估一般采取三种方式进行评估,即MTA,STA和FTA。NICE自1999年建立到2005年,一直采用的是MTA方法。2005年根据国会提议,NICE建立了更简便、快捷的STA,便于患者及时获得所需的药品,该评估方法要求医药生产企业或上市持有人提供评估所需证据,比MTA流程可节约半年左右的时间。2017年NICE建立了FTA流程,主要针对那些成本较低或近似情况下可提供相同或更佳健康收益的技术,旨在方便患者及时获得成本效果更好的新治疗技术。3类评估方法主要特点和差异分析见表1。
3类评估的主要差异包括时间、内容、证据来源和使用范围[8]。MTA需要14个月时间,STA则需要7-9个月的时间,FTA仅需要6个月。标准评估流程(即单一技术评估或多技术评估)和快速评估流程使用前提不同,后者强调针对已有现行技术与待评估技术的成本比较或增量成本效果比(incremental cost-effectiveness ratio, ICER),前者则强调对单独或多项待评估未经实施的技术成本效用比较。标准评估流程(单一技术评估或多技术评估)往往根据相关决定因素包括技术的临床路径的复杂程度和实证是否掌握在企业手里等。临床路径较复杂的技术一般会选择进行MTA,企业掌握证据的技术选择STA。重大疾病新药(如癌症药物)的评估普遍采取STA。因此,两类评估除了评估时间的差别,最大的差别则是证据来源的不同。STA主要依赖医药企业提交证据,而MTA需要NICE顾问负责汇总和提交全部的证据。
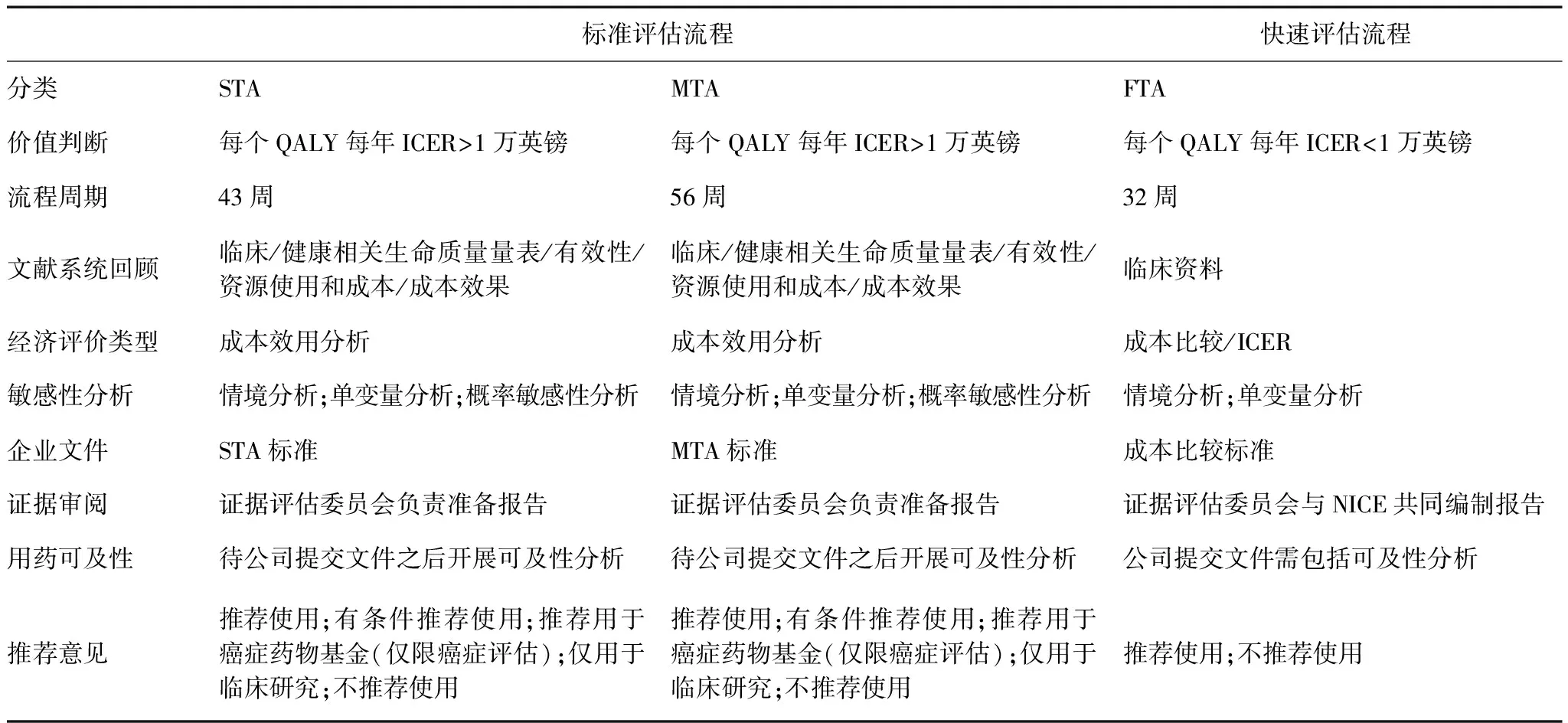
表1 NICE的3类评估方式比较分析
2.2 基本流程
3类评估执行均要求按照主题遴选、范围探查、实证评估、结果形成等基本流程。见图2-图4。
2.2.1 主题遴选。2019年卫生与社会福利部要求NICE对全部进入英国市场的新药或申报新适应症的药物开展评估,对于非药物主题(医疗器械、诊断技术、临床操作技术、组合技术等),NICE与其他机构或临床专家、患者组织、医药行业机构等合作,通过主题遴选方式确定评估对象。根据2022年1月公布的最新选题指南,NICE的评估主题可通过多个来源形成,包括国家医学研究院(National Institute for Health Research, NIHR)医学创新观察组织负责的查新机制,英国制药企业行业组织(UK PharmaScan,HealthTech Connect)递交的探查信息,通过NHS定点医疗机构、医务人员或企业等在NICE网页主动申报的新临床操作的开展信息,医务人员或公众直接向NICE主题遴选小组邮箱递送的信息,及NICE从NHS英格兰或质量管理机构及医学研究联盟等机构获得信息等。一旦NICE认为某个主题适合进入主题遴选程序,即启动评估范围探查工作。
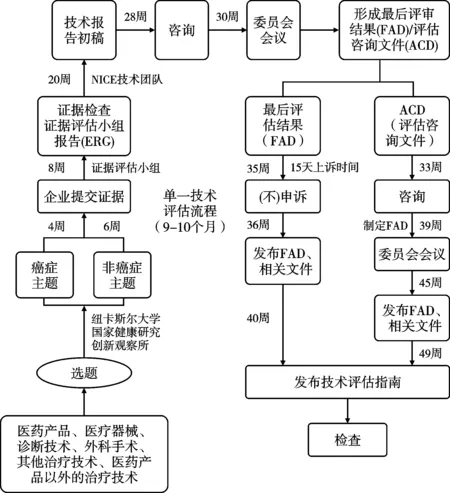
图2 单一技术评估(STA)流程
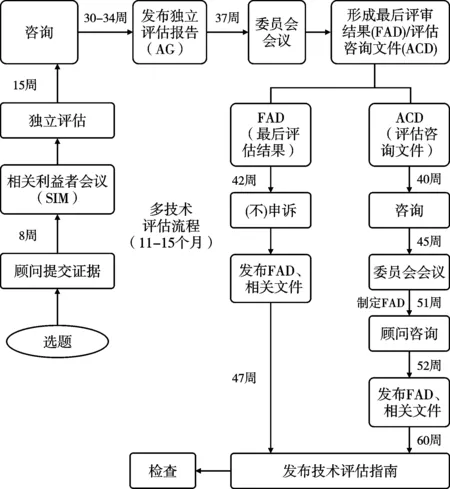
图3 多技术评估(MTA)流程
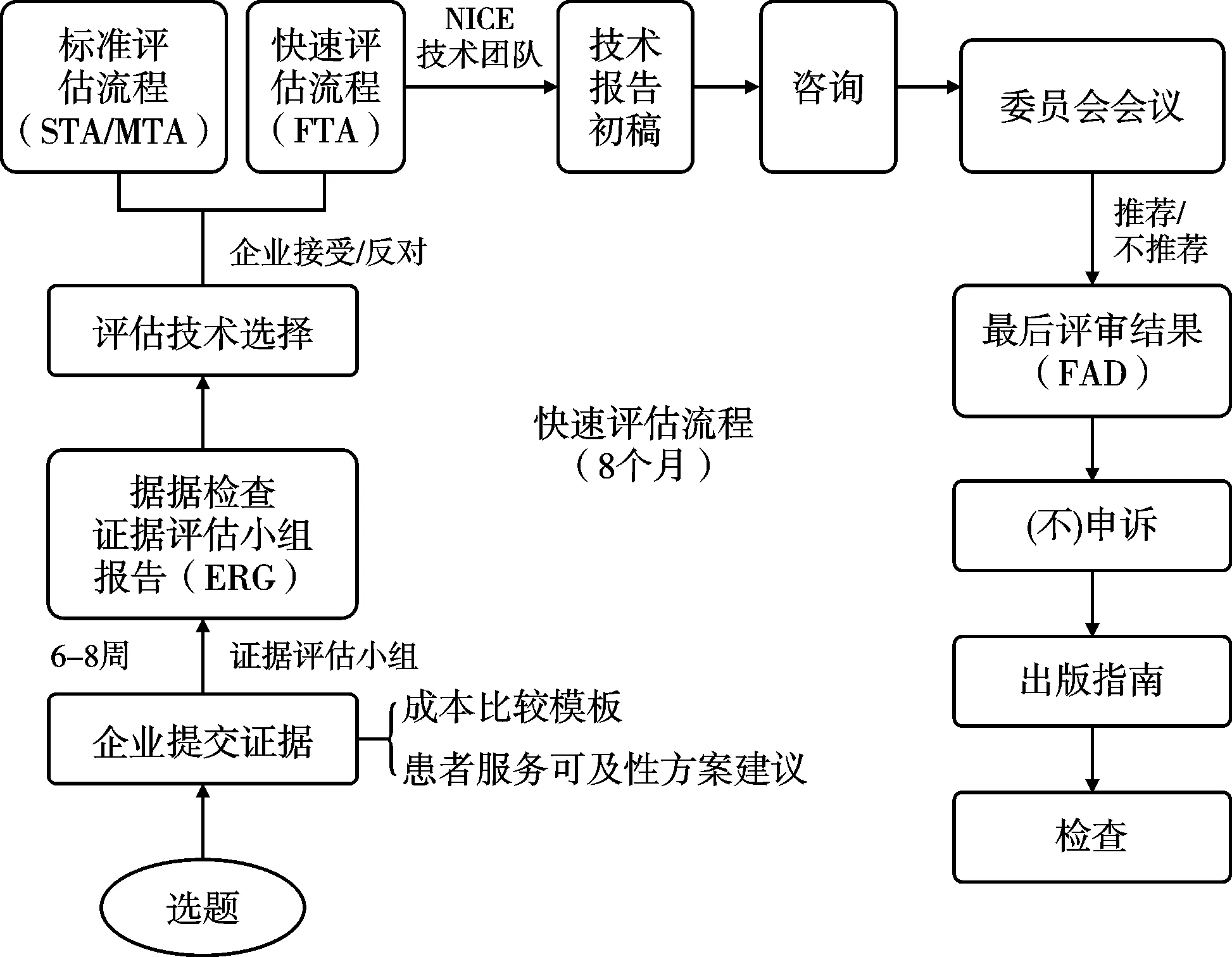
图4 快速技术评估(FTA)流程
2.2.2 范围探查。范围探查是评估过程极其重要的环节,旨在通过范围综述明确评估问题,设定评估内容和证据分析范围,为评估过程提供指导框架。范围探查步骤根据是否为癌症药品主题而略有不同,均产出选题报告(briefing),一般由评估委员会委托2-3名专家撰写,报告包括的常规内容有:临床技术的背景介绍(流行病学情况和替代治疗方法)、技术的使用细则、适用人群、对照技术或药品的描述、证据基础分析、临床结果测量指标、成本测算(包括NHS资源耗费和节约情况)、技术比较的时间范围,及其他一些信息,例如NICE的其他指南、相关政策制定情况和公平性影响等。NICE组织选题专家根据主题证据缺口、评估潜在影响、证据数据可得性等,判断某个主题是否最终纳入评估范畴[9]。NICE还会单独就提议开展快速评估的技术主题咨询有关专家。所有选题报告经卫生部和NHS代表等利益相关者论证后形成正式的主题报告。
2.2.3 证据评估。证据评估是系统分析相关证据的过程,包括临床证据评估和经济性评估两个相互关联的评估内容。2018年起,NHS要求NICE在经济性评估补充纳入有关患者服务可及性分析的内容,以综合考虑技术对患者的远期价值。证据评估要求产出1份评估报告,对证据质量、现状和意义进行客观评价,需指出证据是否存在不足或不确定性。证据评估由NICE指定独立的证据评估委员会负责。评估小组负责对MTA主题开展独立研究,收集有关证据,进行临床证据评估和经济性评估;STA的证据则由生产企业或技术研发者递交,之后由评估组进行评估。当证据不充分或不确定时,评估团队通过开展敏感度分析找出成本效果结果的不确定因素,并向NICE提出要求企业或研发者提供更多信息的建议。对于FTA,评估团队一般会进行干预和对照技术的成本比较或ICER分析。
证据选择是NICE在证据评估环节最关注的内容。NICE独立的证据评估委员会要求证据评估小组尽力完善证据检索范围,全面均衡地选择优质研究证据作为评估的基础。对于临床效果证据,首选随机对照试验(randomized controlled trial,RCT)等高质量研究以获取生命质量和死亡率等证据,在RCT研究证据缺失情况下,可选取偏倚较小的实验研究和观察性研究数据等非RCT研究及高质量系统文献综述证据作为替代。临床效果评估需要基于多来源证据进行综合评估,最终产出一份系统文献综述。成本效果证据可来源于RCT研究或其他研究的证据,同时要求NICE测算技术临床使用成本费用(即NHS经费使用分析)。成本效果证据评估结果也会形成一份系统文献综述。NICE近年来不断扩展对综合证据分析的维度,除了临床效果和成本效果证据,还要求通过文献综述、患者调查、社会价值讨论等途径收集技术的可接受度、适宜性、患者倾向性、服务提供可行性和健康公平性、技术长期体系价值等维度证据。
证据提供者多元化是NICE评估的一个鲜明特点。证据提供者主要有:证据评估小组(独立的学术中心)、医药产品生产企业或上市持有人、全国性患者组织、医务人员、临床专家和患者代表。主要的证据体仍由证据评估小组和医药企业提供,前者负责搜集整理文献形成二次研究证据,后者则负责提供企业开展的临床试验证据或企业掌握的临床效果和成本效果证据,并按照NICE要求格式汇总递交。证据综合分析结果最终以报告文本格式呈递。报告内容除上述临床效果、成本效果、可及性等,还应包括NHS潜在影响分析,即技术由NHS付费对人群健康、卫生资源的影响。
2.2.4 结果形成。收集专家顾问、临床人员和患者代表等相关各方意见后,评估小组会形成一份评估结果分析报告。由评估委员会组织专家和医患代表参与的会议进行评估结果报告的论证,通过表决形成最终建议,递交NICE,由NICE主席和各部门主管组成的管理团队(executive team)正式签发评估结果。评估委员会的最终推荐建议一般分为3类:推荐NHS应用;不推荐;有条件推荐NHS应用。有条件推荐时,评估委员会可进一步提出推荐的具体条件,例如还需要进一步收集RCT研究实证等。评估委员会在确定推荐建议时,不仅基于证据的可靠性和均衡性,还会考虑社会价值和人权因素,及证据不确定性等因素。在正式发布评估结果前,一般NICE会在线发布评估报告初稿,广泛征求全社会意见。质询期间(一般为报告公布15天内),企业或其他相关利益方可对指南初稿提出质疑和反驳(即“申诉”),NICE上诉委员会将考察相关申诉,形成对申诉的反馈意见,如采纳即对指南进行相应的调整修订,最终形成全国发布的临床技术评估结果。
2.3 评估影响
到2021年12月,NICE已经批准公布了747个技术评估结果[10],NHS机构目前广泛参阅NICE进行技术相关购买、使用的决策,为控制医疗费用、规范技术使用提供了科学依据[11]。NICE评估结果还被全球很多国家直接参考引用,推动全球范围HTA助力全民健康覆盖的目标的实现。
首先,评估结果通过影响NHS经费预算,提高了重大疾病患者的救治服务的可及性。根据立法要求,NHS需为NICE推荐的技术提供预算支付,确保适宜NHS使用的医疗技术快速进入临床并为患者所用。例如,截至2021年12月,NICE发布364份肿瘤药物评估报告,含432条建议,其中77%建议是肯定的结果(包括推荐NHS使用、推荐NHS有条件使用、仅作为癌症药物基金资助应用3类)[12]。推荐使用的意见帮助许多癌症患者获得昂贵的新药治疗提供了资助,提高了患者对此类药物的可及性。
其次,评估结果规范了临床行为,提高了患者安全性和服务质量。NICE不仅产出证据评估结果,还同时负责产出临床诊治服务指南和质量安全指标,这样可将评估结果与临床诊治服务行为规范调整机制衔接起来,较好地确保了有关结果在临床的推广应用,并最终实现提质增效、保障患者安全的效果。例如,研究显示,NICE针对普通感染使用的抗菌药处方行为的临床指南,实施后使NHS医院急诊科总抗菌药使用率降低了7.5%[13],有效支持NHS的医院抗菌药管理体系的建立。再如,NICE脑外伤指南实施后,英国某三级医院急诊部脑部CT造影检测量显着降低,使用指南后的颅内病灶的诊断效果优于医生主观决策结果[14]。
另外,评估通过审慎分析新医药技术价值,识别并助力适宜性的创新技术产品快速进入临床,深刻影响了英国卫生科技创新导向。建立之初,医药企业视NICE为创新的阻碍者,因为其设定全社会卫生健康价值评估统一标准的做法,让一部分所谓的“创新技术产品”难以满足NHS的准入标准。近年来,在政府部门支持下,NICE调整策略,一方面与英国药监部门加强创新医药技术评估合作,另一方面与创新医药研发企业和上市代理机构合作,为监管者、卫生决策者、行业机构提供科学指导,支持其快速识别创新技术产品、推动上市并尽快为临床所用。NICE建立医疗创新技术简报(MedTech innovation briefing, MIB),基于3个月快速评估结果向NHS医院提供创新医疗器械、体外诊断、人工智能和数字医疗技术等决策依据。
3 对我国的启示和建议
在新冠肺炎疫情背景下,NICE积极谋求转型发展,适时调整策略和方法以迎合时代背景的需要,我们仍将持续关注其发展动向和模式变化,以更好地汲取经验,发展好我国HTA体系。基于前述NICE评估模式和典型做法分析,我们认为其为“十四五”背景下我国HTA体系建设发展可提供以下3点启示。
一是贯彻循证决策理念,基于HTA构建循证卫生决策路径和方法,支持卫生治理决策机制建设。英国NICE是英国政府落实循证卫生决策的重要载体机构,其开展的HTA明显有别于英国医学科学研究部门建立HTA科研课题,其以决策推荐和临床实践应用为目的开展证据评估,重视主题遴选公正性、评估程序合法性、专家评审充分性,HTA方法是证据集成的基础,但实际上是结合英国卫生部门和NHS决策者、临床专家、医患代表及企业等各方意见,构建多元主体参与、多维度证据支持的药械等适宜技术的科学决策体系和机制,推动临床安全、质量、效果、效益优化,实现以可持续的资源投入维持高质量卫生服务体系运转的政府卫生治理目标。我国在强化科学卫生治理过程中,需要建立类似NICE机构及评估体系,加强科学治理立法及政策保障,参考英国通过立法确定NICE临床指南对于医疗资源配置和筹资决策的影响,制定完善我国卫生治理相关法律法规体系,形成证据集成和决策转化应用的关键机制,为HTA作为卫生决策的核心工具提供支撑,支持循证决策在卫生领域的贯彻。
二是重视评估机制、流程和方法工具的调试和完善,以适应政治政策变化、经济社会发展和医改深化要求。NICE自建立之初仅关注药品评估,到目前将高值医用耗材、诊治技术、数字医疗技术等纳入评估范围,并关注公共卫生和社会照护服务评估,不断迎合医学技术创新进步要求,扩大评估主题领域;评估维度也从最初关注临床效果和成本效果证据,扩展纳入可及性、公平性、伦理性等维度,不断延展评估内容;评估流程和模式不断丰富,从MTA和STA,到6个月 FTA,再到目前3个月产出创新技术评估简报(MIB),NICE不断调整方法以适应政府、医药行业、医患对于加速评估和推动创新医药产品技术可及性的要求;评估产出从针对临床医患的技术评估报告和指南,扩展到针对支付方和管理者的质控标准和定价支付建议,再到针对创新研发企业的建议,不断丰富完善,形成以利益各方决策支持为导向的评估结果快速转化应用机制。我国20世纪90年代引入了卫生技术评估理念和方法,在国家卫生部门指导下,相关评估机构不懈努力,持续探索符合国内特色的卫生技术评估机制和方法。2018年国家卫生健康委卫生发展研究中心正式挂牌建立“国家药物和卫生技术综合评估中心”,标志着我国正式启动了卫生技术评估体系建设工作。
三是注重与其他行业组织和相关机构协作,善于利用行业学会协会、高校等科教研机构、医药企业的技术力量,开展证据评估和转化工作。NICE并非仅靠一己之力开展评估工作,其与医学会、高校和科研机构等通过外包委托课题方式建立证据储备研究的合作,大量聘用外部专家(包括专业人士、公民代表、患者代表等),承担评估委员会、选题专家组、公民代表委员会和外部评论员组等职责,同时不排斥在评估中运用企业提供的证据,给包括我国在内的评估机构维持运行和稳定发展提供了可参考的模式。我国卫生部门当前组织开展药品、医疗器械、基本公共卫生服务包遴选评估体系建设中,应积极借鉴英国NICE经验,在机制流程设计中关注主题信息及证据来源问题、组织管理流程、评估参与者的构成、各类专家具体职责和管理问题、企业证据提交和采信要求等关键内容,重点加强高质量证据信息集成分析体系和利益各方诉求意见科学采纳认定机制的建立完善。



