郭淑贞,啜文静,付帮泽,王 勇,冯玄超,廉洪建,李长虹,郑 磊,王 伟
证候是疾病特定阶段的病生理特征的综合反映。除了宏观四诊信息,证候在微观生物学指标层面必然也存在着特征性的变化。证候特征性生物学标志物的发现,有利于提升临床证候辨识的客观性与准确性。本文拟采用双向电泳等蛋白质组学研究手段,探讨冠心病(心肌缺血)气虚血瘀证特征性的血浆蛋白质谱,并分析其与证候表征的相关性,为后续的证候生物学标志物的临床研究奠定基础。
1 材料与方法
1.1 对象 采用课题组前期建立的方法,制备小型猪心肌缺血气虚血瘀证病证结合动物模型[1]。中华小型猪(中国农业大学小型猪养殖基地,体重25 kg±4 kg,月龄6~10个月)左冠脉前降支近端放置Ameroid缩窄环制备心肌缺血模型。在模型动物符合心肌缺血气虚血瘀证诊断的窗口(术后8周),采集舌象、心功能等指标并采集血浆样本用于后续实验。以同期的假手术动物作为对照。每组6只。
1.2 舌r、g、b分析 数码相机拍照记录动物舌象,以casmatch比色卡(BEAR Medic Corporation,日本)作为参照,采用photoshop软件分析舌RGB值,并计算r、g、b。
1.3 左室射血分数检测 心动超声(惠普Agilent SONOS 5500,美国)Simpson法检测左室射血分数(LVEF)。
1.4 血浆样本收集和制备 动物颈部前腔静脉采血3 m L,采用枸橼酸钠抗凝,并加入蛋白酶抑制剂(Roche),4℃,3 500转/分,离心25 min,收集上清,分装后-80℃保存。
1.5 双向凝胶电泳 样品冰上解冻后,4℃、12 000 g,离心5 min,取上清。Bradford法测定血浆蛋白质含量后,取1.3 mg上样,补加重胀液至450μL。平衡后的胶条转入提前制好的厚度为1.0 mm、13%的SDS-PAGE胶中,采用ETTAN Dalt Six电泳系统进行第二向分离。确定胶条与二相胶面接触良好,0.5%琼脂糖封胶。凝胶通过UMAX 2100XL扫描,胶图数据存储后,采用Imagemaster 2D Platinum 6.0软件进行凝胶的蛋白点检测及匹配,配合三维图像、Histogram及人工校对等方法,以实验组与对照组的vol%的比值>2或<0.5作为可能的差异蛋白点,纳入后续的分析。
1.6 差异蛋白斑点的鉴定 采用激光解吸附-时间飞行质谱(Bruker Ultraflex质谱仪,北京华大蛋白质组学研究中心检测)进行分析。质谱获得的单肽质量通过检索软件Mascot在NCBI蛋白质数据库中进行检索,选择种属为猪。搜索得到的结果如果在绿色阴影区域以外则表示结果基本可信。
2 结 果
2.1 血浆样本双向凝胶电泳 蛋白点的总体分布显示了高度的相似性,共813个匹配的蛋白点群被纳入分析。vol%<0.5的蛋白点表达下调,共确定了18种表达下调的差异蛋白点(见表1)。实验组与对照组的vol%的比值>2的蛋白点被认为表达上调,共确定了6种(见表2)。
2.2 质谱鉴定结果 由于猪的蛋白质表达谱研究远远少于小鼠等模式生物,只有2个蛋白得到了阳性检索结果,分别为动力蛋白重链6(Spot11)和视黄醇结合蛋白4(Spot17)。详见表3。
2.3 左室射血分数、舌象rgb与差异蛋白表达丰度的相关性(见表4、表5)
表1 心肌缺血气虚血瘀证表达下调的差异蛋白点(±s )
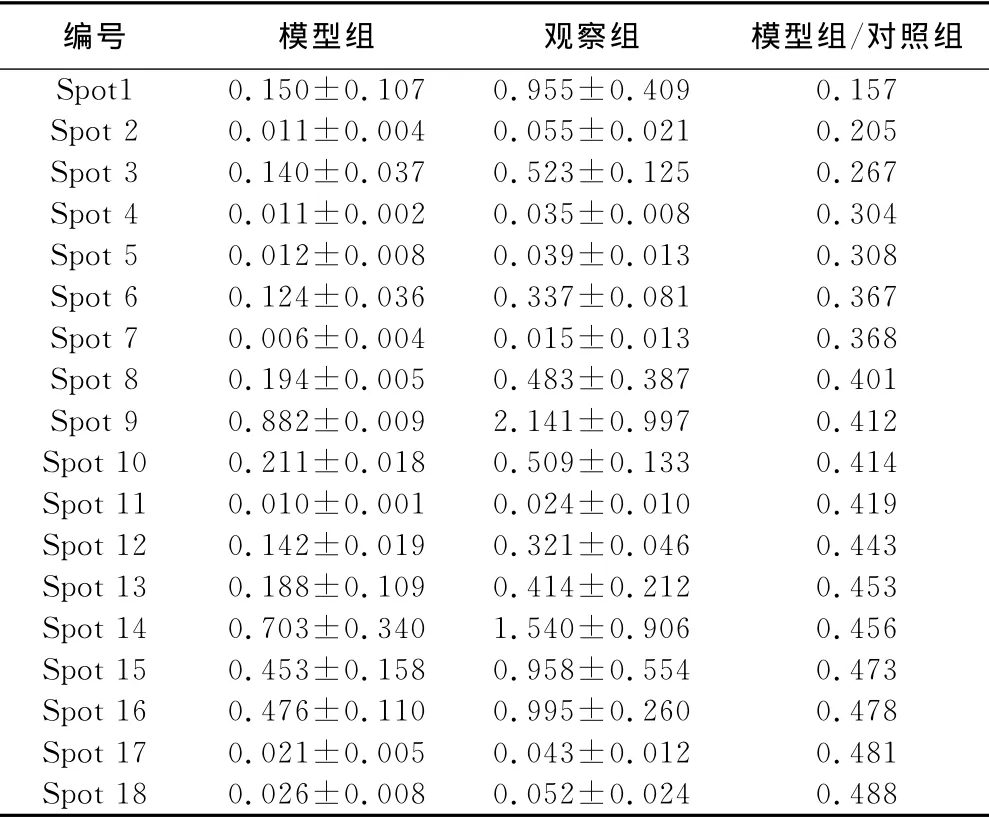
表1 心肌缺血气虚血瘀证表达下调的差异蛋白点(±s )
编号 模型组 观察组 模型组/对照组Spot1 0.150±0.107 0.955±0.409 0.157 Spot 2 0.011±0.004 0.055±0.021 0.205 Spot 3 0.140±0.037 0.523±0.125 0.267 Spot 4 0.011±0.002 0.035±0.008 0.304 Spot 5 0.012±0.008 0.039±0.013 0.308 Spot 6 0.124±0.036 0.337±0.081 0.367 Spot 7 0.006±0.004 0.015±0.013 0.368 Spot 8 0.194±0.005 0.483±0.387 0.401 Spot 9 0.882±0.009 2.141±0.997 0.412 Spot 10 0.211±0.018 0.509±0.133 0.414 Spot 11 0.010±0.001 0.024±0.010 0.419 Spot 12 0.142±0.019 0.321±0.046 0.443 Spot 13 0.188±0.109 0.414±0.212 0.453 Spot 14 0.703±0.340 1.540±0.906 0.456 Spot 15 0.453±0.158 0.958±0.554 0.473 Spot 16 0.476±0.110 0.995±0.260 0.478 Spot 17 0.021±0.005 0.043±0.012 0.481 Spot 18 0.026±0.008 0.052±0.024 0.488
表2 心肌缺血气虚血瘀证表达上调的差异蛋白点(±s)
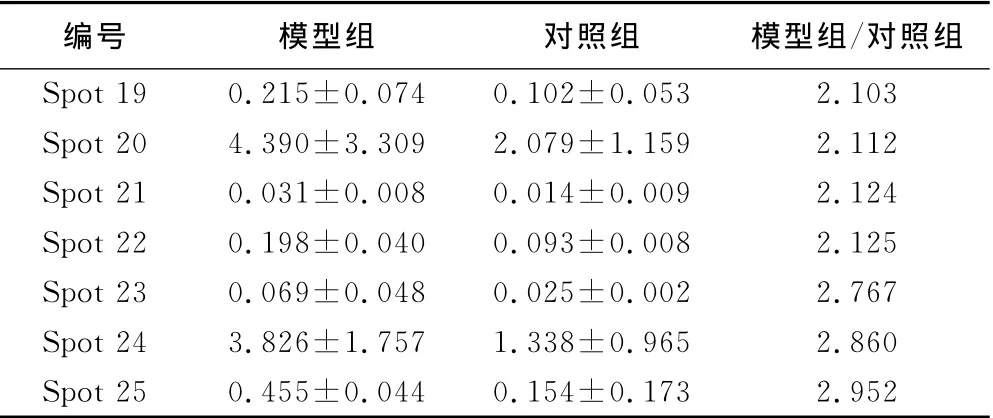
表2 心肌缺血气虚血瘀证表达上调的差异蛋白点(±s)
编号 模型组 对照组 模型组/对照组Spot 19 0.215±0.074 0.102±0.053 2.103 Spot 20 4.390±3.309 2.079±1.159 2.112 Spot 21 0.031±0.008 0.014±0.009 2.124 Spot 22 0.198±0.040 0.093±0.008 2.125 Spot 23 0.069±0.048 0.025±0.002 2.767 Spot 24 3.826±1.757 1.338±0.965 2.860 Spot 25 0.455±0.044 0.154±0.173 2.952

表3 部分差异蛋白点的质谱鉴定结果
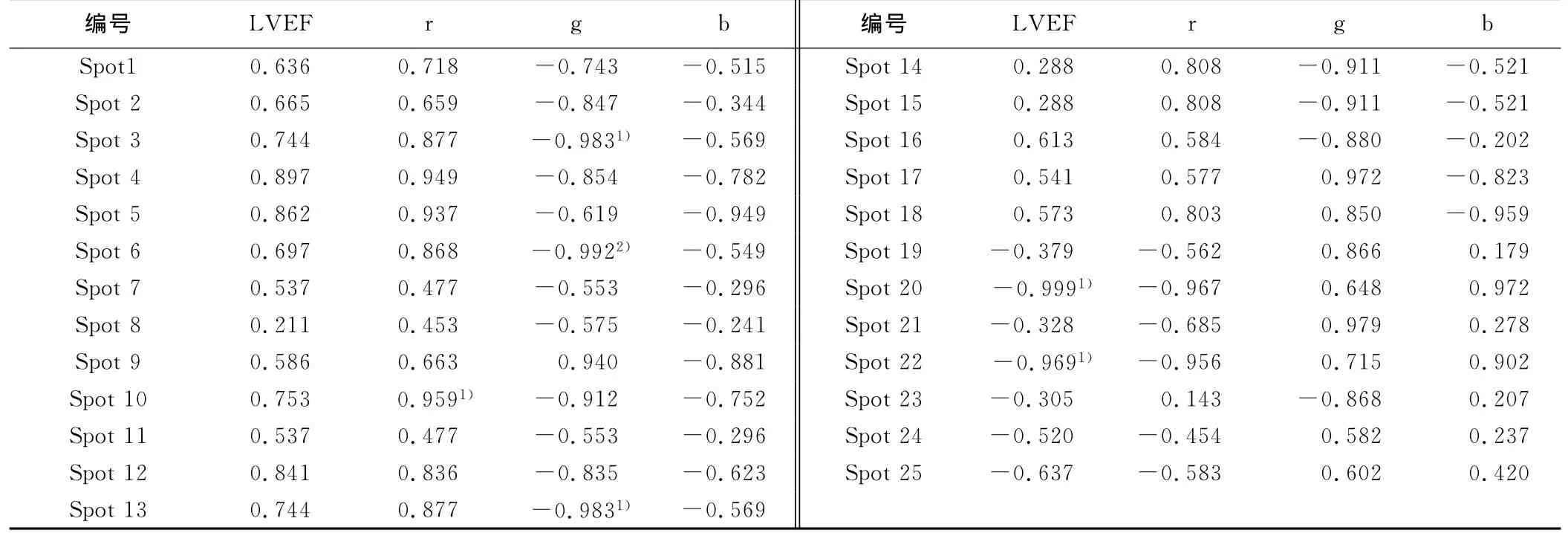
表4 LVEF、舌rgb与蛋白表达丰度的相关性
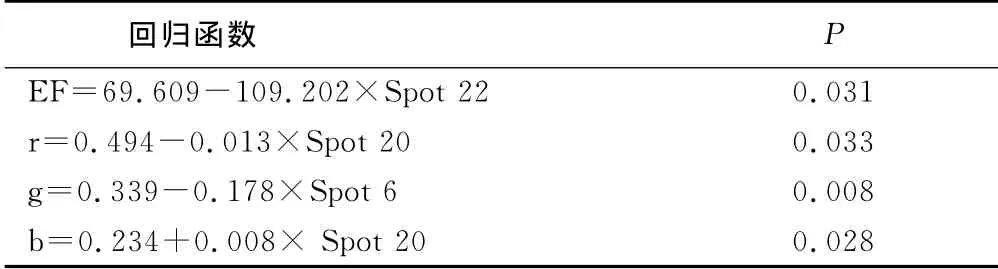
表5 LVEF、舌rgb与差异蛋白表达丰度的线性回归分析
3 讨 论
本研究采用双向凝胶电泳的方法分析了心肌缺血气虚血瘀证小型猪血浆蛋白质表达谱,发现了18个下调蛋白点和6个上调蛋白点。这些差异蛋白点均有可能成为心肌缺血气虚血瘀证特征性的生物学标志物,但必须通过多种检测方法、大样本的严格验证与分析。鉴于蛋白质组学属于开放性研究系统,突破了既往从已知的疾病相关的文献资料中筛选可能的证候生物学标志物的局限,有可能发现新的、在相应疾病的研究中尚无报道的证候特征性标志物,这不仅有可能成为证候的诊断指征,而且有可能为证候的生物学基础研究提示重要线索,还有望为疾病的发病机制阐明提示新的环节。质谱鉴定结果提示,在心肌缺血气虚血瘀证显着下调的蛋白包括动力蛋白重链6和视黄醇结合蛋白4。
基因本体论分类中,动力蛋白最主要的生物进程为ATP的分解代谢。动力蛋白在体内的作用主要包括具有ATP酶活性,可作为呼吸道纤毛运动的动力来源、微管运动的动力来源,并参与了神经细胞的体积、心脏钾通道[2]等的调控。动力蛋白作为微管的重要组成部分还参与了心肌对机械刺激的反应性调控[3]。
视黄醇结合蛋白4主要参与视黄醛的结合与转运。在基因本体论分类中,视黄醇结合蛋白4的功能涉及多个生物学进程,其中主要包括心肌组织发育、心肌细胞增殖的负调控、葡萄糖稳态调节等。既往的研究多显示视黄醇结合蛋白4与脂代谢[4]、颈动脉粥样硬化[5]、冠心病合并高胰岛素血症等相关[6],血浆视黄醇结合蛋白4的水平在冠心病组并没有升高[6],而新近的女性人群研究则发现,全长的视黄醇结合蛋白4以及总视黄醇结合蛋白4呈时间依赖模式与冠心病的发病相关[7]。
目前的研究表明,动力蛋白、视黄醇结合蛋白4均在能量代谢方面具有一定的作用,但并未见到上述蛋白与证候相关的研究报道。心肌缺血气虚血瘀证动物外周血中动力蛋白、视黄醇结合蛋白4下调可能与其心肌能量代谢降低有关,其机制有待进一步深入研究。左室射血分数反映了心功能的变化,也被作为心肌缺血气虚证评价的主要指征之一[8]。本研究提示,左室射血分数与差异蛋白Spot 22呈线性相关,差异蛋白Spot 22可能成为左室射血分数用于气虚证评价时的替代指征。
血瘀证诊断中,舌质紫暗或舌体瘀斑、瘀点,舌下静脉曲血是主要依据之一。本研究建立了rgb值定量分析小型猪舌色变化的方法[9]。本研究提示,Spot20、Spot 6、Spot 20分别与舌r、g、b值呈线性相关。尽管小型猪是心血管疾病最佳的动物模型,本研究也发现了一些与心肌缺血气虚血瘀证及其宏观表征相关的血浆蛋白。但是关于小型猪的基因背景的研究远不及小鼠等模式生物完善,其基因、蛋白数据库的不完整,导致多数的差异蛋白未能获得阳性的鉴定结果,大大限制了其后续的研究与应用。本研究后续还需要进一步采用其他方法进行多维度的分析与验证,上述候选的证候或宏观表征特征性的血浆蛋白才可能真正应用于临床患者与实验动物的证候辨识。
[1] 王勇,李春,啜文静,等.基于小型猪冠心病慢性心肌缺血模型气虚血瘀证的证候评价[J].中国中西医结合杂志,2011,31(2):233-237.
[2] Loewen ME,Wang Z,Eldstrom J,et al.Shared requirement for dynein function and intact microtubule cytoskeleton for normal surface expression of cardiac potassium channels[J].Am J Physiology,Heart Circ Physiol 2009,296(1):H71-83.
[3] White E.Mechanical modulation of cardiac microtubules[J].Pflugers Archi,2011,462(1):177-184.
[4] Von Eynatten M,Lepper PM,Liu D,et al.Retinol-binding protein 4 is associated with components of the metabolic syndrome,but not with insulin resistance,in men with type 2 diabetes or coronary artery disease[J].Diabetologia,2007,50(9):1930-1937.
[5] 李红丽.血清视黄醇结合蛋白4对冠心病患者颈动脉粥样硬化的影响[J].中国当代医药,2013,20(14):68-69.
[6] 李非,杨天伦,赵震宇,等.冠心病患者血浆视黄醇结合蛋白4水平变化及高胰岛素血症对其的影响[J].中南大学学报(医学版),2012,37(11):1177-1182.
[7] Sun Q,Kiernan UA,Shi L,et al.Plasma retinol-binding protein 4(RBP4)levels and risk of coronary heart disease:a prospective analysis among women in the nurses’health study[J].Circulation,2013,127(19):1938-1947.
[8] 刘蕾,王伟,郭淑贞,等.小型猪慢性心肌缺血模型四诊信息采集的方法探索[J].中华中医药学刊,2008,26(7):1438-1440.
[9] 仇琪,郭淑贞,陈建新,等.基于Shannon熵互信息的冠心病证候相关理化指标文献研究[J].中华中医药杂志,2009,24(10):1284-1287.



