杨琴波,崔金刚,王培伟,丁李立强,陈 瑜,张 腾
·基础医学论着/研究·
三七总皂苷防治异丙肾上腺素诱导的心肌损伤实验研究
杨琴波1,2,崔金刚1,2,王培伟1,2,丁李立强1,陈 瑜1,2,张 腾1,2
目的观察三七总皂苷(PNS)对异丙肾上腺素(ISO)诱导的心肌损伤的疗效,并探索三七总皂苷防治心肌损伤潜在的作用机制,为三七总皂苷防治心肌损伤的临床应用提供实验依据。方法将实验小鼠分为3组:正常对照组、ISO模型组、PNS治疗组。ISO造模7 d后,取心脏组织进行HE染色和Masson三色染色评估PNS对ISO诱导的心肌损伤的防治作用。进一步对心肌组织行RT-PCR检测miR-1和miR-222表达,通过免疫组化方法检测MET蛋白在心肌组织的表达。结果心脏病理染色显示,ISO诱导的心肌损伤模型组心肌细胞坏死、大量炎性细胞浸润、胶原纤维增多。而PNS治疗组心脏仅有少量,偶见的炎性细胞,胶原纤维阳性率较ISO模型组显着降低。在ISO模型组心脏中miR-1表达较正常对照组显着降低,miR-222表达显着升高。经PNS治疗后,与ISO模型组相比miR-1表达显着增高;而miR-222表达显着降低。免疫组化表明,MET在模型组心脏中表达显着升高且主要集中在损伤部位,而在PNS治疗组中显着降低。结论PNS对ISO诱导的心肌损伤具有明显防治作用,miR-1/MET/miR-222信号通路可能参与ISO诱导心肌损伤的形成及PNS抗心肌损伤。
心肌损伤;三七总皂苷;微小核苷酸;异丙肾上腺素
心血管疾病已成为威胁人类健康的头号杀手。最新统计表明,心血管病死亡占我国城乡居民总死亡原因首位,农村为44.6%,城市为42.51%[1]。心血管疾病负担日渐加重,已成为重大的公共卫生问题,因此对心血管疾病研究已成为目前全世界重点。心血管疾病作为高发慢性病,其发生与多种因素相关,包括:吸烟、高血压、肥胖、高血脂、糖尿病、情绪问题等。有研究表明,各类心血管疾病如心肌缺血,心肌梗死,心肌肥厚等引起心肌细胞坏死或凋亡、炎症细胞浸润、细胞外基质蛋白或胶原纤维增多、细胞排列紊乱等病理特征[2]。目前西医对心血管疾病治疗有手术治疗和药物治疗,药物治疗多以病因为主,分为硝酸酯类、他汀类降血脂药、抗血小板制剂、β-受体阻滞剂、钙通道阻滞剂等。中医将心血管疾病归为“胸痹”“心痛”等疾病范畴,主要有治则:行气活血、芳香温通、活血化瘀、益气活血、宜痹通阳、通阳化痰和补肾健脾[3],其中活血化瘀方药运用广泛,有较好疗效。
三七为五加科植物三七Panax notoginseng (Burk)F.H.Chen的干燥根和根茎,是一类常用的中药材,主要功效为:活血祛瘀,止血,消肿止痛。《本草纲目拾遗》中记载:“人参补气第一,三七补血第一”,并有“止血不留瘀,行血不伤新”的作用。通过统计600首治疗冠心病方剂中药使用频率,发现三七使用139次,说明三七在临床上广泛应用于心血管疾病的治疗[4]。三七总皂苷(panax notoginseng saponins,PNS)为三七的主要有效活性成分,有研究表明其具有抗血小板聚集、抗氧化、抗炎等药理作用[5],但其防治心血管疾病的作用机制还需进一步研究。
微小RNA(microRNA,miRNA)是一类长度约18个~24个核苷酸,内源性的非编码单链RNA。miRNA通过与靶基因mRNA 3’UTR区域结合从而抑制靶基因的表达,达到负向调控基因表达目的,通过这种方式miRNA调控人类基因组约1/3基因。miRNA表达受相关基因调控,因此生长、发育、疾病发生等过程中miRNA-mRNA网络式互作起重要作用。有研究表明,多个miRNA在心血管疾病发病过程中起重要作用,如血管重构、炎症反应、细胞增殖和迁移等[6-8]。那么miRNA是否参与PNS防治心血管疾病过程呢?
异丙肾上腺素(isoproterenol,ISO)为β受体激动剂,临床上主要治疗支气管哮喘、心脏骤停、房室传导阻滞和抗休克等,过量使用时,由于心肌收缩力和耗氧量增加,引起心律失常、心肌缺血坏死等,因此实验室常用异丙肾上腺素诱导心肌损伤动物模型[9]。本研究使用异丙肾上腺素诱导小鼠心肌损伤模型,并行PNS治疗。经心脏HE染色和Masson三色染色评估ISO是否诱导造模成功及PNS对ISO诱导心肌损伤的疗效;进一步通过检测心肌组织中miRNA表达和组织免疫组化探讨PNS在防治ISO诱导心肌损伤中潜在的作用机制。
1 材料与方法
1.1 实验动物 4周龄清洁级雄性C56BL/6小鼠购置于上海斯莱克实验动物有限公司,饲养于上海中医药大学附属岳阳中西医结合医院动物实验中心[合格证:SYXK(沪)2006-0001,No.0069937]。饲养观察室温度:25 ℃±2 ℃,相对湿度:40%~50%,给予标准光照周期(12 h光照/12 h黑夜)。
1.2 试剂与仪器 PNS(纯度≥98%)购于上海泛亚生物医药集团; ISO(纯度≥99%)购于东京化成工业株式会社(TCI);石蜡包埋组织miRNA抽提试剂盒购于Thermo Fisher;miR-222和miR-1引物订购于上海生工技术有限公司。兔抗鼠MET抗体购于Santa Cruz,羊抗兔二抗购于武汉三鹰。HE染色、Masson三色染色和免疫组化的组织切片使用莱卡DM2000(LEICA)观察拍照,实时荧光定量PCR在罗氏480(Roche 480II)上进行。
1.3 实验方法
1.3.1 实验动物分组及造模 4周龄雄性C56BL/6小鼠饲养至平均体重20 g左右,按体重随机分为:①正常对照组(VC);②ISO模型组(Model);③PNS治疗组(PNS),每组6只。小鼠心肌损伤的造模方法:腹腔注射ISO 5 mg/kg体重,每日1次,连续7 d。模型组小鼠先腹腔注射100 μL PNS溶剂对照(PBS)30 min后,腹腔注射ISO 5 mg/(kg·50 μL),连续7 d。PNS治疗组小鼠腹腔注射PNS 150 mg/(kg·100 μL) 30 min后,腹腔注射ISO 5 mg/(kg·50 μL)。同时正常对照组小鼠每日平行注射PNS溶剂对照(100 μL,PBS)和ISO溶剂对照(50 μL,DMSO)。7 d后对实验小鼠进行解剖取材。
1.3.2 心脏组织HE染色和Masson三色染色 将剥离的心脏在4%多聚甲醛中固定,石蜡包埋。心脏组织从心尖部连续作横断面切片(厚度为4 μm),每个样品选取4张间隔相等的切片用于HE染色和Masson 三色染色。在光学显微镜下观察组织病理改变。
1.3.3 心脏miRNA抽取及表达检测 石蜡包埋心脏组织的miRNA使用Life Technology 公司的专用试剂盒(RecoverAllTMTotal Nucleic Acid Isolation Kit)抽取。从心脏石蜡块上连续切4个20 μm切片用于miRNA抽提,实验操作严格遵守试剂盒操作手册。抽提miRNA进行浓度测定后,使用miScript Reverse Transcription Kit (Qiagen)将其逆转录为cDNA用于实时荧光定量PCR。QuantiTect SYBR Green PCR Master Mix(Qiagen)、cDNA、通用引物和miRNA特异引物按照试剂说明书进行配制,之后在Roche 480II上完成数据采集和分析。U6B作为内参用于评估各组心肌组织中miR-1、miR-222的相对表达。实时荧光定量PCR实验中所有样本三个复孔同时进行扩增,且实验重复3次。miR-1特异引物为5’CCCCTGGAATGTAAAGAAGTATG3’;miR-222特异引物为5’AGCTACATCTGGCTACTGGGT3’;U6B特异引物为5’ACGCAAATTCGTGAAGCGTT3’。
1.3.4 心脏MET免疫组化 组织切片脱蜡至水,经过3%H2O2-甲醇溶液封闭15 min;0.01 mol/L柠檬酸缓冲液微波30 min抗原修复;10%兔血清2 h封闭非特异性抗原;之后MET抗体1∶50稀释,4 ℃过夜孵育;二抗1∶200稀释孵育30 min;HRP标记的链霉亲和素1∶200稀释孵育30 min;最后DAB显色5 min;苏木素复染5 min;脱水、透明、封片在光学显微镜下读片。
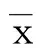
2 结 果
2.1 PNS显着减轻ISO诱导的心肌损伤 正常对照组心脏HE染色显示:心肌细胞排列规则,心肌结构完整;而ISO模型组左心室出现大面积心肌细胞坏死,坏死区域大量炎症细胞聚集,细胞排列杂乱;而PNS治疗组小鼠心脏HE染色显示左心室有少量、散在的心肌细胞坏死和炎症细胞聚集,其程度明显轻于ISO模型组(见图1)。因此小鼠心脏病理观察显示ISO成功地诱导小鼠心肌损伤,而PNS可有效地缓解ISO诱导的心肌损伤。

图1 小鼠心脏HE染色
2.2 PNS显着减少ISO诱导产生的胶原纤维 心脏组织Masson三色染色标记胶原纤维以评估心肌纤维化的程度。如图2所示,正常对照组仅在血管周围可见胶原纤维阳性染色;ISO模型组则在损伤区域可见大量胶原纤维阳性染色;PNS治疗组在损伤区域可见少量胶原纤维阳性染色,但显着少于ISO模型组。通过使用Image Pro对胶原纤维阳性染色进行定量分析,发现ISO模型组胶原纤维阳性率为(9.79±1.06)%,显着高于正常对照组(1.26±0.24)%(P=0.0054);而PNS治疗组胶原纤维阳性率为(3.32±0.68)%,与ISO模型组比较,差异有统计学意义(P=0.015 9)。因此,Masson三色染色表明ISO诱导的心肌损伤促进胶原纤维生成,而PNS能显着缓解ISO诱导产生的胶原纤维。

注:与正常对照组比较,*Plt;0.05;与模型组比较,#Plt;0.05。
2.3 心肌组织切片miR-1与miR-222表达的影响 RT-PCR结果表明,与正常对照组比较,ISO模型组心肌组织中miR-1表达显着降低(P=0.040 4);PNS治疗组心肌组织中miR-1表达较ISO模型组显着升高(P=0.002 6)(图3A)。如图3B所示miR-222的表达在ISO模型组中较正常对照显着升高(P=0.043 2),而PNS治疗组中miR-222的表达较ISO模型组显着降低(P=0.007 9)。详见图3。
注:与正常对照组比较,*Plt;0.05;与模型组比较,#Plt;0.05。
图3小鼠心脏中miR-1和miR-222的表达
2.4 小鼠心脏MET免疫组化表达 MET为miR-1的靶基因,受到miR-1负向调节,同时MET可激活miR-222表达。本研究对心肌组织MET免疫染色,MET免疫阳性主要集中在心肌损伤部位。通过定量心肌组织中MET免疫阳性率表明,ISO模型组MET免疫阳性率显着高于正常对照组(P=0.001);而PNS治疗组MET免疫阳性率比ISO模型组显着降低(P=0.001)。详见表4。

注:与正常对照组比较,*Plt;0.05;与模型组比较,#Plt;0.05。
图4小鼠心脏MET免疫组化
3 讨 论
PNS作为三七的主要活性成分,多项研究表明其对心肌损伤具有良好的治疗作用,且临床上有以PNS为主要成分的心血管药物,如血塞通。本课题组在肿瘤并发心肌损伤模型中证实PNS对心肌损伤的防治作用。本研究通过HE染色和Masson三色染色证明,PNS具有抗心肌损伤作用,这一结果与以往报道一致。miRNA在心血管病的发生、发展中具有重要意义,参与血管生成、血管内皮再生、平滑肌细胞和内皮细胞的增殖、迁移、凋亡;炎细胞浸润和激活等[10]。
miR-1与血管重构紧密相关,包括心脏发育、心律失常、缺血、心肌梗死和心肌肥大等[7]。有研究表明,miR-1在心脏发育过程中具有促进心肌细胞增殖和抑制凋亡作用[11],在心肌肥大和慢性心肌梗死中miR-1表达较正常降低。有研究认为,高表达的miR-1可能通过调控细胞骨架调节蛋白MYLK3、CALM1和CALM2抑制心肌肥大[12-14]。本研究发现miR-1在ISO诱导的心肌损伤小鼠心脏中表达显着降低,说明miR-1可能参与ISO诱导的心肌损伤。PNS治疗能显着提高miR-1表达,因此PNS可能通过调节miR-1的表达缓解ISO诱导的心肌损伤。
研究报道miR-222具有抗血管生成作用,主要表现为抑制血管内皮细胞迁移,损伤修复和微管形成[15]。内皮祖细胞(EPC)作为血管内皮细胞的前体细胞在血管损伤修复中有重要作用,研究表明在动脉粥样硬化病人中miR-221/222水平与EPC数量呈负相关[16]。miR-222具有促进血管平滑肌细胞的增殖和迁移作用[17]。本研究表明,miR-222在ISO诱导的心肌损伤小鼠心脏中表达升高,而PNS治疗显着降低miR-222在心脏中表达,因此miR-222可能在ISO诱导产生心肌损伤和PNS抗心肌损伤中有重要作用。文献报道miR-1通过负向调控MET表达,抑制肿瘤细胞的增殖和迁移[18]。而MET在肿瘤细胞中激活miR-222表达,促进细胞浸润和迁移[19]。既往研究表明PNS能显着抑制肿瘤组织和肿瘤细胞中MET表达,且miR-222表达在PNS治疗的肿瘤组织和细胞中显着低于对照组[20]。
本研究发现miR-1和miR-222在ISO诱导心肌损伤心脏中较正常对照组差异表达,进一步研究发现MET在心肌组织中表达基本集中在损伤区域,在ISO诱导心肌损伤模型中表达显着高于正常对照组,而PNS治疗显着降低MET在心肌组织中的表达。MET水平与miR-1表达呈负相关,与miR-222表达呈正相关。因此miR-1/MET/miR-222信号通路可能与PNS抗ISO诱导心肌损伤的分子机制有关。
[1] 陈伟伟,高润霖,刘力生,等.《中国心血管病报告2015》概要[J].中国循环杂志,2016,31(6):624-632.
[2] Matsui Y,Morimoto J,Uede T.Role of matricellular proteins in cardiac tissue remodeling after myocardial infarction[J].World Journal of Biological Chemistry,2010,1(5):69-80.
[3] 顾亦婷,顾海.从中西医结合角度看心血管疾病的治疗[J].中医药信息,2013,30(6):121-124.
[4] 黄素芳,侯如艳,高烁烁,等.治疗冠心病中药使用频率的研究分析[J].中药新药与临床药理杂志,2009,20(4):395-396.
[5] 朱会超,国晶晶,任煜.三七总皂苷药理研究进展[J].河南中医,2014,34(3):537-541.
[6] Staszel T,Zapala B,Polus A,et al.Role of microRNAs in endothelial cell pathophysiology[J].Polskie Archiwum Medycyny Wewnetrznej,2011,121(10):361-366.
[7] Fang YC,Yeh CH.Role of microRNAs in vascular remodeling[J].Current Molecular Medicine,2015,15(8):684-696.
[8] McManus DD,Freedman JE.MicroRNAs in platelet function and cardiovascular disease[J].Nature Reviews Cardiology,2015,12(12):711-717.
[9] Benjamin IJ,Jalil JE,Tan LB,et al.Isoproterenol-induced myocardial fibrosis in relation to myocyte necrosis[J].Circulation Research,1989,65(3):657-670.
[10] Qin S,Zhang C.MicroRNAs in vascular disease[J].Journal of Cardiovascular Pharmacology,2011,57(1):8-12.
[11] Liu L,Yuan Y,He X,et al.MicroRNA-1 upregulation promotes myocardiocyte proliferation and suppresses apoptosis during heart development[J].Molecular Medicine Reports,2017,15(5):2837-2842.
[12] Wu Y,Geng P,Wang YQ,et al.Effects of microRNA-1 on negatively regulating L-type calcium channel beta2 subunit gene expression during cardiac hypertrophy[J].Chinese Journal of Applied Physiology,2012,28(4):304-308.
[13] Li Q,Song XW,Zou J,et al.Attenuation of microRNA-1 derepresses the cytoskeleton regulatory protein twinfilin-1 to provoke cardiac hypertrophy[J].Journal of Cell Science,2010,123(Pt 14):2444-2452.
[14] Ikeda S,He A,Kong SW,et al.MicroRNA-1 negatively regulates expression of the hypertrophy-associated calmodulin and Mef2a genes[J].Molecular and Cellular Biology,2009,29(8):2193-2204.
[15] Poliseno L,Tuccoli A,Mariani L,et al.MicroRNAs modulate the angiogenic properties of HUVECs[J].Blood,2006,108(9):3068-3071.
[16] Minami Y,Satoh M,Maesawa C,et al.Effect of atorvastatin on microRNA 221/222 expression in endothelial progenitor cells obtained from patients with coronary artery disease[J].European Journal of Clinical Investigation,2009,39(5):359-367.
[17] Liu X,Cheng Y,Zhang S,et al.A necessary role of miR-221 and miR-222 in vascular smooth muscle cell proliferation and neointimal hyperplasia[J].Circulation Research,2009,104(4):476-487.
[18] Han C,Zhou Y,An Q,et al.MicroRNA-1 (miR-1) inhibits gastric cancer cell proliferation and migration by targeting MET[J].Tumour Biology,2015,36(9):6715-6723.
[19] Acunzo M,Visone R,Romano G,et al.MiR-130a targets MET and induces TRAIL-sensitivity in NSCLC by downregulating miR-221 and 222[J].Oncogene,2012,31(5):634-642.
[20] Yang Q,Wang P,Cui J,et al.Panax notoginseng saponins attenuate lung cancer growth in part through modulating the level of Met/miR-222 axis[J].Journal of Ethnopharmacology,2016,193:255-265.
2017-05-21)
(本文编辑 薛妮)
Experimental Study on Panax notoginseng Saponins Attenuates Isoproterenol-induced Myocardial Injury
Yang Qinbo, Cui Jingang, Wang Peiwei, Ding Liliqiang, Chen Yu, Zhang Teng
Yueyang Hospital of Integrated Traditional Chinese and Western Medicine, Shanghai University of Traditional Chinese Medicine, Shanghai 200437, China;Clinical Research Institute of Integrative Medicine,Shanghai Institute of Traditional Chinese Medicine, Shanghai, China
Chen Yu, Zhang Teng
Objective To investigate the effect of panax notoginseng saponins (PNS) on isoproterenal (ISO)-induced myocardial injury and explore the mechanism of PNS anti myocardial injury. Methods C57 mice were divided into vehicle control (VC) group, ISO induced myocardial injury (ISO) group,and PNS treatment (PNS) group.All mice were intraperitoneally injected vehicle control,ISO,ISO,and PNS separately for 7 days. Heart was utilized for HE stain and massion trichrome stain were performed in heart to access the therapeutic effect of PNS on ISO-induced myocardial injury.Further,real time-PCR was carried out to detect the expression of miR-1 and miR-222 in heart,and Met was probed in heart using immunohistochemical staining to discover the role of miR-1/MET/miR-222 in the anti-myocardial injury effect of PNS. Results The pathological staining showed that ISO induced myocardial injuries including necrotic degeneration,granulation as well as inflammatory cell infiltration,and collagen accumulation which was invariably observed in ISO challenged mice.Whereas,slight necrosis,sporadic infiltration of inflammatory cells and accumulation of collagen were observed in PNS treated mice.Down regulated expression of miR-1 and up regulated expression of miR-222 were demonstrated in heart from ISO induced myocardial injury mice compared to that from vehicle control mice.While expression of miR-1 and miR-222 were rescued in heart from PNS treated mice.The level of MET was increased in heart from ISO challenged mice and it focused in the area of injury.But the positive stain of MET in heart from PNS treated mice was significantly less than that from ISO challenged mice. Conclusion PNS has a dominantly therapic effect on ISO induced myocardial injury. MiR-1/MET/miR-222 axis may play an important role in the pathological process of myocardial injury induced by ISO and anti-myocardial injury effect of PNS.
myocardial injury;panax notoginseng saponins;microRNA;isoproterenal
R542.2 R256.2
A
10.3969/j.issn.1672-1349.2017.20.006
1672-1349(2017)20-2534-06
上海市优秀学术带头人资助项目(No.1XD1403500);国家自然基金面上项目(No.81273960,No.81473732);国家自然基金青年项目(No.81400313);上海市东方学者跟踪计划(No.GZ2015011);上海市高校特聘教授(东方学者)人才计划(No.沪201188)
1.上海中医药大学附属岳阳中西医结合医院(上海 200437);2.上海市中医药研究院中西医结合临床研究所
陈瑜,E-mail:chenyu6633@hotmail.com;张腾,E-mail:zhangteng501@hotmail.com
信息:杨琴波,崔金刚,王培伟,等.三七总皂苷防治异丙肾上腺素诱导的心肌损伤实验研究[J].中西医结合心脑血管病杂志,2017,15(20):2534-2539.



