曹冰清,谢 瑱,雷 琦,杨 谦,宋允章
脑血疏口服液对脑出血后脑水肿的影响及可能机制分析
曹冰清,谢 瑱,雷 琦,杨 谦,宋允章
目的探讨脑血疏口服液治疗脑出血病灶周水肿的疗效及可能机制。方法选择脑出血病人92例,随机分为脑血疏治疗组(48例)和内科常规治疗组(44例)。在住院24 h内、7 d、14 d查头颅CT检查,评估颅内血肿周围水肿带体积,同时使用酶联免疫吸附法检测基质金属蛋白酶-9( MMP-9)在相应时间点的变化。结果治疗前两组脑水肿体积及血清内MMP-9的含量比较均无统计学意义(Pgt;0.05);在治疗后7 d、14 d脑血疏组与常规治疗组比较脑出血灶周围水肿体积均减小(Plt;0.05);同时血清MMP-9的含量与常规治疗组比较也有所降低(Plt;0.05)。结论脑血疏口服液可减轻脑出血病人的脑水肿,减少血清中MMP-9的含量,可能与脑血疏口服液减轻脑出血后的炎症反应有关。
脑出血;脑血疏口服液;脑水肿;基质金属蛋白酶-9
脑出血是高发病率、高致残率、高死亡率的疾病,已成为危害人类健康最主要的疾病之一,6个月的死亡率高达30%~50%[1]。导致脑出血死亡的主要原因之一是继发性脑水肿,有越来越多的证据提示脑水肿是主要的继发性损伤因素,可以影响到脑出血病人的预后[2]。尤其是对于脑出血后出现迟发性神经功能症状加重的病人,更多的是由于脑水肿而并非是脑出血引起病情进一步恶化[3]。因此,对于脑出血后病灶周围水肿的研究具有重要的临床意义。
脑出血后脑水肿的发生机制非常复杂,仍然没有完全阐明,包括血脑屏障破坏、炎性因子、铁离子、凝血酶、血流动力学等都可能参与脑水肿的形成过程[4]。脑出血早期以血管性脑水肿为主,而出血后迟发性脑水肿可能是血管源性和细胞毒性共同作用形成。基质金属蛋白酶(MMP)是一种锌依赖性中性蛋白酶,是一类重要的广泛参与降解全身各种组织细胞外基质的金属蛋白酶,尤其是基质金属蛋白酶-9(MMP-9)是一种蛋白水解酶,可特异性地降解基膜的主要成分,其含量的增加被认为参与了血脑屏障的破坏。已有研究证实,MMP-9水平的增加与血肿周围水肿的体积独立相关,认为MMP-9可能与继发性脑水肿损伤和预后显着相关[5]。脑出血后长时间的组织水肿压迫,加重脑功能损伤,不利于神经功能恢复。故减轻脑水肿对于提高脑出血的治愈率,减轻致残率具有重要意义。
本研究分析我院2015年6月—2016年7月应用脑血疏口服液治疗的脑出血病人,拟探讨脑血疏口服液对脑出血后脑水肿的影响及血清MMP-9水平的变化。
1 资料与方法
1.1 一般资料 收集2015年6月—2016年7月我院神经内二科收治的脑出血病人92例,男54例,女38例,年龄50岁~75岁。所有病例均为首次发病的原发性脑出血病人,符合《中国脑出血诊治指南(2015)》制定的诊断标准,并经头颅CT检查证实。排除标准:继发性脑出血,如肿瘤、外伤、血管畸形引起的脑出血;蛛网膜下腔出血;原发性脑室内出血;混合型中风(先出血后梗死或先梗死后出血);经检查证实由脑肿瘤、脑血管畸形、烟雾病、血液病、严重糖尿病、抗凝或溶栓药物所致脑出血;合并心、脑、肾、血液系统和内分泌系统等严重原发性疾病,精神疾病病人;妊娠和哺乳期女性;正在参加影响本研究结果评价的其他临床实验者;小脑出血、脑干出血、有脑疝形成者;严重心功能不全,肝、肾功能障碍者。
将92例脑出血病人分成两组,治疗组48例,男28例,女20例;年龄31岁~72 岁(45.00 岁±3.57岁);出血量10 mL~26 mL(16.00 mL±3.55 mL);收缩压(SBP)为(160 ±15 )mmHg,舒张压(DBP)为(93±13)mmHg;美国国立卫生研究院卒中量表(NIHSS)评分(10.7±2.2)分;格拉斯哥昏迷评分(GCS)评分(11.4±1.7)分。对照组44例,男26例,女18例;年龄28岁~70 岁(43.00 岁±6.78 岁);出血量12 mL~24 mL(17.00 mL±2.15 mL), SBP(158±18)mmHg;DBP(99±11)mmHg;NIHSS 评分(11.7±2.8)分;GCS评分(13.4 ±1.1)分。两组性别、年龄、病情、出血量、NIHSS评分、GCS评分差异均无统计学意义(Pgt;0.05)。
1.2 方法 常规治疗组:入院后按照《中国脑血管病防治指南(2015版》采用常规治疗,即脱水降颅压、脑保护、防治并发症及对症支持治疗。脑血疏治疗组:在上述基础上入院当天给予脑血疏口服液(山东沃华医药科技股份有限公司,批准文号:国药准字Z20070059),鼻饲或者口服,每日3次,每次10 mL,疗程为4周。
1.3 观察指标
1.3.1 脑水肿测量 各组病人均于入院24 h内、7 d和14 d行头颅CT检查评估血肿体积、水肿半暗带体积及部位,有无破入蛛网膜下腔、脑室,有无及中线移位(中线移位gt;0.5 cm)。血肿体积测量采用人工1 / 2 ABC法,将头颅CT显示血肿面积最大平面上的血肿长短轴长度分为A、B、C 为层数。血肿体积=1/2ABC。层数计算:血肿面积75%层面为1层;血肿面积75%~25%层面为1/2层;lt;25%层面不计。脑水肿体积=水肿半暗带体积-血肿体积;水肿半暗带体积的测量方法同血肿测量方法。
1.3.2 血清MMP-9的表达 各组病人于入院24 h内、7 d和14 d采集空腹肘静脉血2 mL,静置30 min后2 000 r/min低温离心15 min后取血清,保存于-80℃冰箱待测。采用酶联免疫吸附双抗夹心法(ELESA)原理定量测定,MMP-9试剂盒购自武汉博士德生物制剂公司,操作过程按试剂盒说明严格进行,并由固定人员操作,减少人员操作导致的误差。
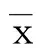
2 结 果
2.1 两组不同时间脑水肿体积比较 治疗前两组脑水肿体积比较无统计学意义,治疗后7 d、14 d行颅脑CT检查,脑血疏组的脑水肿体积均明显小于常规治疗组(Plt;0.05)。详见表1。
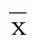
表1 两组不同时间脑水肿体积的变化(±s) mL
2.2 两组不同时间点血清MMP-9的表达变化 入院后治疗前两组血清MMP-9水平比较差异无统计学意义;治疗7 d、14 d后,脑血疏组血浆MMP-9表达均明显低于相应时间点常规治疗组(Plt;0.05)。详见表2。
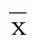
表2 两组不同时间血清MMP-9表达的对比(±s) ng/mL
3 讨 论
脑出血后血肿周围组织的脑水肿是导致脑出血后病情加重的主要原因[6],迟发性脑水肿直接影响到病人的预后。脑出血后脑水肿的病理变化可以分为3个阶段:①超早期(最初几小时)此时期与流体静力压和血肿收缩有关;②早期(24 h~48 h)涉及凝血级联反应和凝血酶的形成;③迟发性水肿(48 h后)与红细胞的溶解、血红蛋白释放、补体的激活以及炎症反应相关[7]。
脑出血时,血液进入脑组织形成血肿,血肿很快发生回缩,导致电解质及部分蛋白漏出至血肿周围,形成早期的血管源性脑水肿。Wagner等[8]研究显示,将猪自体血注入脑内1 h后,周围水肿已形成但血脑屏障仍然完整,认为在脑出血早期形成的脑水肿主要原因是血肿的血清蛋白聚集。Lee等[9]将凝血酶注入脑内,可诱导脑水肿的形成,认为凝血酶的细胞毒性及其对血脑屏障的破坏也是脑出血后脑水肿形成的诱发机制之一。在脑出血发生的24 h内,大量试验均发现脑出血后血肿周围组织的炎性因子,如白细胞介素-6(IL-6)、细胞间黏附分子-1(ICAM-1)、肿瘤坏死因子等浓度均有增高[10]。炎症反应进一步参与血脑屏障破坏,加重脑出血后早期脑水肿[11]。因此,抑制炎症反应可在一定程度上减少血脑屏障的破坏,减轻脑水肿。MMP是一组降解细胞外基质蛋白酶[12],MMP-9是MMP家族中明胶酶类,主要由血管内皮中的单核细胞、巨噬细胞、中性粒细胞、成纤维细、内皮细胞等合成和分泌,并以无活性酶原形式分泌。细胞外基质是构成血管基底膜的主要成分,很大程度上决定了血管的完整性。血管周围的基膜含有层黏连蛋白、硫酸乙酰肝素、胶原酶Ⅳ等,它们大多数是MMP-9的底物[13],故MMP-9在脑血管基底膜的降解中起重要作用。有研究显示[14]利用敲除MMP-9基因的小鼠,证实了MMP-9可引起血脑屏障的破坏。MMP-9在正常的脑组织中仅有低水平的表达,当发生神经元损伤、细胞凋亡时可出现MMP-9水平升高。在炎性反应促发下,MMP-9由胶质细胞、白细胞、血管内皮细胞等分泌到细胞外间隙,可被氧自由基、血红蛋白降解产物等激活,从而降解脑血管基底膜成分,增加血脑屏障的通透性,促使脑水肿的形成[15]。当发生脑出血时,血肿压迫脑组织,脑组织的缺血缺氧刺激上述细胞合成MMP-9,MMP-9水平的升高反过来又进一步加重血肿体积,导致脑水肿加重[16]。因此,寻求阻断脑出血后MMP-9的激活和促进MMP-9抑制剂的表达,将是防止和减轻脑出血后灶周水肿的一种重要途径。
积极控制脑水肿、降低颅内压是治疗脑出血的关键[17]。目前评估脑出血后脑水肿的影像学方法有CT和MRI。有学者认为MRI是描述脑出血后周围水肿带的金标准,多使用T2加权序列、FLAIR序列区分脑水肿及正常脑组织[18]。但是,在区分脑水肿与血肿的方面,由于FLAIR序列有可能低估血肿体积,而T2加权序列有可能高估血肿体积[19]。因此,如有选取MRI检查,计算得到绝对脑水肿体积存在偏差,而且,由于CT的便捷性、经济性,在临床上的使用比MRI更为广泛,所以本研究选择CT作为测量脑水肿体积的方法。
脑血疏口服液是根据中医名着《医林改错》和《金匮要略》中的方剂调整而成,根据“气为血之帅,血为气之母”的中医气血理论及长期临床经验研制的中药新药。中医治疗讲究辨证施治,对中风的治疗历史悠久,有针灸、中药内服、外敷等多种治疗手段。中医认为,“凡出血必离经,离经之血则为瘀血,总以祛瘀为要”,故认为脑出血稳定期的治疗应以活血化瘀为主。脑血舒口服液由《医林改错》中的补阳还五汤加上《金匮要略》中的大黄蟅虫丸调整而来,由黄芪、水蛭、石菖蒲、大黄等7 味中药组成,具有益气、破血、逐瘀、通经的功效[20]。现代医学基础研究表明脑血疏口服液具有降低脑组织丙二醛(MDA)含量,提高脑组织超氧化物歧化酶(SOD)活性,起到抗自由基损伤的作用,并可以改善脑微循环障碍,有利于神经细胞及其功能的恢复[21]。脑血疏口服液在促进脑出血病人血肿吸收,改善病人神经功能缺损程度方面,具有更好的效果[21]。
脑出血后血肿周围组织存在一系列炎症反应,炎症反应进一步参与血脑屏障破坏,加重脑水肿。脑出血发生后炎性因子如细胞间黏附因子、白细胞介素-6、肿瘤坏死因子等浓度有明显增高[22]。机体炎性反应通过细胞间黏附才能完成, 细胞黏附分子属免疫球蛋白超家族成员,是一类介导细胞与细胞、细胞与细胞外基质互相黏附的糖蛋白。其中ICAM-1是一种单链糖蛋白,是介导黏附反应重要的一个黏附分子,在中枢神经系统中的小胶质细胞、神经元、星型胶质细胞等均有广泛表达[23]。有研究发现脑出血病人的ICAM-1水平明显增高,可加重脑出血后早期的炎症反应和水肿,浓度增高与随后的脑水肿密切相关[24]。因此,抑制炎症反应可在一定程度上减少血脑屏障的破坏,减轻脑水肿。脑血疏可能在一定程度上通过抑制ICAM-1的表达,减轻炎症反应的发生,进而抑制MMP-9的激活,降低血脑屏障的通透性,减轻脑水肿。在此方面仍需进行更深入和细致的研究。另外,由于凝血酶的活化产生的细胞毒性及其对血脑屏障的破坏,在脑出血后水肿的形成过程发挥了重要作用。
脑血疏口服液中含有黄芪,黄芪提取物黄芪苷对于凝血酶激活途径中的凝血酶受体基因的表达有明显的抑制作用,能够在一定程度上阻断凝血酶的活化,减轻脑出血后灶周水肿带的形成[25]。水蛭素与黄芪苷可发挥协同作用,抑制凝血酶的作用,减轻脑出血灶周水肿的形成[26]。
脑出血后长时间的组织水肿压迫,加重脑功能损伤,不利于神经功能的恢复。故减轻脑水肿对于提高脑出血的治愈率,减轻致残率具有重要意义。本研究表明脑血疏治疗急性脑出血效果明显,有效促进病人血肿吸收和抑制水肿形成,有效缩短病程,且未见明显不良反应。脑血疏口服液可作为脑出血、脑外伤急性期药物治疗之一。
脑出血病人在神经内科常规治疗基础上,早期、足量、按疗程加用脑血疏口服液,可更快减轻灶周水肿,提高治愈率及好转率,提高病人生活质量及生活能力水平。
[1] Mayer SA,Rincon F.Treatment of intracerebral hemorrhge[J]. Lancet Neurol,2005,4(10):662-672.
[2] 宛丰,黄梅,吕衍文,等.MMP-9与脑出血后迟发性脑水肿的关 系研究[J].卒中与神经疾病,2014,21(2):110-112.
[3] Xi G,Keep RF,Hoff JT.Pathophysiology of brain edema formation[J].Neurosurg Clin N Am,2002,13(3):371-383.
[4] Xi G,Keep RF,Hoff JT.Mechanisms of brain injury after intracerebral haemorrhage[J].Lancet Neurol,2006,5(1):53-63.
[5] 吉洁,沈光宇.基质金属蛋白酶9在脑出血中作用的研究进展[J].实用医学杂志,2009,25(24):4244-4245.
[6] Kreitzer N,Adeoye O.An update on surgical and medical management strategies for intracerebral hemorrhage [J].Semin Neurol,2013,33(5):462-467.
[7] Keep RFHua Y,Xi G.Intracerebral haemorrhage:mechanisms of injury and therapeutic targets[J].Lancet Neurol,2012,11(8): 720-731.
[8] Wagner KR,Xi G,Hua Y,et al.Lobar intracerebral hemorrhage model in pigs:rapid edema development in perihematomal white matter[J].Stroke,1996,27(3):490-497.
[9] Lee KR,Kawai N,Kim S,et al.Mechanisms of edema formation after intracerebral hemorrhage: effects of thrombin on cerebralblood flow,blood brain barrier permeability,and cell survival in a rat model[J].J Neurosurg,1997,86(2):272-278.
[10] Burchell SR,Iniaghe LO,Zhang JH,et al.Fucoidan from fucus vesiculosus fails to improve outcomes following intracerebral hemorrhage in mice [J].Acta Neurochir Suppl,2015,121(2):191-198.
[11] 祝春华,张祥建.脑出血后病理生理机制及临床治疗对策[J].中国神经免疫学和神经病学杂志,2012,5(19):167-169.
[12] 陈玉姣,欧阳晴晴,王燕,等.肿瘤坏死因子-α对骨髓源性肥大细胞表达MMP-3、MMP-9、IL-17 的影响[J].南方医科大学学报,2015,35(11):1633-1637.
[13] Yabluchanskiy A,Ma Y,Iyer RP,et al.Matrix metalloproteinase-9:many shades of function in cardiovascular diseas[J]. Physiology(Bethesda),2013,28(6):391-403.
[14] Gursoy-Ozdemir Y,Qiu J,Matsuoka N,et al.Cortical spreading depression activates and upregulates MMP-9[J].J Clin Invest,2004,113(10):1447-1455.
[15] Li Y,Ma Q,Halavi S,et al.Fetal stress-mediated hypomethylation increases the brain susceptibility to hypoxic-ischemic injury in neonatal [J]. Exp nurology,2015;275(1):1-10.
[16] Cheon SY ,Cho KJ ,Kim SY ,et al.Blockade of apopotosis signalregulating kinase 1 attenuates matrix metalloproteinase 9 activity in brain endothelial cells and the subsequent apopotosis in neurons after ischemic injury [J]. Front Cell Neurosci ,2016,10:213.
[17] 于辉天,叶华卫,麦荣康,等.高血压脑出血的病理改变及脑出血对周围组织的影响[J].中外医疗,2013,1(4):11-13.
[18] Carhuapoma JR,Hanley DF,Banerjee M,et al.Brain edema after human cerebral hemorrhage: a magnetic resonance imaging volumetric analysis[J]J Neurosurg Anesthesiol,2003,15(3):230-233.
[19] Schellinger PD,Jansen O,Fiebach JB,et al.A standardized MRj stroke protocol:comparison with CT in hyperacute intracerebral hemorrhage[J].Stroke,1999,30(4):765-768.
[20] 鲁明,谢汝萍,付瑜,等.脑血疏口服液治疗高血压性脑出血的对照研究[J].中国康复理论与实践,2004,10(5):304-305.
[21] 顾燕岳,马速.脑血疏口服液治疗脑出血32 例[J].河南中医,2010,30(10):982-983.
[22] Yang JT,Lee TH,Lee IN,et al.Dexamethasone inhibits ICAM-1and MMP-9 expression and reduces brain edema in intracerebral hemorrhagic rats[J].Acta Neurochir(Wien),2011,153(11):2197-2203.
[23] Sari E, Tunc-Sarisozen Y,Mutlu H,et al.ICAM-1 targeted catalase encapsulated PLGA-b-PEG nanoparticles against vascular oxidative stress[J],J Microencapsul,2015,32(7):687-698.
[24] Syeda T,Muhammad Hashim AS,Rizvi HA,et al.Serum SIOOB in patients with brain tumours undergoing craniotomy[J].J Coll Physicians Surg Pak,2013,23(2):112-115.
[25] 赵剑,刘广辉,梁亮,等.黄芪甲苷对大鼠脑出血后脑水肿及水 通道蛋白 4 表达的影响[J].宁夏医科大学学报,2015,37(8) :879- 882;886;前插2.
[26] 王新高,赵性泉.脑血疏口服液治疗急性脑出血的配对研究[J].中西医结合心脑血管病杂志,2015,13(7):937-938.
2017-04-08)
(本文编辑 王雅洁)
R743.3 R289.5
B
10.3969/j.issn.1672-1349.2017.21.031
1672-1349(2017)21-2759-04
陕西省人民医院(西安 710068),E-mail:569689538@qq.com
信息:曹冰清,谢瑱,雷琦,等.脑血疏口服液对脑出血后脑水肿的影响及可能机制分析[J].中西医结合心脑血管病杂志,2017,15(21):2759-2762.



