, ,
脑性瘫痪(cerebral palsy,CP)简称脑瘫,是一种非进行性脑损伤所致的,以姿势异常和运动障碍为主要表现的综合征,多在小儿出生前至出生后1个月内发生,常合并有感知觉障碍、智力障碍等症状[1]。CP不仅对患儿的生长发育及日后生活带来巨大影响,而且给患儿家庭带来沉重的负担。目前临床上尚无确切治疗脑瘫的方法,也无有效药物,只能依靠综合治疗方法进行早期康复治疗[2]。干细胞移植技术及基因临床治疗技术日新月异的发展,为CP患儿的治疗康复提供了新途径[3]。为了探讨干细胞移植是否对CP的治疗有效,本研究采用改良的HIE手术方法对Wistar大鼠进行脑瘫建模,建模后行侧脑室内神经干细胞(NSCs)移植治疗,并对模型组、对照组及实验组大鼠神经行为学检测结果、Morris水迷宫逃避潜伏时间以及脑室旁白质中胶质纤维酸性蛋白(GFAP)的含量进行对比分析,以探究侧脑室内NSCs移植对脑瘫鼠模型的治疗效果。
1 材料与方法
1.1 实验动物 选取60只7日龄健康、SPF级Wistar大鼠,体重13 g~15 g,均喂养于自由进食、进水,相对湿度45%~60%,室温23℃~25℃,光照12 h的环境中;大鼠购买自新疆医科大学实验动物中心,许可证编号:SYXK(新)2015-0004。
1.2 药品与仪器 侧脑室神经干细胞由本实验室自行配置[4];兔抗神经胶质纤维酸性蛋白(GFAP)由汉博士德生物工程有限公司提供;生物显微镜BX50F4,由日本OLYPUS公司提供。
1.3 动物分组与建模 建模方法:除对照组外,对48只大鼠行改良HIE造模方法。所有大鼠麻醉后,固定在手术板上,颈前正中作切口,分离并结扎左颈总动脉,然后缝合切口;将大鼠置于37℃的水封闭缺氧箱中,氧气含量为8%,维持2 h;对建模后的大鼠,参考Hideyuki[5]的方法进行神经行为学及病理学检查,选取24只建模成功大鼠。 对照组假手术后,给予等量生理盐水。 模型组造模后回笼饲养,给予等量生理盐水。 NSCs组(实验组)建模3 d后给予NSCs移植。
1.4 治疗方法 实验组大鼠建模3 d后,麻醉并进行颅骨钻孔。将大鼠置于立体定向仪头架上,进行左侧脑室穿刺,微量泵缓慢注入2 μLNSCs移植液。注射后留针2 min,采用骨蜡将注射针孔封闭,缝合头皮。
1.5 病理组织观察 心脏灌注后,进行断头取脑,采用4%多聚甲醛溶液进行固定。24 h后,在脑前卤取冠状脑组织约1 mm,作石蜡切片。经HE染色后,固定、晾干,光镜下观察。
1.6 观察指标及评估方法 对比各组大鼠在42日龄时的Morris水迷宫溺水逃避潜伏期时间差异,Morris水迷宫是英国心理学家Morris于20世纪80年(1981)代初设计并应用于脑学习记忆机制研究的一种实验手段。将大鼠面向池壁分别从4个入水点放入水中若干次,记录其寻找到隐藏在水面下平台的时间(逃避潜伏期,escape latency)。采用悬吊实验(大鼠前腿抓住粗0.5 cm的玻璃棒,观察其掉下的时间,<10 s得1分;10 s~30 s得2分;31 s~119 s得3分;2 min~5 min得4分;>5 min得5分)、斜坡实验(大鼠放置于坡度为45°的斜坡上,观察大鼠调转头的时间)、旷场实验(长宽高分别为36 cm的无盖方盒,盒底划分成9个等大小的格子,观察记录大鼠活动情况,大鼠1/2以上身体部位进入相邻方格计为1分,大鼠后肢性站立得1分,二者相加为其总分),评定各组大鼠的神经行为能力。
对比各组大鼠的脑室旁白质中胶质纤维酸性蛋白(GFAP)含量差异。免疫组化法检测GFAP含量。断头取脑后制作石蜡切片;切片脱蜡脱水,微波抗原修复约20 min,3%H2O2室温孵育10 min,BSA室温封闭10 min,兔抗大鼠GFAP抗体处理4℃过夜。二抗37℃下孵育20 min,SABC试剂于37℃下孵育20 min。HE染色,经脱水、透明后采用中性树脂封片。晾干、待检。400倍镜下每张切片同一部位随机选取5个不同的视野,采用数码相机图像采集系统采图。Imageproplus6.0软件对图像进行分析,免疫组化检测测量阳性细胞数,求其平均数作为最后的阳性结果,并记录阳性细胞数。
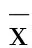
2 结 果
2.1 病理切片结果分析 正常组大鼠脑室周围组织中细胞排列规则,未发现炎症细胞、软化灶形成(见图1A);模型组大鼠的脑室周围组织中可见细胞排列紊乱,细胞出现变性、肿胀、坏死,炎症细胞浸润增加,软化灶形成(见图1B);NSCs组的病理严重程度较模型组显着的减轻(见图1C)。
注:A为正常组,B为模型组,C为NSCs组(100倍)。
图1 HE染色观察
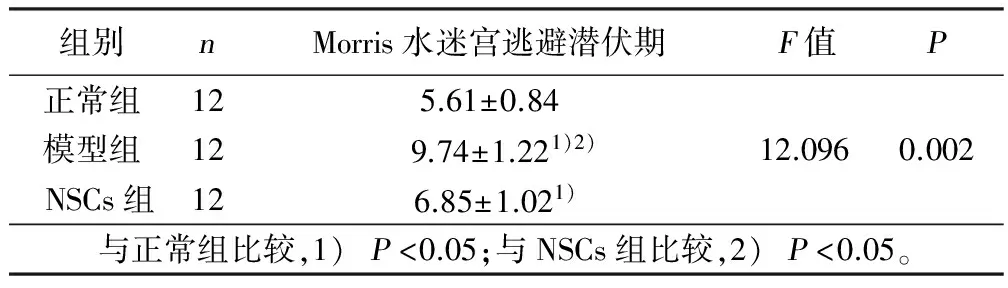
2.2 各组大鼠Morris水迷宫逃避潜伏时间比较 42日龄时,模型组大鼠的Morris水迷宫逃避潜伏时间显着长于NSCs组和正常组大鼠,差异具有统计学意义(P<0.05);NSCs组大鼠的Morris水迷宫逃避潜伏时间显着长于正常组大鼠,差异具有统计学意义(P<0.05)。详见表1。
2.3 各组大鼠神经行为能力测定 42日龄时,模型组大鼠的斜坡实验时间显着长于NSCs组和正常组大鼠,悬吊试验和旷场试验评分显着低于NSCs组和正常组大鼠,差异具有统计学意义(P<0.05);NSCs组大鼠的斜坡实验时间显着长于正常组大鼠,悬吊试验和旷场试验评分显着的低于正常组大鼠,差异具有统计学意义(P<0.05)。详见表2。
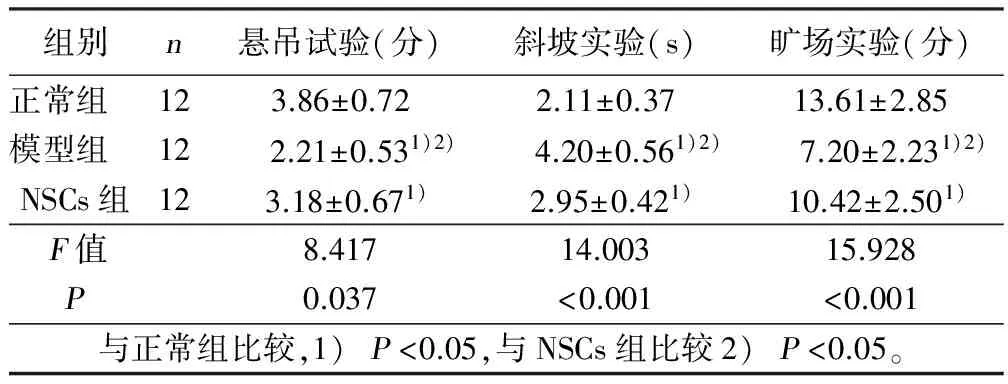
组别n悬吊试验(分)斜坡实验(s)旷场实验(分)正常组 123.86±0.722.11±0.3713.61±2.85模型组 12 2.21±0.531)2) 4.20±0.561)2) 7.20±2.231)2)NSCs组123.18±0.671)2.95±0.421)10.42±2.501)F值8.41714.00315.928P0.037<0.001<0.001 与正常组比较,1)P<0.05,与NSCs组比较2)P<0.05。
2.4 各组大鼠脑室旁白质中GFAP阳性细胞计数 42日龄时,模型组大鼠的脑室旁白质中GFAP阳性细胞数目显着高于NSCs组和正常组大鼠,差异具有统计学意义(P<0.05);NSCs组大鼠的脑室旁白质中GFAP阳性细胞数显着高于正常组大鼠,差异具有统计学意义(P<0.05)。详见表3、图2。
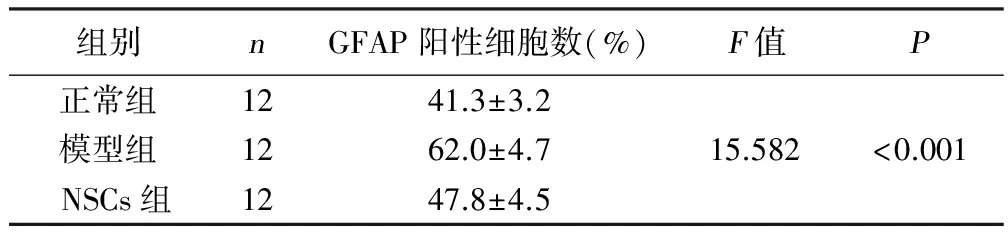
组别nGFAP阳性细胞数(%)F值P正常组1241.3±3.2模型组1262.0±4.715.582<0.001NSCs组1247.8±4.5
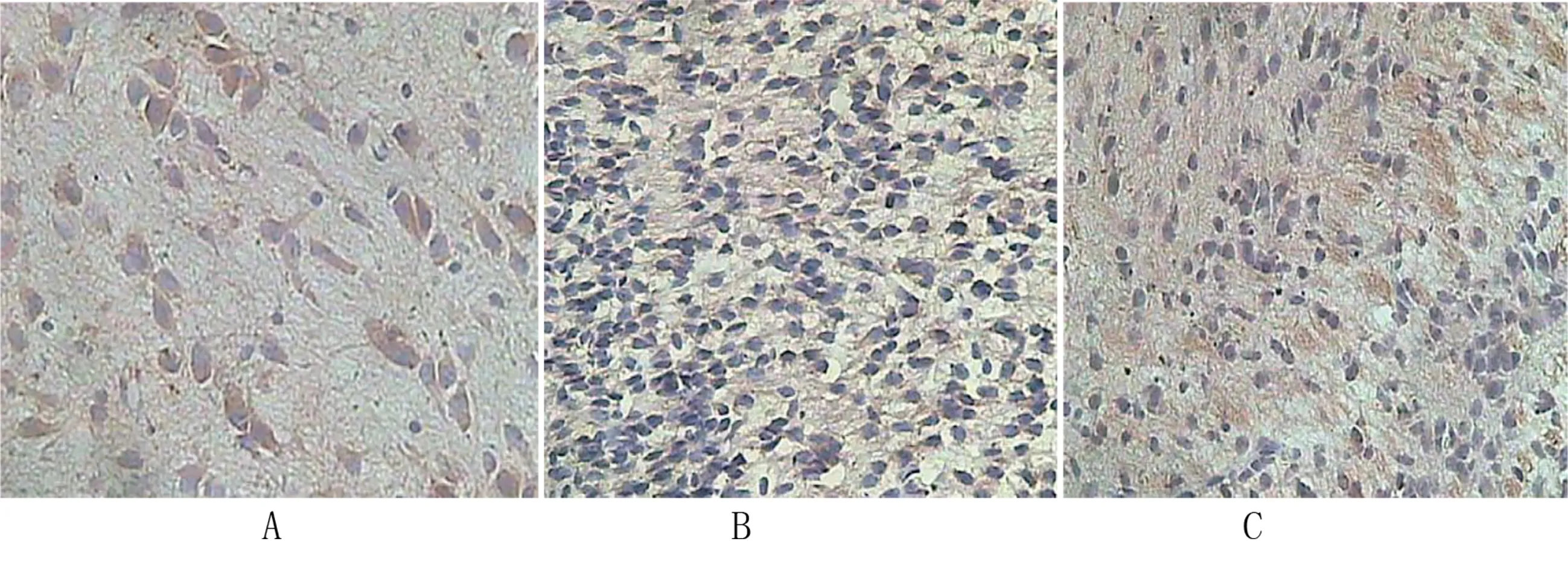
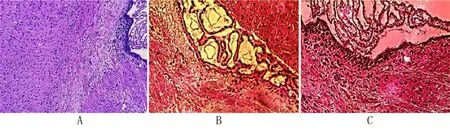
注:A为正常组,B为模型组,C为NSCs组(200倍)。
3 讨 论
随着医疗技术的发展,脑性瘫痪患儿的生存率逐年上升,脑性瘫痪患儿的治疗康复方法亦成为临床研究的重点。脑性瘫痪发病机制尚不明确,其发生与围生期多因素相关,如早产、低体重、产时窒息、感染、多胎以及脑室周白质软化等均为脑性瘫痪的常见危险因素[6-7]。神经干细胞具有多向分化及自我更新的能力,能够促进损伤脑组织再生,维持神经内环境稳定,近年来外源性NSCs治疗脑损伤已成为临床研究热点[8-11]。为探讨侧脑室内神经干细胞移植对小儿脑瘫的治疗效果,本研究对7日龄大鼠进行脑瘫造模并采用侧脑室内神经干细胞移植治疗。
3组病理组织观察:正常组大鼠脑室周围组织中细胞排列规则,未发现炎症细胞、软化灶形成;模型组大鼠的脑室周围组织中可见细胞排列紊乱,细胞出现变性、肿胀、坏死,炎症细胞浸润增加,软化灶形成;NSCs组的病理严重程度较模型组显着减轻。说明神经干细胞干预治疗能够减轻损伤部位炎性反应,减缓炎症浸润,保护脑室周围组织细胞。
3.1 NSCs移植对脑瘫鼠Morris水迷宫逃避潜伏时间的影响 Morris水迷宫实验具有视频摄像跟踪技术,能够避免人为干扰,结果真实可靠,被广泛用于动物的空间学习记忆能力的研究。本研究采用Morris水迷宫对3组大鼠学习记忆能力进行检测,结果显示:42日龄时,模型组大鼠的Morris水迷宫逃避潜伏时间显着长于NSCs组和正常组大鼠;NSCs组大鼠的Morris水迷宫逃避潜伏时间显着长于正常组大鼠。说明NSCs移植能够改善脑瘫鼠的智力水平,提升空间学习记忆能力,对脑瘫鼠治疗具有积极意义。
3.2 NSCs移植对脑瘫鼠神经行为能力的影响 42日龄时,模型组大鼠的斜坡实验时间显着长于NSCs组和正常组大鼠,悬吊试验和旷场试验评分显着低于NSCs组和正常组大鼠;NSCs组大鼠的斜坡实验时间显着长于正常组大鼠,悬吊试验和旷场试验评分显着低于正常组大鼠。NSCs组的神经行为能力明显高于模型组,说明NSCs移植干预治疗后脑瘫鼠的神经行为能力得到提升。
3.3 NSCs移植对脑瘫鼠脑室旁白质中GFAP阳性细胞数量的影响 星形胶质细胞(AS)是中枢神经系统的主要细胞之一,具有维持神经细胞微环境稳定以及调节代谢过程的作用,胶质纤维酸性蛋白(glial fibillary acidic protein GFAP)是AS中间纤维所特有一种细胞骨架蛋白,可作为AS的特征性标记物[12-13]。本研究通过对3组大鼠脑室旁白质中GFAP阳性细胞数量的检测,结果显示:42日龄时,模型组大鼠的脑室旁白质中GFAP阳性细胞数目显着高于NSCs组和正常组大鼠;NSCs组大鼠的脑室旁白质中GFAP阳性细胞数显着高于正常组大鼠。星形胶质细胞具有保护及抑制神经元的双重作用:神经损伤后AS激活,产生神经营养因子及大量GFAP用于损伤修复;大量GFAP堆积以及AS过度胶质化,可形成机械阻断屏障,影响髓壳等的再生。本研究中NSCs组大鼠GFAP数量大于对照组,说明AS激活,机体修复神经损伤,但其数量小于模型组,可以减少AS细胞过度胶质造成的负面作用。
脑瘫鼠模型采用侧脑室内NSCs移植治疗,能够显着的改善其神经行为及学习能力,值得临床对此方法进一步研究使用。
[1] 衡庆鑫,冯燕华,孙武权,等. 小儿脑瘫的临床应用和研究进展概况[J]. 中国医药导报,2015(24):65-69.
[2] Dan,Bernard. Stem cell therapy for cerebral palsy[J]. Developmental Medicine and Child Neurology,2016,58(5):e424.
[3] Chen G,Wang Y,Xu Z,et al. Neural stem cell-like cells derived from autologous bone mesenchymal stem cells for the treatment of patients with cerebral palsy[J]. Journal of Translational Medicine,2013,11(1):1-11.
[4] 尹凤婷,曹勇军,马全红. 胎鼠侧脑室神经干细胞的培养及鉴定[J]. 中国血液流变学杂志,2014,24(2):203-204;211.
[5] Hideyuki O. Neural stem cells as therapeutic agents for CNSinjuries and disorders [J]. Int Congress Series,2003,1252:493-498.
[6] 李鹏. 神经干细胞移植治疗小儿脑性瘫痪的研究[D]. 蚌埠: 蚌埠医学院,2014.
[7] 黎君君,曾理. 小儿脑瘫分娩前危险因素的病例对照研究[J]. 广西医科大学学报,2015,32(3):429-431.
[8] 周菊花,方素珍,周细中,等. 神经干细胞移植治疗重度脑瘫患儿的研究进展[J]. 临床儿科杂志,2014,32(1):85-87.
[9] 高谋,徐如祥,杨志军,等. 两种干细胞对颅脑创伤炎症反应调控作用的对比研究[J]. 第三军医大学学报,2015,37(17):1697-1703.
[10] Mcintyre S,Blair E,Badawi N,et al. Antecedents of cerebral palsy and perinatal death in term and late preterm singletons[J]. Obstetrics & Gynecology,2013,122(4):869-877.
[11] 贾进明,陈菲菲,吴云飞,等. 神经干细胞移植联合PEP-1-SOD1对颅脑损伤大鼠神经功能恢复的影响[J]. 南京医科大学学报:自然科学版,2015(11):1511-1516.
[12] 屈素清,刘卫鹏,杨辉,等. 人神经干细胞侧脑室移植治疗40例重度脑性瘫痪的临床疗效[J]. 中华行为医学与脑科学杂志,2015,24(7):615-618.
[13] 庞源广,高小青,陈波,等. GDNF基因修饰的神经干细胞移植对大鼠局灶性脑缺血后GFAP表达的影响[J]. 四川医学,2013,34(8):1099-1101.



