网络药理学概念[1]最早于2007年由Andrew L Hopkins在Nature Biotechnology上提出,内容涉及蛋白组学、基因组学、系统生物学、计算生物学和网络生物学等多学科,是在现代药理学基础上建立的以系统生物学为基础的药物设计与开发的新方法。通过构建“药物-靶点-疾病”关系网络,运用专业网络分析软件及算法,系统分析成分-靶点关系,从网络层面观察中药成分对疾病靶点的干预与影响,从而阐明中药多成分、多靶点、多通路的特征。网络药理学已成为目前药物研发理论方法的热点[2-3]。
近年来,我国心脑血管病患病率处于持续上升阶段[4],血栓形成和血栓栓塞是心脑血管病的重要病理过程,参与多种疾病的发生与发展。血小板活化聚集、血液黏度升高等是血栓形成关键的病理因素,也是抗血栓药物的研究方向[5]。中医理论中血瘀证见于多种疾病,其临床表现与现代医学的血栓性疾病类似。益气活血作为血瘀证的治法之一,在治疗血栓性疾病中取得了良好的效果。相较于西药的单靶点、高选择性,中药多靶点、多途径相互作用一直是新药研发的热点。组方中西洋参益气以助气行血、丹参活血以免壅滞,且两药合用活血而不耗气、益气而不壅滞,抗血栓疗效明确,因而被广泛用于防治心脑血管疾病,但是其药效的物质基础和作用机制不明,因此,本研究通过网络药理学的方法分析、预测西洋参、丹参组方抗血栓药效物质基础、作用靶点及机制,以期为本课题组后续西洋参、丹参组方抗血栓基础实验研究提供参考依据。
1 方 法
1.1 丹参、西洋参成分潜在靶点网络构建 Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform (TCMSP数据库)[6]是西北农林科技大学王永华教授团队研发的中药系统药理学分析平台,为中药研究提供了新的方法。在数据库中检索西洋参、丹参所有成分及靶点,通过口服生物利用度(OB)、药物相似性(DL)进行活性成分筛选。其中西洋参活性成分指标设定为OB>30%、DL>0.18,丹参活性成分筛选指标设定为OB>40%、DL>0.18,再通过Cytoscape3.2.1软件对成分、潜在靶点进行可视化网络构建。
1.2 血栓性疾病靶点网络构建 以“thrombosis”为关键词分别检索TTD、DrugBank数据库,获得疾病靶点,通过Uniprot数据库进行蛋白基因名的转换,再通过Cytoscape3.2.1软件进行疾病靶点可视化构建,利用Bisogenet构建蛋白-蛋白相互作用(PPI)网络。
1.3 药物活性成分-疾病靶点网络构建 通过Cytoscape3.2.1工具的Merge功能,将以上构建得到的“西洋参、丹参组方成分-潜在靶点网络”与“疾病靶点蛋白-蛋白相互作用网络”进行Merge分析,得到药物-疾病共同相关的靶点,映射得到活性成分,进行网络构建与分析。
1.4 KEGG富集通路可视化分析 利用David数据库将药物-疾病共同相关靶点进行Go注释与KEGG富集通路分析,通过OmicShare平台以高级气泡图进行可视化。
2 结 果
2.1 西洋参、丹参组方成分-潜在靶点网络 本研究基于样本量和数据的复杂性,通过OB、DL参数作为ADME筛选条件,最终得到50个活性成分构建得到的可视化网络(见图1)包含140个节点和939条边。
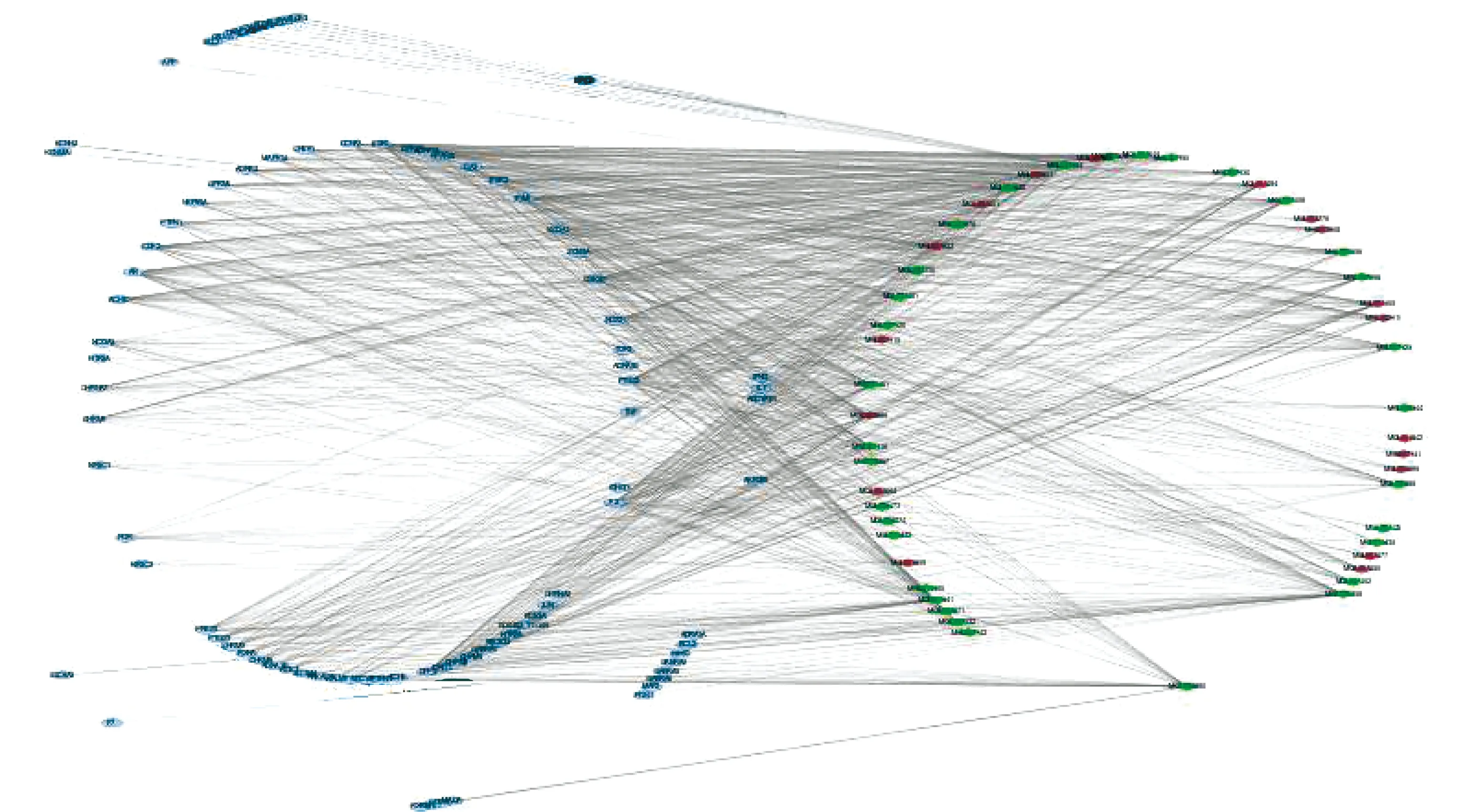
蓝色长方形代表靶点;菱形代表成分,绿色为西洋参活性成分,红色为丹参活性成分。节点的度表示网络中与该节点相连的边的条数,每个长方形的度表示与该靶点相关的活性成分的数目,每个菱形的度则表示该成分可能作用的靶点的数目
图1丹参、西洋参成分-潜在靶点网络图
2.2 血栓形成性疾病-靶点网络 33个疾病靶点通过UniProt数据库转换为标准基因名,构建可视化网络(见图2)及“疾病靶点PPI网络”(见图3),得到714个潜在疾病靶点,共7 046条边。计算PPI网络节点度值中位数为12,因此以度值大于24的节点作为疾病核心靶点,构建网络图(见图4),其中疾病核心靶点共195个。
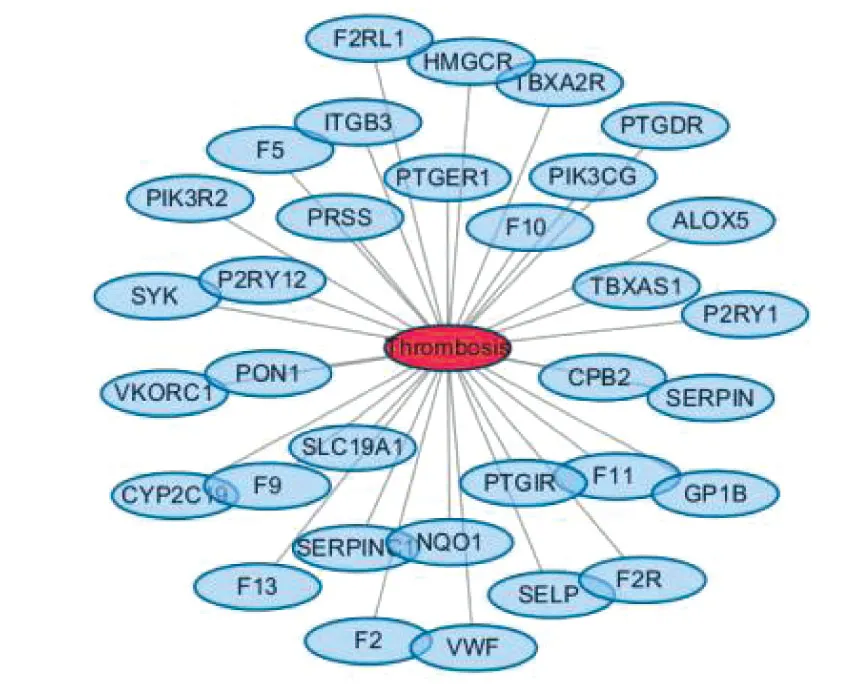
图2 疾病-靶点网络

图3 疾病靶点蛋白-蛋白相互作用网络
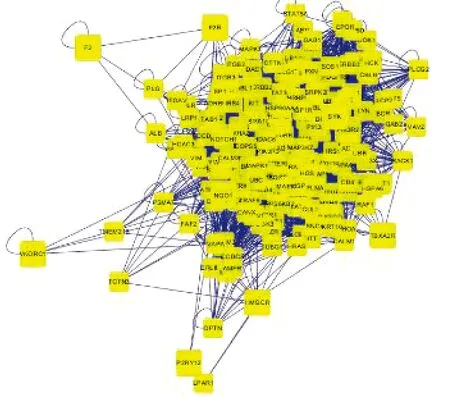
图4 疾病核心靶点网络
2.3 药物活性成分-疾病靶点网络构建 “成分-潜在靶点网络”与“疾病靶点PPI网络”Merge分析后构建的“成分-靶点网络” (见图5),包括11个药物-疾病共同的靶点,映射得到34个成分。靶点以菱形表示,活性成分以椭圆表示,颜色越深则度值越大,与其直接相连的节点越多。节点间的连接原则为西洋参、丹参组方活性成分靶点与疾病核心靶点相同时,则将活性成分与疾病靶点连接,此靶点即为西洋参、丹参组方中某个活性成分治疗血栓性疾病的潜在作用靶点。进一步通过Cytoscape的 Network Analyze、CytoNAC插件对“成分-靶点网络”进行拓扑分析,计算出度值中位数为3,然后筛选出度值大于中位数2倍的节点作为核心成分靶点网络节点,最后构建 “核心成分-靶点网络”(见图6),其中包括5个疾病靶点和8个活性成分。
2.4 KEGG富集通路信息 利用David 对11个靶点进行富集分析,得到10条信号通路(见表1、图7),横坐标表示富集因子,纵坐标表示通路,圆点颜色代表P值,颜色越鲜艳,则P值越小,基因在此通路上的显着性越高;圆点大小表示基因数,越大则富集基因数越多。每条通路上的基因见表1,与血栓形成直接相关的通路是platelet activation(血小板活化),有3个基因富集在这条通路上,分别是MAPK14,PRKACA,ITGB3,映射得到直接相关的活性成分共16个(见表2、图8)。
3 讨 论
中药成分多样、机制复杂,唯有明确其药效物质基础及作用机制,才能在中医药宝库中开发出更多造福人类的新有效药。西洋参益气,丹参活血,二药合用共奏益气活血之效,临床用于治疗血栓性疾病,疗效明确。本研究利用TCMSP平台通过ADME参数筛选西洋参和丹参活性成分,选择OB和DL作为反映活性成分在体内代谢动力学的参数。通过设定OB>30%、DL>0.18两个参数,得到9个西洋参活性成分、65个潜在疾病靶点。丹参中已知成分202个,因此提高OB值为大于40%,最终得到丹参活性成分41个、72个潜在疾病靶点。去除重复的47个靶点后,最终构建的可视化网络包含140个节点、939条相互作用关系。此结果表明,不同成分可以作用于相同靶点,发挥协同或拮抗作用,同一个成分亦可作用于不同靶点,参与不同信号通路,治疗不同的疾病。可见,中药多成分、多靶点、交互作用的特点使其成为新药研发的热点,同时解释了中医异病同治、同病异治法的机制之一[7]。
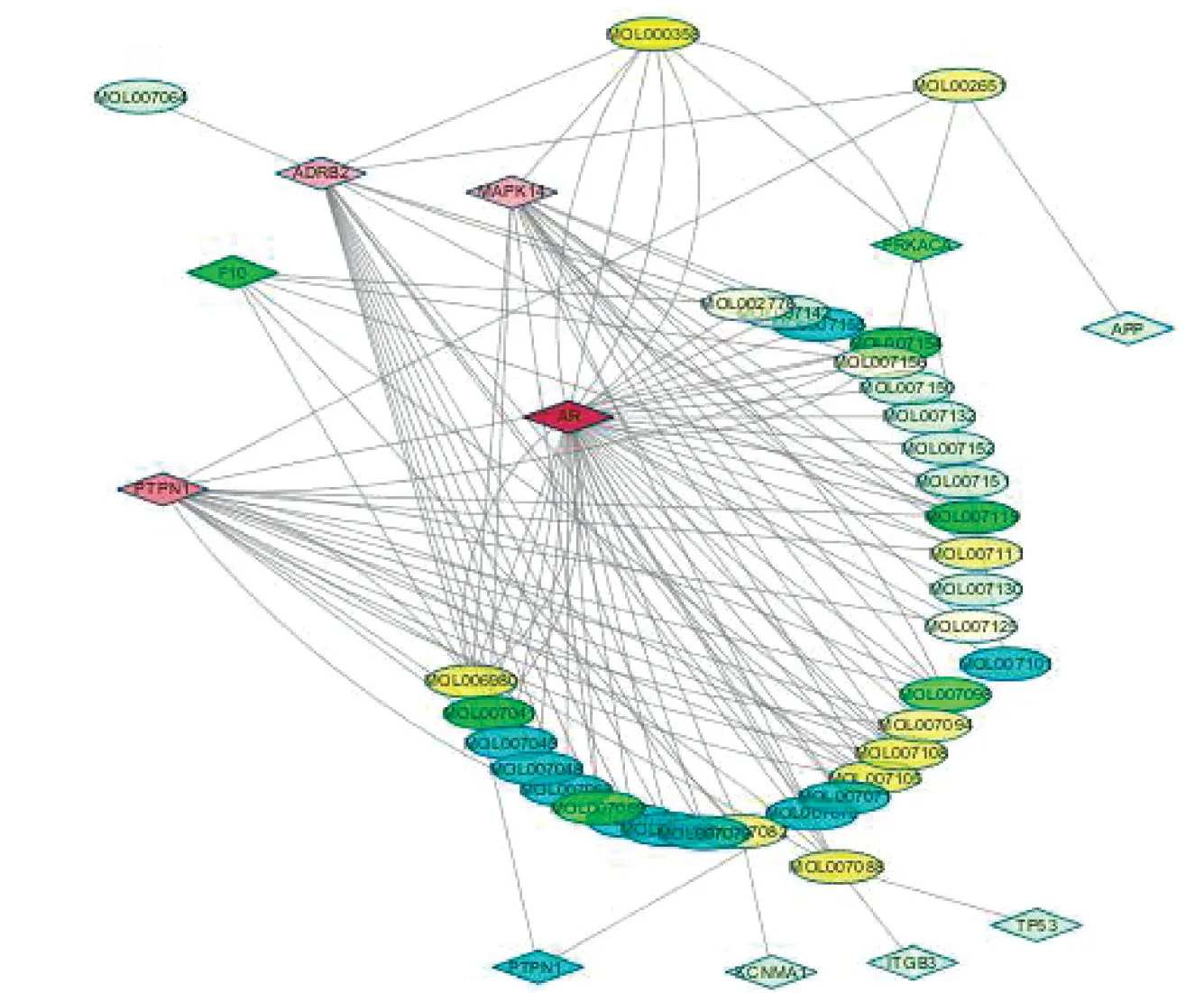
图5 成分-靶点网络
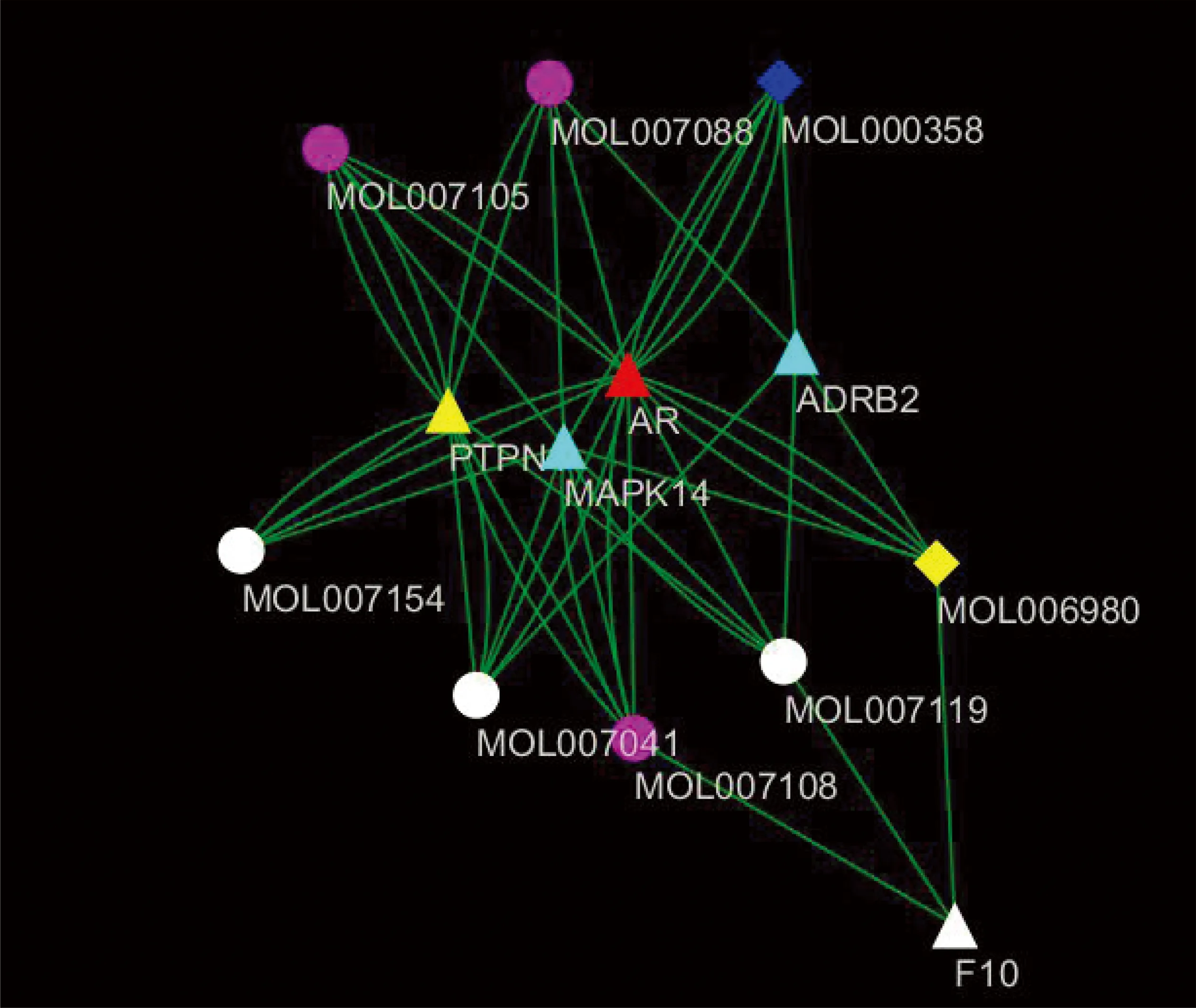
图6 核心成分-靶点网络

编号 通路名称 基因名称百分比(%)hsa05205Proteoglycans in cancer(癌症蛋白聚糖)MAPK14 TP53 PRKACA ITGB336.36hsa04924Renin secretion(肾素分泌)KCNMA1 ADRB2PRKACA27.27hsa04970Salivary secretion(唾液分泌)KCNMA1 ADRB2PRKACA27.27hsa04919Thyroid hormone signaling pathway(甲状腺激素信号通路)TP53 PRKACA ITGB327.27
(续表1)

编号 通路名称 基因名称百分比(%)hsa04611Platelet activation(血小板活化通路)MAPK14 PRKACA ITGB327.27hsa04261Adrenergic signaling in cardiomyocytes(心肌细胞肾上腺素能信号)ADRB2 MAPK14 RKACA27.27hsa05169Epstein-Barr virus infection(人类疱疹病毒感染)MAPK14 TP53 PRKACA27.27hsa04010MAPK signaling pathway(丝裂原活化蛋白激酶信号通路)MAPK14 TP53 PRKACA27.27hsa05014Amyotrophic lateral sclerosis (ALS)(肌萎缩性脊髓侧索硬化症)MAPK14 TP5318.18hsa04923Regulation of lipolysis in adipocytes(脂肪细胞的脂溶性调节)ADRB2 PRKACA18.18
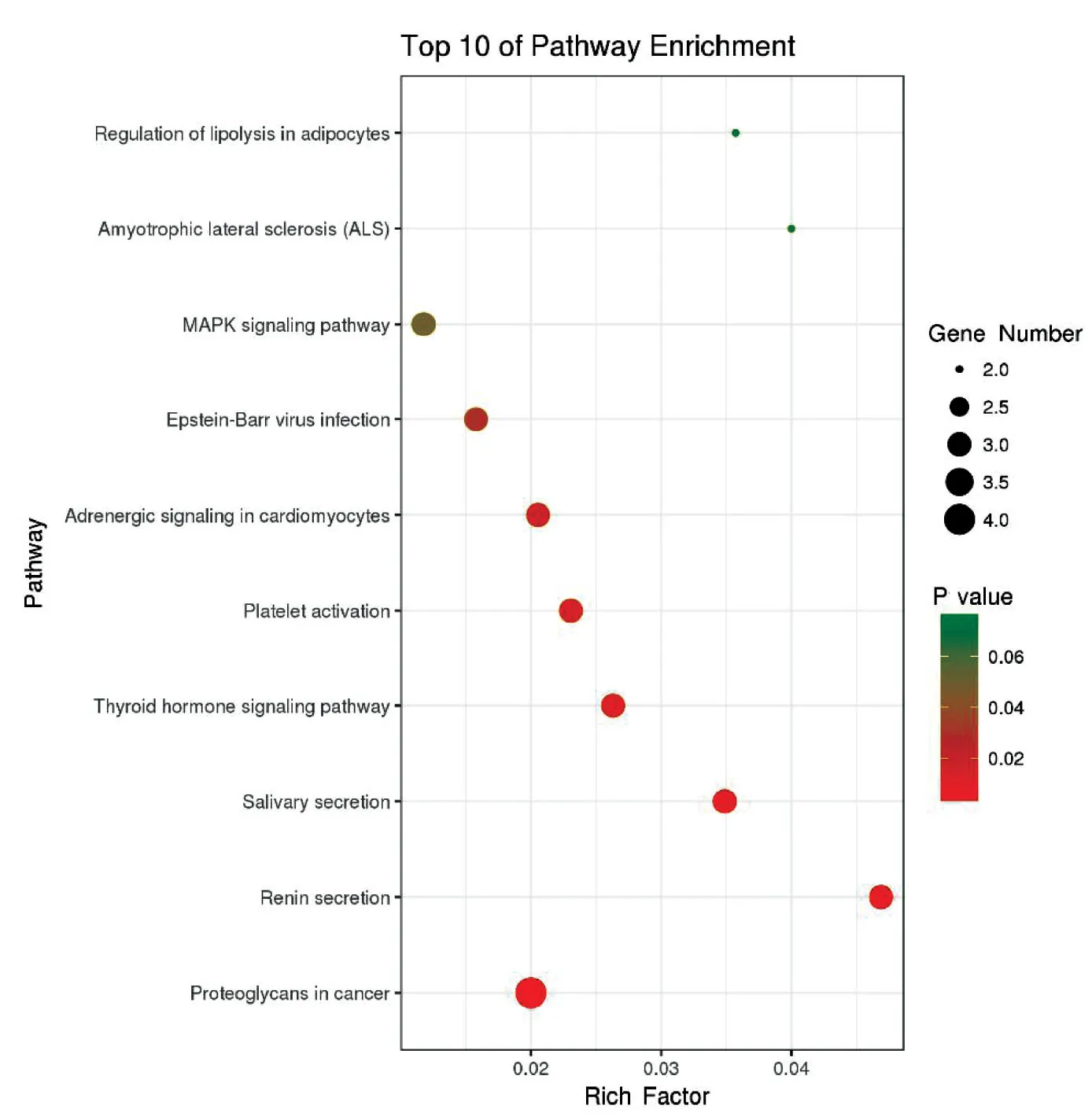
图7 11个成分靶点富集通路气泡图
表2作用于血小板活化通路靶点的活性成分

编号CAS 名称口服生物利用度类药性来源MOL00035883-46-5beta-sitosterol(β-谷甾醇)36.910.75西洋参MOL00698058-74-2Papaverine(罂粟碱)64.040.38西洋参MOL00708835825-57-1/ 4733-35-1Cryptotanshinone(隐丹参酮)52.340.40丹参 MOL007105113472-19-8 Epidanshenspiroketallactone(表丹参螺旋缩酮内酯)68.270.31丹参 MOL00710822550-15-8Isocryptotanshinone(异丹参酮)54.980.39丹参 MOL00704187112-49-0 Miltirone Ⅰ(丹参新酮)40.860.23丹参 MOL007119 N/AMiltiononeⅠ(丹参醌新酮Ⅰ)49.680.32丹参
(续表1)

编号CAS 名称口服生物利用度类药性来源MOL007154568-72-9Tanshinone ⅡA(丹参酮ⅡA)49.890.40丹参MOL00706996839-29-1Przewaquinone c(紫丹参素C)55.740.40丹参MOL00709827468-20-8Deoxyneocryptotanshinone(脱氧基新隐丹参酮)49.400.29丹参MOL002651119963-50-7Dehydrotanshinone Ⅱ A(去氢丹参酮ⅡA)43.760.40丹参MOL007094149817-96-9Danshenspiroketallactone(丹参螺旋缩酮内酯)50.430.31丹参MOL00711120958-15-0Isotanshinone Ⅱ(异丹参酮ⅡA)49.920.40丹参MOL007125109664-02-0Neocryptotanshinone(新隐丹参酮)52.490.32丹参MOL007101125623-97-4DihydrotanshinoneⅠ(二氢丹参酮)45.040.36丹参MOL00715517397-93-2 Tanshinone ⅡB (丹参酮ⅡB )65.260.45丹参
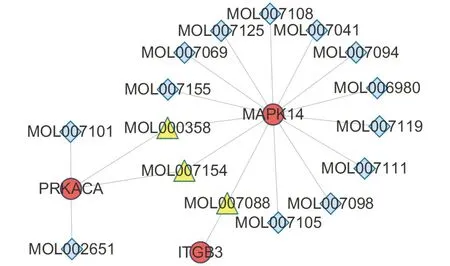
图8 血小板活化通路成分靶点网络
益气活血法在防治心脑血管疾病中具有重要意义,临床实践证实益气活血化瘀中药能有效防治血栓性疾病的发生与进展[8-9],并且通过动物实验明确其可以在抗血小板聚集、降低血液黏度、改善炎症状态等各方面发挥抗血栓作用[10-12]。本研究通过网络筛选得到西洋参、丹参组方活性成分和血栓性疾病靶点,构建含共同靶点的成分-靶点网络并进行富集通路分析,结果显示有34个活性成分可以直接作用于11个靶点,涉及10条疾病通路,其中与血栓性疾病最直接相关的通路是platelet activation(血小板活化),共16个活性成分作用于此通路中3个靶点。其中β-谷甾醇和罂粟碱来源于西洋参,实验证实β-谷甾醇具有抗炎作用[13],罂粟碱[14-15]具有扩张血管平滑肌的作用。丹参中作用于血小板活化通路14个成分主要为水溶性紫丹参素C和丹参酮类,包括隐丹参酮、丹参酮ⅡA、丹参酮ⅡB、二氢丹参酮、异丹参酮、丹参新酮、去氢丹参酮ⅡA、异丹参酮ⅡA、新隐丹参酮等,多项实验证实丹参酮、丹参素具有抗血小板聚集、改善炎症的作用[16-17]。
血小板活化通路富集的3个靶点分别是MAPK14,PRKACA,ITGB3。基因ITGB3编码产物是受体糖蛋白Ⅱb/Ⅲa(Glycoprotein Ⅱb/Ⅲa receptor,GPⅡb/Ⅲa),作为血小板膜表面的糖蛋白,其在膜表面大量表达是所有血小板激活通路最核心且最关键的一步,每个GPⅡb/Ⅲa有两个与纤维蛋白原结合位点,其激活后介导血小板与纤维蛋白原结合,促进血小板聚集形成血栓。GPⅡb/Ⅲa是抗血小板药物研发最核心的靶点,目前上市的阿昔单抗、依替巴肽、替罗非班临床疗效明确,但是剂型仅限于静脉制剂,且只在经皮冠状动脉介入(PCI)术中应用,在血栓性疾病的防治中略显局限。本研究发现34个活性成分中隐丹参酮能直接作用于此靶点,且具有较高的口服吸收利用度(52.34%)和类药性(0.396),推测隐丹参酮是西洋参、丹参组方合用发挥抗血栓的成分之一。另外,隐丹参酮还直接作用于MAPK14,推测其可能通过改善炎症状态从而发挥抗血栓作用。
MAPK14既是编码基因又是产物蛋白丝裂原活化蛋白激酶14(mitogen-activated protein kinase 14,MAPK14),也叫p38αMAPK,是p38MAPK家族一员,其在环境应激情况和促炎因子作用下发生磷酸化进入激活状态,激活MAP激酶激活蛋白激酶2(MAP kinase-activated protein kinase 2,MK2)后,通过HSP27、LSP1、CREB、COX-2、ATF1/2/6、SRF、TTP和STAT1、CHOP、MEF2A/C、GATA4、c-Myc、c-FOS等靶点底物介导下游应激相关的转录、细胞周期调节和遗传毒性应激反应。MAPK14是MAPK家族中在心脏发挥作用的主要形式,临床发现抑制其活性可以缓解缺血性心力衰竭急性损伤[18],并且在缺血再灌注中有保护心肌的作用[19],推测其可能具有调节受损心肌进行细胞分裂的作用。目前正在研发的针对MAPK14靶点的治疗心血管疾病的西药有Losmapimod、VX-702。本研究发现β-谷甾醇、罂粟碱、隐丹参酮、丹参酮ⅡA等12个活性成分可以直接作用于该靶点,提示这些成分可能具有调节炎症因子表达、调节心肌细胞凋亡等作用。
基因PRKACA是蛋白激酶A催化亚基α(catalytic subunit α of protein kinase A,PKA Cα)的编码基因,PKA最早由Fischer和Krebs发现并命名,因其激活需要依赖上游激酶通过第二信使cAMP实现,因此也称为依赖cAMP的蛋白激酶A。PKA是由2个调节亚基和2个催化亚基组成的四聚体,其起催化作用的亚基α(Cα)负责调节底物蛋白的磷酸化,主要在心血管疾病、癌症和某些内分泌紊乱疾病中发挥作用。有研究提出其磷酸化水平的异常升高会影响心肌正常的兴奋收缩耦联,导致长QT间期综合征、心律失常等心脏疾病,甚至发生心脏猝死[20]。心律不齐会引起血流动力学异常,尤其房颤时最易发生附壁血栓,血栓脱落后果严重,会引起各系统的栓塞,发生肺栓塞、脑卒中等严重不良事件,最严重的直接导致心脏猝死。本研究发现活性成分β-谷甾醇、丹参酮ⅡA、二氢丹参酮和去氢丹参酮ⅡA可以直接作用于PKA Cα,推测西洋参、丹参组方可能通过调节心肌兴奋收缩耦联改善心律不齐等会引起血栓形成的心脏节律疾病,间接发挥抗血栓作用。
本研究通过网络药理学方法分析西洋参、丹参组方活性成分及血栓靶点之间的关系,发现西洋参、丹参组方益气活血组方中生物碱、丹参酮是抗血栓的药效物质基础,通过抗血小板活化、抗炎、改善心肌细胞兴奋收缩耦联共同发挥抗血栓作用。为明确网络药理学虚拟筛选的结果的准确性,后续可进行文献挖掘和基础实验,完善对西洋参、丹参组方抗血栓物质基础与作用机制的研究。



