文登台 郑澜 田旭 林丽容 夏晓璇 吴端振
湖南师范大学体适能与运动康复湖南省重点实验室(湖南 长沙410012)
果蝇是唯一具有心脏的无脊椎动物, 许多调节人类心脏功能的重要基因与果蝇具有同源性, 如与心律失常有关的钙依赖蛋白激酶II (calcium dependent protein kinase II, CaMKII)基因[1]、与心脏收缩功能紊乱和心房颤动相关的热激蛋白23(Heat shock protein 23,HSP23)基因[2]、与心肌复极化有关的钾离子电压门控通 道 (potassium voltage -gated channel, KQT -like subfamily, member 1, KCNQ1)基因[3]等, 且果蝇生命周期短、基因组冗余程度低、遗传操作技术成熟。 因此,果蝇心脏不仅是心脏发育研究的理想模型, 近些年已成为研究成体和衰老心脏的重要材料[4,5]。
CG9940 是果蝇编码烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD) 合成酶的基因, 机体内可通过从头合成和补救途径完成NAD的生物合成, 在哺乳动物和人类中CG9940的同源基因为NAD合成酶1(NAD synthetase 1,NADSYN1),是补救合成途径中催化烟酸腺嘌呤二核苷酸 (nicotinic acid adenine dinucleotide, NAAD)合成NAD的必需酶[6]。 对NAD功能的研究发现,NAD不仅参与能量代谢,还与细胞衰老的进程和程度密切相关[7,8],运动对机体能量代谢的深刻影响提示CG9940基因可能在运动抗心脏衰老中发挥重要作用。 我们及Nicole Piazza等人利用果蝇负趋地性对其进行运动干预, 发现运动能延缓果蝇心脏功能的增龄衰退[9,10],在人类及脊椎动物中适宜耐力运动同样能够提高心肌收缩能力,射血分数[11],表明心脏的运动效应在人类和果蝇不同种属中具有相似性。本研究通过使CG9940基因过表达, 结合耐力运动干预,研究二者在心脏抗衰老中的作用及其相互关系。
1 材料与方法
1.1 果蝇品系、杂交及分组
CG9940过表达品系y[1]w[67c23]P{y[+m8]=Mae-UAS.6.11}CG9940[GG01267](购于美国Bloomington Drosophila Stock Center,品系号:14158),野生型W1118和arm-Gal4品系由湖南师范大学心脏发育中心馈赠。 通过arm-Gal4品系与y[1]w[67c23]P{y[+m8]=Mae-UAS.6.11}CG9940[GG01267]品系杂交,杂交后代可获得全身CG9940基因过表达[12,13]。
杂交方案为:y[1]w[67c23]P{y[+m8]=Mae-UAS.6.11}CG9940[GG01267]品系雌性果蝇分别与W1118或arm-Gal4品系雄性果蝇杂交, 收集前者杂交F1代8~12小时内羽化的处女蝇800只,随机分为2组:对照组、运动组;收集后者杂交F1代8~12小时内羽化的处女蝇800只,随机分为2组:过表达对照组、过表达运动组。 每组400只,20只/管,于HWS智能型恒温恒湿培养箱(宁波江南仪器厂制造)中,保持25℃温度、50%湿度,12小时昼∕夜循环饲养。
1.2 运动方案
采用自主研制的果蝇平台运动装置于果蝇30天龄时实施运动, 运动组和过表达运动组培养管底部的海绵距顶部绵塞8 cm作为果蝇逆重力攀爬运动区域,为排除平台震动的干扰, 训练期间对照组和过表达对照组试管底部海绵与绵塞间留出约1.5~2.5 mm距离,使果蝇随平台上下震动而不做攀爬运动。 训练时,4组均置于运动平台上, 运动频率由电机装置控制为24秒/转,每天运动2.5小时,连续5天[13]。
1.3 果蝇培养基
以配制6 L水的培养基为例(可按比例增减量),加热前先加入黄豆粉120.5 g, 酵母粉148.8 g和玉米粉504.0 g搅匀, 加热过程中再加入琼脂51.4 g直至沸腾。沸腾后停火,冷却过程中加入蔗糖和麦芽糖各369.6 g,麦芽糖要慢慢加入,防止成团,待蔗糖和麦芽糖充分溶解后,加入丙酸20 ml、对羟基苯20 g溶于200 ml无水乙醇,充分搅拌后立即分装于洁净的培养试管中,每管培养基厚度为0.5~1.0 cm。
1.4 指标检测
1.4.1 实时荧光定量PCR检测
将100mg(10只果蝇)组织样品研为匀浆,用Tripure试剂(Roche公司)提取RNA,然后用RNeasey mini spin cloumn试剂盒(Qiagen公司)对RNA进行纯化,用紫外分光光度计(美国Amersham Biosciences 公司)定量,引物使用Premiers5.0软件设计, 并经NCBI BLAST基因库检索验证,与其他基因无高度同源性,以rp49 基因为内参。 引物由上海生物工程生物制品有限公司合成、纯化。 其序列如表2,取2 μl RNA,逆转录为cDNA,PCR扩增后用2% 的琼脂糖电泳鉴定。
取稀释后的反转录产物5 μl,加入SYBRRPremix Ex Taq(2×)15 μl(Takara)、PCR Forward Primer(10μM) 1 μl、PCR Reverse Primer (10uM)1 μl、ROX 0.6 μl、ddH2O 7.4 μl,总体系30 μl,分三个重复孔,每孔10 μl。 反应条件:95℃变性30 s,95℃5 s,60℃30 s,40个循环。 反应结束,由熔点曲线判定PCR 反应的特异性, 根据荧光曲线的Ct 值以及标准曲线计算定量结果,检测在ABI 7900HT(美国应用生物系统公司)中进行。 计算基因相对表达值以及根据相对表达值计算平均过表达量, 过表达率=(过表达组-对照组)/对照组(均为平均过表达量)。
1.4.2 M-mode心动图检测心脏功能的变化
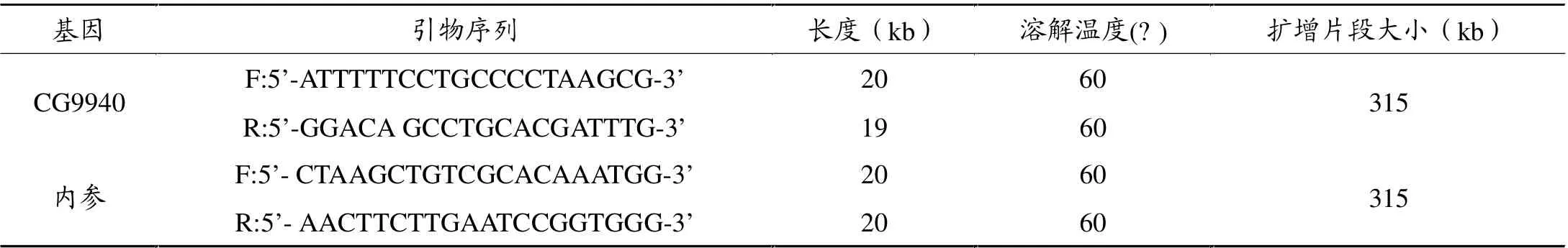
表1 引物及内参设计
将果蝇置于麻醉瓶 (内含三酰胺麻醉剂,FlyNapTM)麻醉5 min,在一个直径为2cm透明培养皿底部均匀涂上薄层凡士林,用镊子将麻醉果蝇腹部朝上,使其背部和翅膀粘于凡士林上, 倒入氧化的果蝇人工血淋巴(人工血淋巴:果蝇血淋巴配剂、蔗糖、海藻糖按照8∶1∶1的比例制成,4℃保存), 在体视-冷光源显微镜下,去除果蝇头部、腹侧胸腔和腹部表皮,用微细玻璃管吸去内脏及脂肪组织,暴露心管,采用EM-CCD高速摄像机(日本HAMAMATS公司)镜下拍摄果蝇心脏跳动显微影像,拍摄时长为20 s,频率为130帧/秒,利用HC-Image 软件记录并处理视频数据,采用半自动光学心动分析软件 (Semi-automatic Optical Heartbeat Analysis software,SOHA, 由美国伯纳姆医学研究所神经学和衰老中心Karen Ocorr和Rolf Bodmer教授惠赠)量化分析果蝇第35天龄心管收缩时间、收缩直径、舒张直径、射血分数、舒张功能不全指数和心律失常指数,平均收缩速度=(舒张直径-收缩直径)/收缩时间。
1.4.3 运动能力检测
采用NV-GS400摄像机(日本Panasonic公司)于果蝇第35天龄拍摄果蝇震落至培养瓶底部后的负趋地性爬行的行为学特征,测量攀爬指数评定果蝇运动能力[9],拍摄时间为17︰00到18︰00。
1.4.4 生命周期检测
每组取200只果蝇,从第40天龄开始,在每天的18︰00至19︰00观察并记录果蝇死亡数, 直到各组果蝇全部死亡为止,制作果蝇存活曲线。 全部果蝇寿命的算术平均数为果蝇的平均寿命,平均延寿命率(%)=(运动组或过表达对照组或过表达运动组平均寿命-对照组平均寿命)/对照组平均寿命×100%。统计各组果蝇平均寿命、最高寿命和平均延寿率[9]。
1.4.5 统计学处理
为研究耐力运动、CG9940基因过表达以及二者联合干预对中老龄果蝇的影响,实验完全随机设计分组,分为对照组、运动组、过表达对照组和过表达运动组,重复测量四组数据并进行差异比较, 采用单因素方差分析中LSD分析进行多重比较,若方差不齐则用非参数检验单因素分析, 实验数据用均数±标准差 (± s)表示,显着性水平取α=0.05。
2 结果
2.1 CG9940 mRNA实时荧光定量PCR检测结果
过表达对照组CG9940 mRNA 过表达率为155.2%(P<0.01), 过表达运动组的过表达率为152.0%(P<0.01)。 如图1。
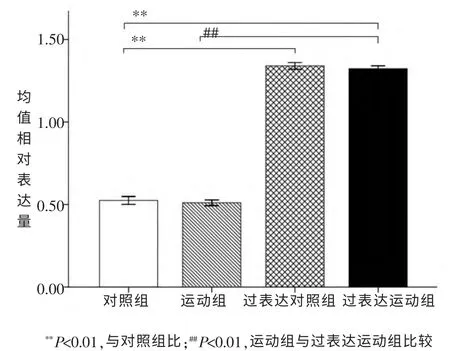
图1 果蝇CG9940 mRNA表达量qRT-PCR检测结果
2.2 果蝇心脏M-mode检测结果
与对照组相比,运动组心率降低(P<0.01),射血分数增大(P<0.01),舒张功能不全指数降低(P<0.05),心律失常指数有减小的趋势(P=0.31)。 见表2。
与对照组相比,过表达对照组心率降低(P<0.05),射血分数增大(P<0.01),心律失常指数有减小的趋势(P=0.34)。 见表2。
与对照组相比,过表达运动组心率降低(P<0.01),心脏平均收缩速度增大(P<0.05),射血分数增大(P<0.01),舒张功能不全指数减小(P<0.01),心律失常指数降低(P<0.05);与运动组相比,过表达运动组心率降低(P<0.05),射血分数增大(P<0.01),舒张功能不全指数减小(P<0.05);与过表达对照组相比,过表达运动组心率降低(P<0.05),射血分数增大(P<0.05),舒张功能不全指数减小(P<0.01)。 见表2。
2.3 果蝇攀爬能力测量结果
中老龄果蝇攀爬指数对照组为2.14 ± 1.60,运动组为2.70 ± 2.15,过表达对照组为2.30 ± 1.66,过表达运动组为3.00 ± 1.99。 其中运动组高于对照组(P<0.05);过表达运动组高于对照组 (P<0.01) 和过表达对照组(P<0.05)。 如图2。

表2 果蝇心脏功能相关指标检测结果

图2 果蝇攀爬指数测量结果
2.4 果蝇生命周期统计结果
运动组寿命高于对照组(P<0.05);过表达对照组寿命高于对照组(P<0.01); 过表达运动组寿命高于对照组(P<0.01)、高于运动组(P<0.01)和过表达对照组(P<0.05),过表达对照组的平均延寿率为6.8%,过表达运动组平均延寿率为11.5%,对照组、运动组、过表达对照组和过表达运动组最高寿命分别是67、67、77和78天。 见表3、图3。
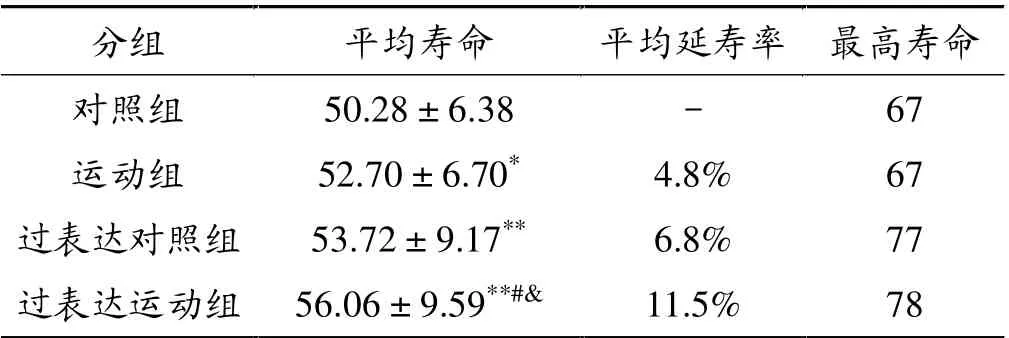
表3 果蝇生命周期测量结果
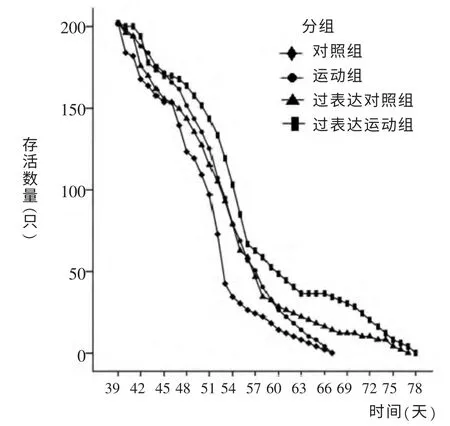
图3 果蝇存活数量随时间变化曲线图
3 讨论
3.1 耐力运动联合CG9940基因过表达对中老龄果蝇心脏收缩功能的影响
流行病学研究表明衰老会降低心肌收缩能力,增加心率失常的发生, 导致心脏衰竭和猝死风险的上升[14]。 而中等强度耐力运动可提高线粒体呼吸链氧化酶还原型辅酶 (reduced form of nicotinamide-adenine dinucleotid,NADH)、 细 胞 色 素 氧 化 酶(cytochrome oxidase,CCO)含量和活性,增加心肌氧化磷酸化能力及能量代谢能力[15]。 此外,耐力训练能够预防心脏衰竭导致的更严重局部缺血和再灌注损伤[16],对心脏起保护作用。 CG9940是果蝇NAD合成酶基因,能催化NAAD合成NAD[6],是NAD拯救合成途径的关键步骤,NAD与能量代谢密切相关,作为氧化还原反应的辅酶,在糖酵解、糖异生、三羧酸循环和呼吸链中发挥着不可替代的作用, 其中间产物会将脱下的氢递给NAD, 使之成为NADH,而NADH则会作为氢的载体,在呼吸链中通过化学渗透偶联的方式,合成ATP[7]。 本研究发现耐力运动和CG9940基因过表达均能降低老年果蝇安静时心率,提高射血分数,对改善中老年果蝇心脏功能产生类似效应,其机制可能与心肌细胞NAD含量和活性升高,进而改善心肌能量代谢有关。 但由于耐力运动后CG9940 mRNA表达量未见增加,运动和CG9940基因过表达二者对于衰老心脏功能的改善可能存在不同的机制。 CG9940基因过表达的老龄果蝇进行耐力训练后,与运动或CG9940基因过表达相比, 心率降低更明显,心肌收缩能力和心脏泵血能力提高更显着, 说明二者联合对老龄心脏的维护产生了叠加效应, 能更好保护心脏功能,其作用机制还需进一步研究。
3.2 耐力运动联合CG9940基因过表达对中老龄果蝇心脏节律的影响
心脏舒张功能不全会导致心脏舒张性心力衰竭,肥胖、冠心病、高血压、糖尿病等因素能引起心脏舒张功能障碍,而衰老是其中重要的影响因素[17]。 衰老的心脏会表现出舒张功能的紊乱和心肌僵硬, 与间质纤维化和胶原蛋白交联的增加密切相关,从而破坏心脏Ca2+的内稳态,导致心脏舒张功能不全[18]。 心脏起搏部位、心搏频率和节律以及冲动传导的任一异常可致心律失常,可由各种气质性心血管病、药物中毒、电解质和酸碱平衡失调等因素引起, 部分心率失常也可因植物神经功能紊乱所致[19]。 伴随衰老的加剧,心律失常会变得越来越严重,预示着各种心脏疾病如冠心病、肺心病和猝死等风险将升高[20]。 尽管耐力运动能够显着降低老龄果蝇的舒张功能不全指数,但运动和CG9940基因过表达对心律失常的降低并不明显,进一步的研究表明,在CG9940基因过表达条件下进行耐力运动,对降低中老龄果蝇心律失常和舒张功能不全指数有显着效果。需指出的是, 本研究中果蝇取材时去除了头部且心脏被置于人工淋巴液中,神经和激素调控被阻断,得出的是心脏固有肌源性心律失常[1]。 而在完整的果蝇中,心律失常与神经和激素调节功能紊乱有关[21-23]。有研究表明心肌细胞内肌浆网钙-ATP酶2a的表达下降、 活性减低,导致肌浆网对钙离子摄取能力下降,是造成心脏舒张和收缩异常的主要原因[24],细胞内高水平的NAD活性和含量满足中老龄心脏对NAD代谢需求, 有三种消化酶能分解代谢NAD,cADP-核糖合酶是其中一种,它是一对胞外酶, 常被人们称做白细胞抗原38(Cluster Differentiation 38,CD38[25])和CD157[26]淋 巴 细 胞 抗 原,CD38能催化烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide Adenine Dinucleotide Phosphate, NADP) 和Na间的碱基交换,形成能水解底物的Na-ADP[27],并且CD38的所有产物在钙离子的激活中都有一定作用, 充足NAD被CD38分解代谢,其产物对心脏钙离子的激活可能保证心肌自律性正常, 也对衰老心脏舒张功能性障碍表现出很强抵抗作用,能有效预防其导致的心脏衰竭,这可能与CG9940基因过表达条件下进行耐力运动能显着降低中老龄果蝇心律失常和舒张功能不全指数有关。
3.3 耐力运动联合CG9940基因过表达对中老龄果蝇运动能力和寿命的影响
在研究中老龄心脏功能的同时, 本研究也探讨了运动及CG9940基因过表达对中老龄果蝇运动能力及寿命的影响, 结果表明耐力运动可提高老龄果蝇运动能力,但NAD合成酶CG9940基因过表达对中老龄果蝇运动能力提高不明显, 这可能与运动能力测量采用的指标是逆重力攀爬指数有关, 此方法可能受限于果蝇逆重力感官能力, 有研究表明果蝇逆重力特征随着衰老而减弱[28],所以我们推测长期耐力运动使果蝇延缓逆重力特性衰退,而NAD合成酶CG9940基因过表达尽管有利于能量代谢, 但不能有效抵抗中老年果蝇逆重力特性退化,运动能力随之降低。 结果也表明CG9940基因过表达能够促进耐力运动对中老龄果蝇运动能力保持,且其效果要优于只进行耐力运动。 此外,我们发现果蝇NAD合成酶基因CG9940过表达可显着延长果蝇寿命。近些年的研究表明NAD不仅参与能量代谢,它自身分解代谢还与细胞衰老的进程和程度密切相关,特别是沉默信息调节因子sirtuins (Sir2-related enzymes, sirtuins)家族的发现及其与细胞寿命关系的证实[29-31],人类的sirtuin6是sirtuins家族成员,具有NAD依赖的去乙酰化酶活性[8],研究表明NAD+水平高低直接决定sirtuins 家族活性, 而sirtuins活性又对细胞寿命有着重要的影响[32],并且NAD+和端粒也存在重要关系,被认为和细胞衰老有着重要的联系, 原因是sirtuin6调节端粒状态,并且由NAD+的激活[33]。 由于CG9940基因是编码NAD合成的重要限速酶,因此我们认为CG9940过表达导致果蝇寿命的延长与NAD的生物合成有关。目前关于运动是否有益于寿命报道不一,Rebeca Garcia-Valles等人[34]的研究表明大鼠终身自发运动能够提高大鼠生活质量却不能增进寿命,而郑澜等人[9]的研究表明适宜运动能够有效延长果蝇生命周期, 我们的研究表明耐力运动能够提高果蝇平均寿命, 运动能否延长寿命与运动类型、 个体遗传背景等有关。 在CG9940过表达的背景下,耐力训练对老龄果蝇生命周期的延长要更显着, 说明该基因过表达不仅能延长果蝇寿命,对运动延寿也产生促进作用,其机制仍然可能与更高水平NAD活性及含量对sirtuins活性、 端粒状态产生有利影响, 延缓老龄果蝇细胞衰老进程和程度有关,但究竟是过表达还是耐力运动影响更佳,具体机制还需进一步研究。
4 结论
耐力运动的干预能够提高中老年果蝇运动能力并且对延缓心脏功能性衰退和增进生命周期有一定作用;NAD合成酶基因CG9940过表达能够延缓果蝇心脏衰老,显着延长果蝇寿命;耐力运动联合CG9940基因过表达对降低中老龄果蝇心率失常和舒张功能不全,防止心脏衰竭有更为明显的效果, 同时能增强中老龄果蝇逆重力攀爬特征,提高活动能力,并且延寿效果更好,表明二者对中老龄果蝇抗衰老产生了叠加效应。
[1] Santalla M, Valverde CA, Harnichar E, et al. Aging and CaMKII alter intracellular Ca2+transients and heart rhythm in Drosophila melanogaster[J]. PLoS One. 2014, 9(7): e101871.
[2] Zhang D, Ke L, Mackovicova K, et al. Effects of different small HSPB members on contractile dysfunction and structural changes in a Drosophila melanogaster model for Atrial Fibrillation [J]. J Mol Cell Cardiol. 2011, 51 (3):381-389.
[3] Ocorr K, Reeves NL, Wessells RJ, et al. KCNQ potassium channel mutations cause cardiac arrhythmias in Drosophila that mimic the effects of aging [J]. PNAS, 2007, 104(10):3943-3948.
[4] Diop SB, Bodmer R. Drosophila as a model to study the genetic mechanisms of obesity-associated heart dysfunction[J]. J Cell Mol Med, 2012, 16(5): 966-971.
[5] Nishimura M, Ocorr K, Bodmer R, et al. Drosophila as a model to study cardiac aging [J]. Exp Gerontol, 2011, 46(5):326-330.
[6] Wojcik M, Seidle HF, Bieganowski P, et al. Glutaminedependent NAD synthetase: How a two -domain, three -substrate enzyme avoids waste.[J]. J Biol Chem, 2006, 281:33395-33402.
[7] 张蕴琨,丁树哲.运动生物化学[M].北京:高等教育出版社,2006,39-58.
[8] Liu TF, Vachharajani VT, Yoza BK, et al. NAD+-dependent sirtuin 1 and 6 proteins coordinate a switch from glucose to fatty acid oxidation during the acute inflammatory response[J].J Biol Chem, 2012, 287(31): 25758-25769.
[9] 郑澜,王小月,吴越,等.不同运动方案对果蝇运动能力、生命周期及心脏功能的影响[J].中国运动医学杂志,2013,31(7):611-616.
[10] Piazza N, Gosangi B, Devilla S, et al. Exercise-training in young Drosophila melanogaster reduces age-related decline in mobility and cardiac performance [J]. PLoS ONE, 2009, 4(6):e5886.
[11] Kemi OJ, Ellingsen O, Smith GL, et al. Exercise-induced changes in calcium handling in left ventricular cardiomyocytes [J]. Frontiers in Bioscience, 2008, 13: 356-368.
[12] Polaski S, Whitney L, Barker BW, et al. Genetic analysis of slipper/Mixed lineage kinase reveals requirements in multiple Jun -N -terminal kinase -dependent morphogenetic events during Drosophila development [J]. Genetics, 2006, 174(2):719-733.
[13] R?rth P, Szabo K, Bailey A, et al. Systematic gain-offunction genetics in Drosophila [J]. Development, 1998, 125:1049-1057.
[14] Lakatta EG. Heart Aging: A Fly in the Ointment? [J].Circulation Research, 2014, 88: 984-986.
[15] Davidson SR, Burnett M, Hoffman-Goetz L. Training effects in mice after long-term voluntary exercise [J]. Med Sci Sports Exerc, 2006, 38: 250-255.
[16] Erbs S, H?llriegel R, Linke A, et al. Exercise training in patients with advanced chronic heart failure (NYHA IIIb)promotes restoration of peripheral vasomotor function,induction of endogenous regeneration, and improvement of left-ventricular function [J]. Circ Heart Fail, 2010, 3: 486-494.
[17] Kass DA, Bronzwaer JG, Paulus WJ. What mechanisms underlie diastolic dysfunction in heart failure?[J]. Circ Res,2004, 94: 1533-1542.
[18] Ouzounian M, Lee DS, Liu PP. Diastolic heart failure:mechanisms and controversies [J]. Nat Clin Pract Cardiovasc Med, 2008, 5: 375-286.
[19] Said M, Becerra R, Valverde CA, et al. Calcium-calmodulin dependent protein kinase II ( CaMKII) : a main signal responsible for early reperfusion arrhythmias [J]. J Mol Cell Cardiol, 2011, 51 ( 6 ): 936-944.
[20] McLennan PL, Abeywardena MY. Membrane basis for fish oil effects on the heart: linking natural hibernators to prevention of human sudden cardiac death [J]. Membrane Biol, 2005, 20(6): 85-102.
[21] Dulcis D, Levine RB. Glutamatergic innervation of the heart initiates retrograde contractions in adult Drosophila melanogaster[J]. J Neurosci. 2005; 25(2):271-280.
[22] Dulcis D, Levine RB, Ewer J. Role of the neuropeptide CCAP in Drosophila cardiac function [J]. J Neurobiol. 2005, 64(3):259-274.
[23] Johnson E, Ringo J, Dowse H. Native and heterologous neuropeptides are cardioactive in Drosophila melanogaster[J].J Insect Physiol, 2000, 46(8): 1229-1236.
[24] AraiM. Function and regulation of sarcoplasmic reticulim Ca2+-ATPase. Jpn Heart J, 2000, 41: 12-13.
[25] Olgun A. Converting NADH to NAD + by nicotinamide nucleotide transhydrogenase as novel strategy against mitochondrial pathologies during aging [J]. Biogerontology,2009, 10(4): 531-534.
[26] Howard M, Grimaldi JC, Bazan JF, et a1. Formation and hydrolysis of cyclic ADP -ribose catalyzed by lymphocyte antigen CD38[J]. Science, 1993, 262(5136): 1056-1059.
[27] Aarhus R, Graeff RM, Dickey DM, et a1. ADP-bosyl cyclase and CD38 catalyze the synthesis 0f a calcium-nobilizing metabolite from NADP [J]. J Biol Chem, 1995, 270(51):30327-30333.
[28] Rhodenizer D, Martin I, Bhandari P, et al. Genetic and environmental factors impact age -related impairment of negative geotaxis in Drosophila by altering age-dependent climbing speed[J]. Exp Gerontol, 2008, 43: 739-748.
[29] Mitchell SJ, Martin-Montalvo A, Mercken EM, et al. The SIRT1 activator SRT1720 extends lifespan and improves health of mice fed a standard diet [J]. Cell Rep, 2014, 6(5):836-843.
[30] Kanfi Y, Naiman S, Amir G, et al. The sirtuin SIRT6 regulates lifespan in male mice [J]. Nature, 2012, 483(7388):218-221.
[31] Hubbard BP, Sinclair DA. Small molecule SIRT1 activators for the treatment of aging and age-related diseases[J]. Trends Pharmacol Sci, 2014, 35(3):146-154.
[32] Koubova J, Guarente L. How does calorie restriction work[J].GenesDev, 2003, 17(3): 313-321.
[33] Michishita E, Mc Cord RA, Berber E, et al. SIRT6 is a histone H3 lysine 9 diacetylase that modulates telomeric chromatin[J]. Nature, 2008, 452(7186): 492-496.
[34] Garcia-Valles R, Gomez-Cabrera MC, Rodriguez-Ma?as L, et al. Life-long spontaneous exercise does not prolong lifespan but improves health span in mice[J]. Longevity & Healthspan,2013, 14(2):1-12.



