李欣 丁树哲 卢健
1华东师范大学体育与健康学院(上海 200241)
2绵阳师范学院体育与健康教育学院(四川绵阳 621000)
心肌sarcopenia是一种随年龄增加而出现的心肌细胞减少和心血管功能减退的一种老年病征[1]。其主要特征为心肌细胞数量减少、剩余心肌细胞代偿性肥大、以左心室变化为主的心血管功能的减退[1]。衰老心肌细胞有从生理性的代偿性肥大向病理性的失代偿性肥大发展的趋势[2],是发生心肌 sarcopenia 的重要机制之一[1]。最能区分生理性和病理性心脏肥大的特征性信号通路是Gaq和PI3-K信号通路,PI3K/Akt/mTOR信号通路主要在生理性代偿性肥大过程中起到主导地位,在心肌向病理性肥大转化过程中,该信号通路表达降低[3]。目前的研究证实运动可以通过对该通路的影响来正性对抗心肌细胞向病理性肥大转化的表型[4],但关于运动对衰老心脏PI3K/Ak/mTOR信号通路的研究较少,其作用机制仍不清楚。本研究通过建立衰老小鼠耐力训练模型,采用实时荧光定量PCR技术观察耐力训练后衰老小鼠心肌Akt/mTOR通路中 Akt、mTOR、p70S6K和eIF-4E基因表达的变化,探讨耐力训练对衰老心脏Akt/mTOR信号通路的影响机制。
1 材料与方法
1.1 实验动物及分组
健康雄性SAMP8小鼠36只(由天津中医药大学动物中心提供,合格证号:W-J津实动质M准字第006号,2月龄),体重为17.98±0.82g。实验在华东师范大学运动生物化学实验室进行,室温20~22℃,相对湿度45~50%,昼夜节律人工控制光照,光照时间为12h/d。小鼠按体重分层后随机分为年轻对照组(young control group,YC组)、耐力训练组(endurance training group,E组)和老年对照组(aging control group,AC组),每组 12只。各组均以国家标准啮齿类动物饲料(由中国科学院上海实验动物中心提供)饲养,自由取食及饮水。每周观察小鼠的一般状况,测量饮食量和体重,用以监控建模过程。
1.2 运动模型建立
YC组饲养至3月龄时处死;在Reznick研究基础上[5],结合 Fernando 的运动模型[6],E 组小鼠在 DSPT~202型电动鼠类跑台上进行适应性训练1个月,每周5次,每次训练20min,速度为10m/min。正式跑台训练从3月龄开始,每周3次,每次40min,包括5m/min的热身(5min),15m/min的耐力训练(30min),5m/min的放松(5min),持续训练3个月。训练在晚上18点到20点间进行,不使用光、电等刺激手段,训练至6月龄时处死;AC组小鼠也同时在此环境中自由活动,饲养至6月龄,到达衰老时处死。
1.3 实验取材及组织准备
动物建模结束后24小时内,每组随机选取4只小鼠,0.4%戊巴比妥钠0.3ml腹腔麻醉后,开胸暴露心脏,针头从心尖部插入左心室后快速滴注肝素化的生理盐水(500ml生理盐水中含有肝素2ml),剪断后腔静脉,滴完生理盐水后,再快速滴注4%的多聚甲醛缓冲盐溶液500ml。常规酒精梯度脱水、二甲苯透明、浸蜡,石蜡包埋,切片,切片厚度为 5μm,放入 37℃恒温箱烤干,待用。其余小鼠断头处死后取出心脏修剪,将心脏沿冠状面切开,滤纸吸干心脏表面的液体后称重,计算心系数(心系数=心脏重量/体重);固定液中固定24h后,用锡箔纸包裹、标记后放入液氮中,于-80℃低温冰箱保存待用。
1.4 总mRNA提取及RT-PCR
取心脏组织块50~100g,用液氮在研钵中加Trizol研磨成粉末状后移入离心管中,冰上孵育5分钟后加0.2ml氯仿,震荡,冰上孵育5分钟后 12000g,4℃离心15分钟,取上清液移至新离心管,加0.5ml异丙醇,震荡,冰上孵育5分钟后12000g,4℃离心10分钟,弃上清液,加入1ml 75%乙醇,震荡后7500g,4℃离心5分钟,弃上清液后室温下使之干燥,加入DEPC处理水10μl溶解RNA。琼脂糖凝胶电泳检测完整性后,使用RT-PCR,将mRNA反转录成cDNA待用。使用逆转录试剂盒(Farmentas MBI),并按试剂盒说明书进行操作。加4μl RNA样品于冰上放置的 EP管中,1μl的 oligo(dT),加无菌无酶水至总体积为 12μl。混匀后离心 5s,70℃温浴 5min,再于冰上按 顺 序 加 入 :4μl5 ×buffer,1μlRNasin(20U/μl),2μl 10mMdNTP mix。混匀后短暂离心。37℃孵育。加 1μl的M-MLV(200U/μl),至反应终体积为 20μl。42℃孵育 1h,70℃温浴10min,冰上放置。产物-20℃保存。
1.5 设计合成引物
从美国国家生物信息中心的序列资料库(Gene Bank)查找小鼠 Akt、mTOR、p70S6K、eIF-4E(目的基因)及小鼠 β-肌动蛋白(β-actin,内参照)基因序列,应用Primer Express 3.0软件设计引物,由上海捷瑞生物公司合成(表1)。

表1 实时荧光定量PCR检测引物序列及相关参数Table 1 Sequence of primer and its related parameters
1.6 Real-Time PCR反应
Applied Biosystems StepOneTMReal-Time PCR反应体系中含 SYBR Premix ExTaq TM10μl(内含 DNA聚合酶、Buffer、dNTP、SYBR Green)、上游引物 1μl、下游引物 1μl、目标 cDNA 模板 2μl、无 RNA 酶的蒸馏水 6μl,总体积为 20μl。反应参数:95℃变性 10min,95℃20s,59℃20s,40个循环,随后从65℃至95℃每隔1℃记录一次荧光值,获得融解曲线。系统自动测定的指标有检测样品CT值、△CT值、△△CT值和融解曲线。使用β-actin作为内参基因,将所测得的 Akt、mTOR、p70S6K和 eIF-4E基因的相对拷贝数除以内参基因拷贝数,再取常用对数后进行统计学分析:T=log2(目的基因拷贝数/内参基因拷贝数)[7]。
1.7 统计学分析
采用SPSS11.0统计软件对组间数据进行单因素方差分析,P<0.05表示有显着性差异。所有数据以均数±标准差表示。
2 结果
2.1 心脏重量及心系数
由表2可知,YC组小鼠心脏重量和心系数显着高于AC组(P<0.05)。E组小鼠心脏重量和心系数较AC组显着增大(P<0.05),但体重没有明显差异。E组小鼠心脏重量和心系数低于YC组,但没有统计学意义(P>0.05)。
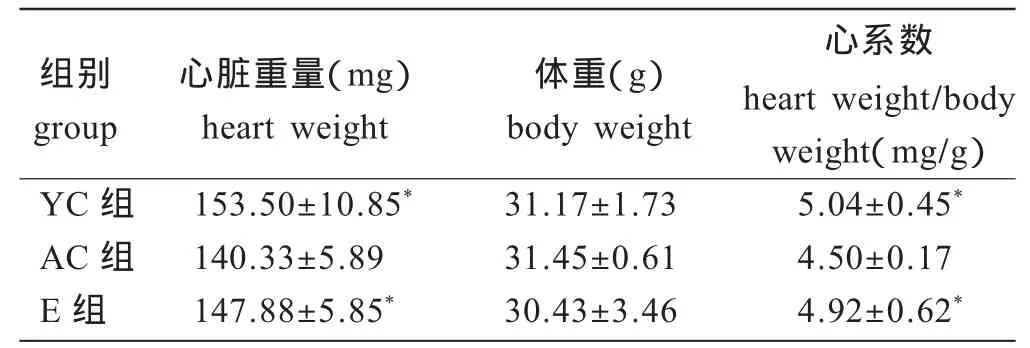
表2 小鼠心脏重量与心系数的变化(n=12)Table 2 Change in heart weight and heart weight/body weight in mice
2.2 心肌组织HE染色
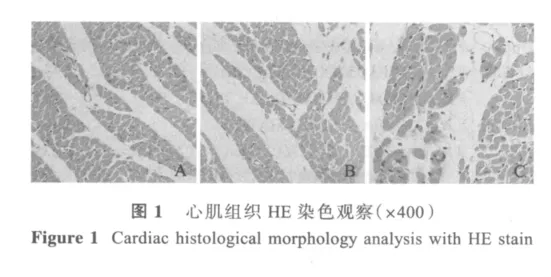
HE染色(图1)显示:YC组心肌纤维结构清晰,着色均匀,细胞核呈卵圆形,核大小均匀,位于心肌纤维的中央(图1A)。AC组小鼠心肌横截面空白区域较YC组增大,但心肌纤维结构清晰,细胞核染色清晰,未见细胞核溶解、局限性间质水肿等病理性改变(图1B)。E组小鼠心肌横截面空白区域较YC及AC组增大,但心肌纤维结构清晰,细胞核染色清晰,未见变性及坏死现象(图1C)。
2.3 Akt/mTOR通路基因表达
表3显示,AC组小鼠心肌 Akt、mTOR、p70S6K和eIF-4E mRNA表达水平与YC组相比显着下降(P<0.05);耐力训练后E组小鼠心肌Akt、mTOR、p70S6K和eIF-4E mRNA表达水平与AC组相比显着增强(P<0.05);耐力训练后E组小鼠心肌Akt、mTOR、p70S6K和 eIF-4E mRNA表达水平与YC组相比,表达有所下降,但不具有统计学意义(P>0.05)。
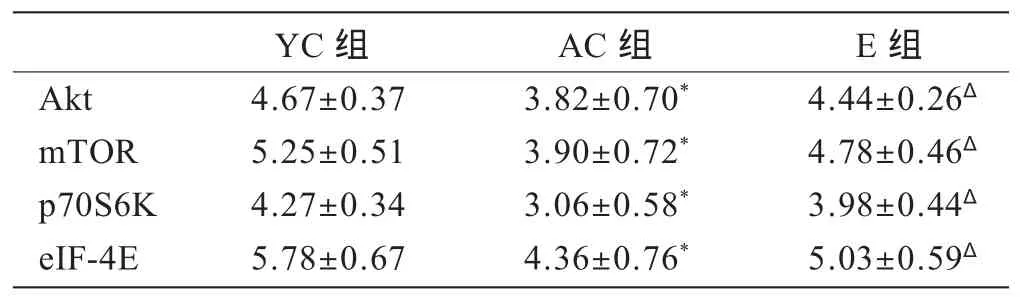
表3 各组小鼠心肌Akt、mTOR、p70S6K和eIF-4E mRNA表达比较(n=8)Table 3 The mRNA expression of cardiac Akt,mTOR,p70S6K and eIF-4E of each group
3 讨论
3.1 耐力训练与运动性心肌肥大
心系数是反映心肌肥大的重要指标。一般认为,运动性心肌肥大是心脏对运动训练的适应性反应,是一种生理性心脏重塑的过程。本实验结果显示,耐力训练后衰老小鼠心脏重量及心系数增加,与AC组相比具有显着性差异,且小鼠心肌细胞及结缔组织未出现病理性改变,表明耐力训练诱导了衰老小鼠运动性心肌肥大的形成。器官体积的增大原因包括:细胞数目的增多和细胞体积的增大,而成熟的心肌细胞基本丧失分化、繁殖的能力,因此E组小鼠心脏发生肥大的主要原因是由于心肌细胞体积的增大,提示心肌细胞蛋白合成增加。
3.2 Akt/mTOR信号通路与心肌细胞肥大
研究表明,Akt/mTOR信号通路激活蛋白质翻译,调节蛋白质合成,是细胞生长的中心调控者,在决定细胞、组织及器官大小中发挥重要作用[8]。激活的Akt主要通过促进哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)来发挥促细胞生长生存功能。mTOR的激活是心肌细胞蛋白合成的直接因素,其主要下游作用靶物质包括核糖体S6蛋白激酶(p70S6K)和真核翻译起始因子eIF-4E结合蛋白[9]。p70S6K活化后能够磷酸化激活S6蛋白,提高核糖体蛋白、延伸因子、polyA结合蛋白等的翻译效率,进而调控 5’TOP(5’terminal oligopyrimidine tract)mRNA翻译蛋白的起始,有利于蛋白质合成[10]。eIF4E的水平和活性决定了核糖体与mRNA结合的速度,在帽依赖性翻译的调节中起中心作用,是蛋白合成过程的一种限速蛋白。mTOR通过调控eIF4E和p70S6K这两条不同的下游通路,分别控制特定亚组mRNA的翻译。在本实验中,AC组小鼠心脏重量和心系数低于YC组的结果表明,衰老小鼠的心脏重量下降。结合形态学的检测,我们认为,其主要原因是心肌细胞凋亡引起的心肌细胞流失和蛋白合成效率降低,使心肌纤维质量下降。结合本实验Akt/mTOR通路各靶基因的表达均明显低于 YC组的结果,提示 Akt、mTOR、p70S6K和eIF-4E在心肌蛋白合成中具有重要作用,而整个Akt/mTOR信号通路各信号分子的表达随衰老而降低,从而使衰老小鼠心肌细胞蛋白合成效率降低。
3.3 耐力训练对心肌Akt/mTOR信号通路的影响
本实验发现,E组小鼠在耐力训练后,产生了运动性心肌肥大,且Akt/mTOR信号通路中各靶物质的mRNA表达较AC组明显增加,提示Akt/mTOR信号通路与运动性心肌肥大有关;E组小鼠心肌纤维的增粗提示心肌蛋白合成增加,而Akt和mTOR表达明显增强,说明耐力训练可以提高Akt和mTOR的活性。有报道指出,mTOR不仅可以由Akt激活,运动更是独立增加mTOR生成的主要因素[11]。由于本实验中未使用Akt的阻断剂,故无法判断mTOR mRNA表达的增高是否是由运动单独引起的。使用雷帕霉素可以阻断mTOR及其下游的p70S6K和 4E-BP1的活化,几乎完全(95%)阻断了肌肉肥大[12],表明在肌肉适应性肥大过程中需要mTOR及其下游p70S6K和eIF4E的作用。本实验E组小鼠心肌p70S6K和eIF4E mRNA表达均明显增强,提示耐力训练可以通过激活mTOR的表达,增强心肌p70S6K和eIF4E的活性,证明p70S6K和eIF4E在心肌肥大过程中扮演了重要角色。目前对于Akt/mTOR信号通路研究更多的集中于骨骼肌,一般认为耐力运动的刺激选择性激活AMPK通路,从而抑制mTOR信号通路[13]。由于运动、营养缺乏或缺氧等因素引起AMPK含量升高,激活的AMPK能够降低蛋白质的合成而节约能量消耗,或通过AMPK磷酸化激活TSC2而间接抑制mTOR的活性[14]。我们的实验证明了耐力训练后心肌mTOR信号通路实际上是处于一种被激活的状态,也从侧面表明在心肌和骨骼肌中,耐力训练对Akt/mTOR蛋白合成信号通路的影响不同,心肌对于耐力训练所产生的蛋白适应性合成增加主要通过mTOR信号通路。综合整个实验结果,我们认为,耐力训练可以促进衰老小鼠Akt和mTOR蛋白的活性,从而使p70S6K和eIF4E的表达增强,促进翻译起始和增加蛋白合成,使心肌纤维肥大,产生运动性心肌肥大。
4 总结
耐力训练后,衰老小鼠心脏组织结构正常,未见病理性改变;心脏绝对重量和心系数发生显着性增加,表明小鼠发生了运动性心肌肥大;心脏Akt、mTOR、p70S6K和eIF-4E表达增加,表明耐力训练可激活心脏Akt/mTOR信号通路。耐力训练可以通过心脏对Akt/mTOR通路的作用,提高整个信号通路中各信号分子的表达,从而使衰老心脏发生生理性的运动性心肌肥大。
[1]Jing Lin,Elizabeth FL,Yufang Jin,et al.Age-related cardiac muscle sarcopenia:Combining experimental and mathematical modeling to identify mechanisms.Experimental Geron tology,2008,43(4):296-306.
[2]Rodríguez-Calvo R,Serrano L,Barroso E,et al.Peroxisome proliferator-activated receptor alpha down-regulation is associated with enhanced ceramide levels in age-associated cardiac hypertrophy.J Gerontol A Biol Sci Med Sci,2007,62(12):1326-36.
[3]Kemi OJ,Ceci M,Wisloff U,et al.Activation or inactivation of cardiac Akt/mTOR signaling diverges physiological from pathological hypertrophy.Cell Physiol,2008,214(2):316-21.
[4]Lee YI,Cho JY,Kim MH,et al.Effects of exercise training on pathological cardiac hypertrophy related gene expression and apoptosis.Eur J Appl Physiol,2006,97:216-224.
[5]Reznick AZ,Steinhagen-Thiessen E,Gellersen B,et al.The effect of short and long-term exercise on aldolase activity in muscles of CW-1 and C57/BL mice of various ages.Mech Ageing Dev,1983,23(3-4):253-8.
[6]Fernando P,Bonen A,Hoffman-Goetz L.Predicting sub maximal oxygen consumption during treadmill running in mice.Can J Physiol Pharmacol,1993,71(10-11):854-7.
[7]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta CT)method.Methods,2001,25(4):402-408.
[8]Lee CH,Inoki K,Guan KL.mTOR pathway as a target in tissue hypertrophy.Annu Rev Pharmacol Toxicol,2007,47:443-67.
[9]Li W,Tan D,Zhang Z,et al.Activation of Akt-mTOR-p70S6K pathway in angiogenesis in hepatocellular carcinoma.Oncol Rep,2008,20(4):713-9.
[10]Dreyer HC,Glynn EL,Lujan HL,et al.Chronic paraplegiainduced muscle atrophy down-regulates the mTOR/S6K1 signaling pathway.J Appl Physiol,2008,104(1):27-33.
[11]Fluckey JD,Knox M,Smith L,et al.Insulin-facilitated increase of muscle protein synthesis after resistance exercise involves a MAP kinase pathway.Am J Physiol Endocrinol Metad,2006,290(6):E1205-1211.
[12]Montagne J,Stewart MJ,Stocker H,et al.Drosophila S6 kinase:a regulator of cell size.Science,1999,285:2126-2129.
[13]Atherton,Babra,Smith K,et al.Selective activation of AMPKPGC21α or PKB/TSC/mTOR signaling can explain specific adaptive responses to endurance or resistance training-like electrical muscle stimulation.FASEB,2005,19(7):786-788.
[14]Zarrinpashneh E,Beauloye C,Ginion A,et al.AMPKalpha2 counteracts the development of cardiac hypertrophy induced by is oproterenol.Biochem Biophys Res Commun,2008,376(4):677-81.



