王杨文洁 刘肇杰 安惠暄 张缨
北京体育大学运动人体科学学院(北京100084)
运动引起肌肉收缩产生具有生物活性的物质——肌肉因子,是调控骨骼肌能量代谢的重要因素[1]。Ape⁃lin作为近年来新发现的肌肉因子[2],被认为可能参与了运动调控骨骼肌能量代谢的作用。
Apelin的前体是包含77个氨基酸的多肽原,可被剪切为多种具有生物活性的片段,这些片段均含有apelin-13的氨基酸序列,因此apelin-13被认为是ape⁃lin的基本结构[3-5]。已有研究报道,apelin-13 C末端的苯丙氨酸(phenylalanine,Phe)被丙氨酸(alanine,Ala)所替代,形成异构体apelin-13(F13A),被认为是ape⁃lin-13的拮抗剂[6,7]。而另有研究报道,苯丙氨酸缺失的apelin片段仍具有结合和活化apelin受体的功能[8-11],故F13A被认为是apelin-13的类似物,与apelin-13的作用相同。因此,F13A的具体作用还需进一步证实。
Apelin作为细胞膜上G蛋白偶联受体APJ的内源性配体,广泛表达于中枢系统和外周组织(如心脏、肺、肾脏、脂肪组织和骨骼肌等)中[10]。Apelin可通过内分泌、旁分泌和自分泌的方式作用于APJ,进而参与调节心血管功能[12]、体液平衡[13]等,而在能量代谢(特别是骨骼肌)方面的作用直到近年来才受到关注。已有研究表明,apelin与细胞膜上的APJ结合后,可上调骨骼肌腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)的磷酸化水平和过氧化体增殖活化受体γ辅助活化因子(peroxisome proliferator-activated receptor γ co⁃activator-1α,PGC-1α)的蛋白表达,进而调控骨骼肌能量代谢[14-16]。解偶联蛋白(uncoupling proteins,UCPs)是分布于线粒体内膜上的一类产热蛋白,可介导线粒体呼吸链的代谢物脱氢氧化和ADP磷酸化过程解偶联,使产生的能量以热能的形式释放,其中解偶联蛋白3(uncoupling proteins 3,UCP3)是主要在骨骼肌中表达的解偶联蛋白,是哺乳动物体温的重要调控因子[17,18]。另外,UCP3还可促进脂肪酸氧化,并对体重、体脂和静息代谢率等产生影响[19-21]。也有文献报道,骨骼肌UCP3的表达可能受AMPK、PGC-1α的调控[22-25]。目前虽然已有研究表明有氧运动可增加骨骼肌apelin/APJ的表达[26],但有氧运动介导apelin是否对骨骼肌UCP3的表达产生影响及其可能的调节通路并不清楚。
本研究采用C57BL/6J雄性小鼠为研究对象,通过4周有氧运动并腹腔注射生理盐水或F13A,观察小鼠骨骼肌apelin、APJ、AMPK、p-AMPK、PGC-1α及UCP3蛋白表达和能量代谢相关指标的变化,探讨4周有氧运动介导apelin对小鼠骨骼肌UCP3表达的影响及可能的机制,观察F13A在本研究中的具体作用。
1 材料与方法
1.1 研究对象与分组
SPF级健康4周龄的C57BL/6J雄性小鼠(购于北京维通利华实验动物技术有限公司,其实验动物许可证:SCXK(京)2015-0001)40只,于北京体育大学动物饲养房(饲养许可证编号:SYXK(京)2011-0034)中分笼饲养,每笼5只。动物饲养房室温控制在20~25℃,相对湿度50%~70%,12︰12 h昼夜循环照明(光照时间7:00~19:00),国家标准啮齿类动物常规饲料饲养,自由进食和饮水。
适应性喂养4周后,8周龄小鼠体重22.55±4.08 g,按体重随机分为生理盐水组(Saline,S)和F13A组(F13A,F),每组20只;各组再随机分为安静组(Con⁃trol,C)和运动组(Exercise,E),分别为生理盐水安静组(SC)、生理盐水运动组(SE)、F13A安静组(FC)、F13A运动组(FE),每组10只。
1.2 干预方案
F13A组小鼠通过腹腔注射F13A(瑞士Bachem公司;H-7752)0.2µmol/kg/day[6,20];Saline组小鼠以同样的方式注射300µl生理盐水作为对照。注射时间为每天15:00,持续28天。
安静组小鼠正常笼中活动,不施加任何运动负荷。
正式实验前3天,运动组小鼠分别进行10 min、20 min、40 min的适应性跑台训练,方案为:坡度5°,速度15 m/min。正式实验为跑台有氧运动,前2周坡度为5°,速度15 m/min(约70%~75%最大摄氧量强度),60 min/天,6天/周;2周训练后,采用实验动物监测系统(美国Columbus Instruments)对小鼠进行最大摄氧量的测量,根据测量结果,调整后2周的训练方案为坡度5°,速度20 m/min(约70%~75%最大摄氧量强度),60 min/天,6天/周。跑台训练共持续4周。
1.3 取材
最后一次运动后48 h,进行摘眼球取血,在内壁涂有EDTA的抗凝管中静置30 min,后转速3000 rpm,离心15 min,分离出的血浆冻存在-20℃备用;取血后立即脱颈处死,迅速取两侧小腿三头肌,称量,用锡纸包裹标记,投入液氮,后转入-80℃冰箱,保存待用。
1.4 指标测定
1.4.1 摄食量、体重监控
每天14:00定时称量笼中饲料量,计算每组每天平均摄食量。分别称量4周干预前后小鼠的体重,并计算干预前后体重的变化量。
1.4.2 WesternBlot测定骨骼肌apelin、APJ、AMPK α、p-AMPK α(Thr172)、PGC- 1 α、UCP 3的蛋白表达
100 mg骨骼肌加入800µl含蛋白酶抑制剂的RIPA裂解液(碧云天),剪碎,超速匀浆;冰盒中静置30 min,随后转速12000 rpm、4℃离心30 min,取上清液,将提取的总蛋白置于-20℃,保存待用。
采用BCA法对总蛋白浓度进行测定(BCA Protein Assay Reagent,美国Thermo Scientific公司)。根据测定的总蛋白浓度,以上样量20µg/次,计算总蛋白上样量,进行配样。采用Blot 4%~12%Bis-Tris Plus凝胶(美国life technologies公司)和NuPAGE MES SDS(1×)电泳缓冲液(美国life technologies公司)进行电泳,后用iBlot Gel Transfer System(美国Invitrogen公司)将电泳后蛋白从电泳凝胶转移至NC膜上。标记目的条带后用5%的脱脂牛奶或BSA封闭1 h。用相应的一抗在4℃孵育过夜,一抗的稀释比例依次是:1︰500的apelin(美国Santa Cruz Biotechnology,sc-293441)、1︰2000 的 APJ(美国Santa Cruz Biotechnology,sc-33823)、1︰1000的AMPKα(美国Santa Cruz Biotechnology,sc-74461)、1︰1000的p-AMPKα(美国Santa Cruz Biotechnology,sc-33524)、1︰500的 PGC-1α(美国 Santa Cruz Biotechnology,sc-13067)、1︰2000 的 UCP3(美国Santa Cruz Biotechnolo⁃gy,sc-31387)和1︰1000的总蛋白内参β-Tubulin(Pro⁃teintech Group,10094-1-AP)。
次日用1×TBST洗脱,10 min/次,共3次。洗脱后用相应的二抗在室温下孵育1 h,二抗的稀释比例分别是:1︰1000的apelin(羊抗小鼠,中科晨宇,164018)、1︰1000的APJ(羊抗兔,中杉金桥,ZB-2301)、1︰5000的AMPKα(羊抗小鼠,中科晨宇,164018)、1︰2000的p-AMPKα(羊抗兔,中杉金桥,ZB-2301)、1︰1000的PGC-1α(羊抗兔,中杉金桥,ZB-2301)、1︰4000的UCP3(兔抗羊,中科晨宇,164036)和1︰5000的β-Tu⁃bulin(羊抗兔,中杉金桥,ZB-2301)。之后用1×TBST洗脱,10 min/次,共3次。加入发光液显影,放入Bio-Rad凝胶成像仪曝光,拍照。使用Image Lab软件对条带进行检测分析,读取积分灰度值。计算公式如下:

1.4.3 测定血浆总apelin含量
小鼠血浆样本置于冰上备用,采用apelin酶联免疫试剂盒(美国Sigma公司;RAB00181KT)测定血浆总apelin的含量。
1.5 统计学分析
实验数据用SPSS 17.0软件进行统计处理,结果以平均值±标准误表示。在方差齐性的条件下,采用双因素方差分析对药物和运动因素的主效应以及两因素的交互作用进行统计分析。若两因素有交互作用(P<0.05),则采用LSD法进行简单效应检验;若两因素无交互作用,同一因素内采用独立样本t检验。显着性水平以P<0.05表示具有显着性差异;P<0.01表示非常显着性差异。
2 研究结果
2.1 摄食量和体重变化
如图1所示,FC组与SC组相比,小鼠摄食量无显着性变化。SE组与SC组相比,摄食量呈增加趋势,但没有显着性差异。而FE组与FC组相比,除了第20天之外,摄食量在其余时间均显着性增加(P<0.05或0.01)。如图2所示,FC组与SC组相比,小鼠体重无显着性差异;SE和FE组分别与其Control组相比,小鼠体重均呈下降的趋势,但无显着差异。
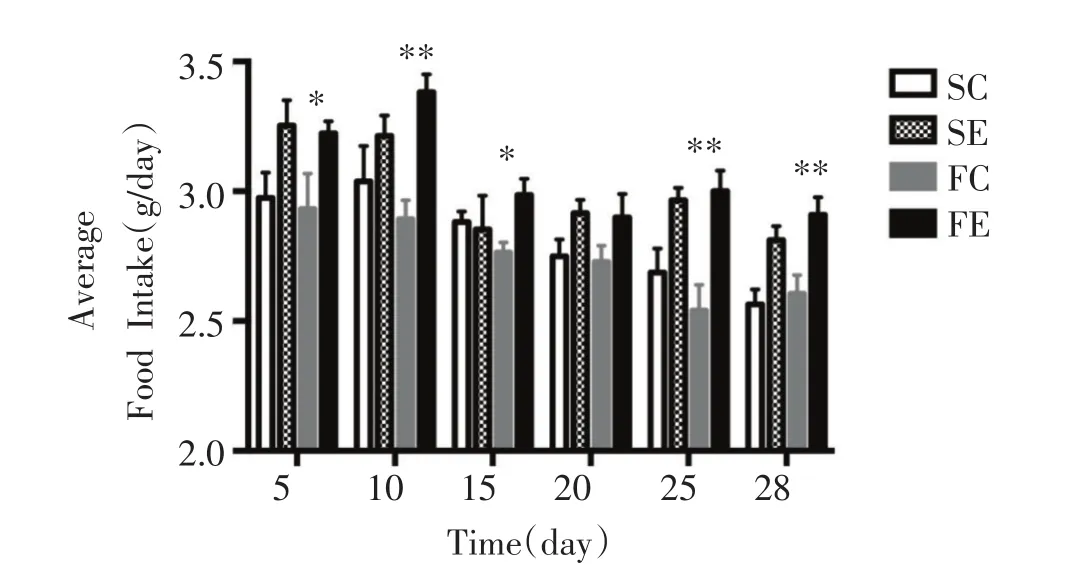
图1 平均摄食量的变化
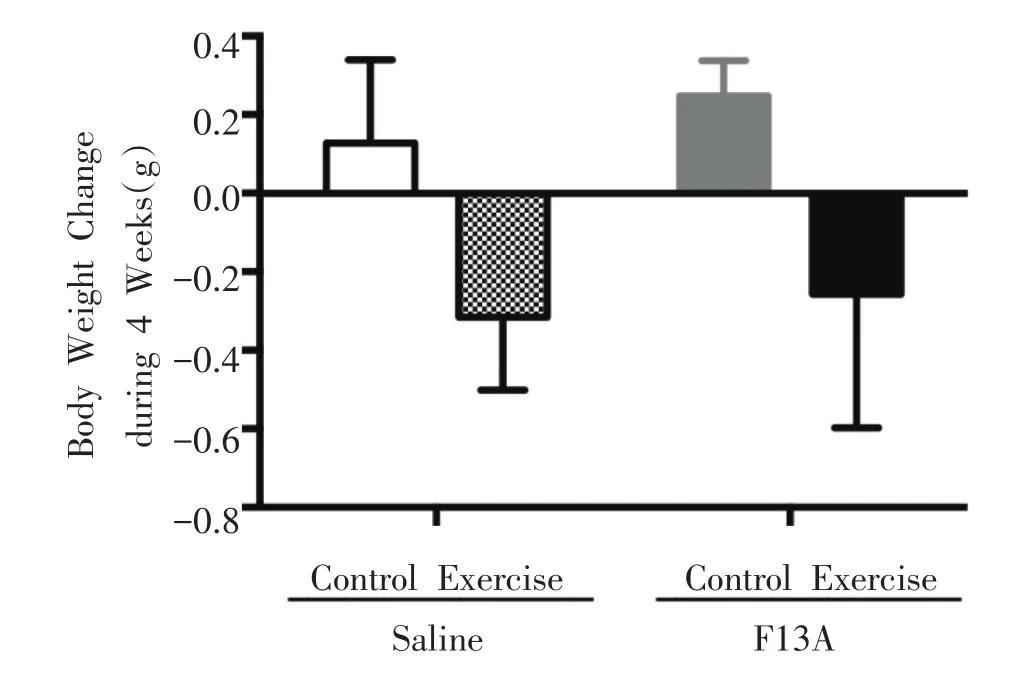
图2 体重的变化
2.2 骨骼肌蛋白表达的变化
2.2.1 Apelin蛋白表达
如图3所示,与SC组相比,FC组和SE组小鼠骨骼肌apelin蛋白表达均显着性增加(P<0.05);FE组与FC组相比,骨骼肌apelin蛋白表达非常显着性增加(P<0.01)。
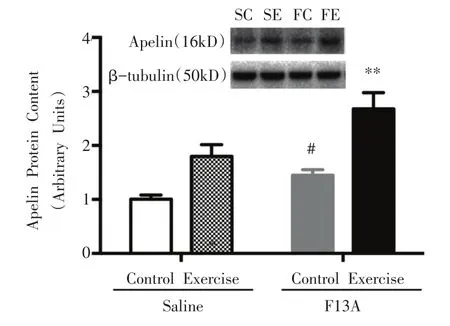
图3 骨骼肌apelin蛋白表达的变化
2.2.2 APJ蛋白表达
如图4所示,FC组与SC组相比,骨骼肌APJ蛋白表达无显着性差异。SE组与其Control组相比,APJ蛋白表达呈增加趋势,但无显着性差异。而FE组与FC组相比,APJ蛋白表达非常显着性增加(P<0.01)。
2.2.3 AMPK α、p-AMPK α(Thr172)蛋白表达及p-AMPK α(Thr172)/AMPK α 比值
如图5所示,SE组与其Control组相比,骨骼肌p-AMPKα(Thr172)蛋白表达显着性增加(P<0.05);同时,FE组与其Control组相比,骨骼肌p-AMPKα(Thr172)蛋白表达和p-AMPKα(Thr172)/AMPKα比值呈现显着性增加(P<0.01,P<0.05)。
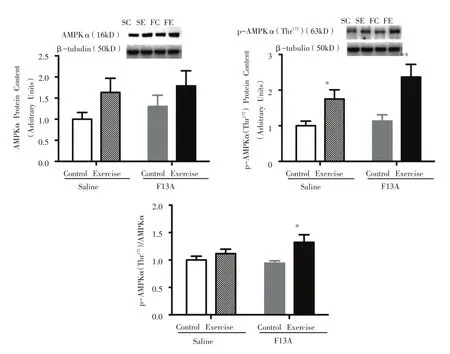
图5 骨骼肌AMPKα、p-AMPKα(Thr172)蛋白表达及p-AMPKα(Thr172)/AMPKα比值的变化
2.2.4 PGC- 1 α蛋白表达
如图6所示,FE组与FC组相比,PGC-1α蛋白表达显着性增加(P<0.05)。
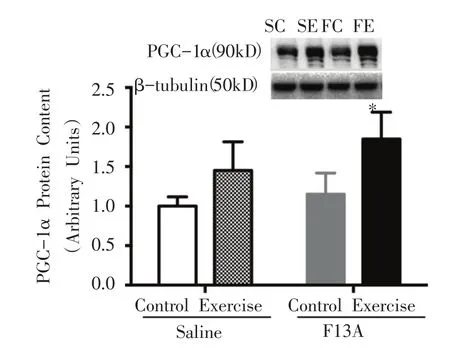
图6 骨骼肌PGC-1α蛋白表达的变化
2.2.5 UCP 3蛋白表达
如图7所示,FE组与FC组相比,UCP3蛋白表达显着性增加(P<0.05)。
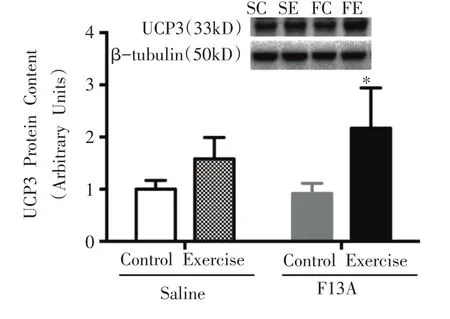
图7 骨骼肌UCP3蛋白表达的变化
2.3 血浆中总apelin含量
如图8所示,FE组与FC组相比,血浆apelin浓度显着性降低(P<0.05)。
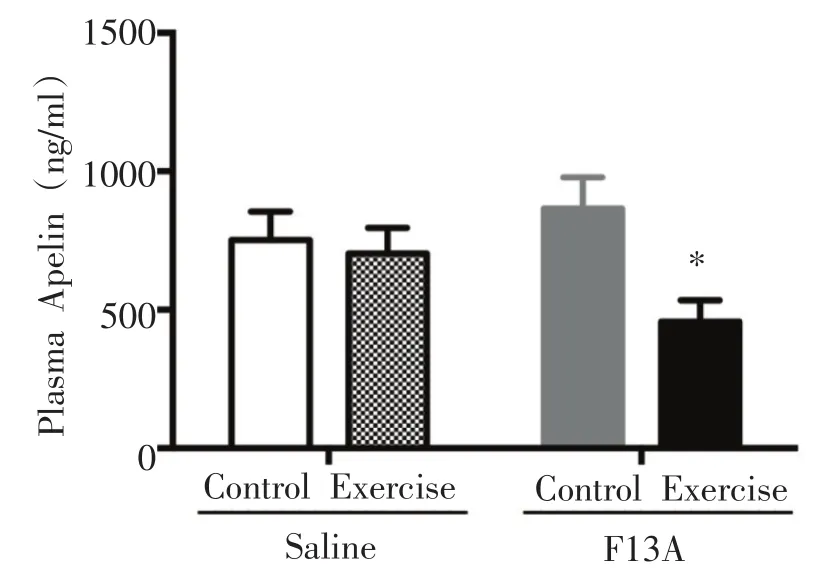
图8 血浆apelin含量的变化
3 讨论
3.1 F13 A与有氧运动对小鼠骨骼肌apelin、APJ、AMPK α、p-AMPK α(Thr172)、PGC- 1 α和UCP 3 蛋白表达的影响
APJ作为apelin机体内的天然配体,在apelin转基因小鼠股四头肌中APJ mRNA表达显着性增加[27]。对胰岛素抵抗小鼠4周腹腔注射apelin-13,比目鱼肌中的p-AMPKα/AMPKα比值显着升高,并显着上调PGC-1α mRNA的表达[6]。另有研究表明,C2C12细胞中转染PGC-1α,可通过线粒体代谢产生ROS,上调UCP3 mRNA表达[28]。因此,由上述实验推测,apelin的干预可促进骨骼肌中apelin/APJ表达,进而激活AMPK—PGC-1α信号通路,增强UCP3的表达以调节骨骼肌能量代谢。在本研究中,单纯注射F13A后仅小鼠小腿三头肌apelin的蛋白表达显着性增加,而APJ、p-AMPKα(Thr172)/AMPKα、PGC-1α及UCP3的表达均无显着性变化。分析其原因可能是由于:1)F13A生物活性可能低于apelin。Yang等[11]通过对apelin结构的研究提出,F13A虽具有与apelin-13相同的结合与激活apelin受体—APJ的生物学作用,但其生物活性弱于apelin-13;2)本实验采用的是小腿三头肌,而F13A可能对不同骨骼肌肌纤维类型的作用不同。
运动刺激骨骼肌收缩可产生并分泌apelin[2]。AMPK作为细胞代谢的能量感受器,大鼠在一次性跑台运动后3小时股四头肌AMPKα磷酸化水平显着升高,并上调PGC-1α的mRNA和蛋白表达[29]。另有研究采用电刺激模拟运动刺激,干预体外培养的大鼠骨骼肌细胞后,发现骨骼肌中AMPKα磷酸化水平、PGC-1α蛋白表达及UCP3 mRNA表达显着性升高[30]。高脂饮食诱导的胰岛素抵抗大鼠进行8周跑台运动后,可显着增加比目鱼肌和腓肠肌中apelin、APJ mRNA和蛋白表达量[26]。那么,运动训练是否可通过apelin/APJ—AMPK—PGC-1α,促进骨骼肌UCP3蛋白表达,进而调节骨骼肌能量代谢?在本研究中,单纯4周有氧运动后小鼠小腿三头肌apelin的蛋白表达显着性增加,而APJ、p-AMPKα(Thr172)、PGC-1α及UCP3表达虽有增加趋势,但无显着性差异。推测可能与4周的有氧运动时间不足有关,仍有待于进一步确定。虽然单纯F13A或有氧运动干预,小鼠骨骼肌这些蛋白表达均无显着性差异,然而,注射F13A并进行有氧运动组骨骼肌 apelin、APJ、p-AMPKα(Thr172)、PGC-1α 及UCP3蛋白表达均显着性增加。提示有氧运动可增强机体对F13A干预的敏感性,促进F13A介导骨骼肌apelin/APJ—AMPK—PGC-1α信号通路,提高UCP3的表达,增强骨骼肌能量代谢调节。
3.2 F13 A与有氧运动对小鼠摄食量和体重的影响
在下丘脑外侧区apelin/APJ的高表达可能提示apelin在食欲调节中的重要作用[31,32]。对小鼠第三脑室连续10天注射apelin-13(1µg/day),可促进小鼠摄食量(第3-7天)的显着性增加[33]。连续14天腹腔注射不同剂量(1、5和50µg/kg)apelin-13后,发现大鼠摄食量呈现剂量依赖性增长[32]。也有研究发现,apelin转基因鼠与野生型小鼠相比,无论高脂饮食或正常饮食其摄食量并无显着性变化。以上实验结果的不同可能与实验对象、apelin的干预方式不同有关,其具体作用并不明确。在本研究中,单纯F13A干预对小鼠摄食量并无显着性影响,但F13A结合运动后,小鼠摄食量呈现显着性增加。表明4周有氧运动可扩大F13A对小鼠摄食量的调控作用,并推测这一摄食调控作用可能与上述骨骼肌apelin等蛋白表达增加有关。
UCP3作为骨骼肌脂质代谢重要的调节因子,对体重变化有一定影响。UCP3基因敲除鼠骨骼肌中线粒体的脂肪酸氧化能力降低[21]。也有文献表明,apelin-13(0.1µg/kg/day)干预后可增加骨骼肌UCP3 mRNA表达,降低正常饮食和高脂饮食小鼠的体重和脂肪含量,而小鼠摄食量没有显着性变化[20]。但Tekin等[32]研究结果与上相反,SD雄性大鼠连续14天腹腔注射1、5、50µg/kg/day不同剂量apelin-13后,骨骼肌UCP3 mRNA表达均显着性降低,而大鼠体重则显着性升高。以上实验结果表明,apelin-13干预后骨骼肌UCP3表达与体重可出现成反比例的关系。在本研究中,单纯F13A干预对骨骼肌UCP3表达和小鼠体重均无显着性影响;在F13A结合运动的FE组,与FC组相比虽然小鼠骨骼肌UCP3蛋白表达出现显着性增加,但小鼠体重仅有降低的趋势,也无显着性差异。此结果是否与该组小鼠的摄食量显着性增加有关,仍需要进一步确定。在本研究中若增加测定骨骼肌组织脂代谢相关指标,可能会有更好地解释说明骨骼肌UCP3与脂代谢或体重的关系。
3.3 F13 A与有氧运动对小鼠血浆apelin含量的影响。
在本研究中,FE组与FC组相比,小鼠血浆apelin水平显着降低,与骨骼肌apelin蛋白表达的结果相反。推测运动对apelin表达的影响在不同组织中可能不同。Yang等[26]研究显示高脂饮食诱导的胰岛素抵抗大鼠进行8周跑台运动后,骨骼肌apelin和APJ表达增加,而脂肪组织和血浆中apelin、APJ水平显着降低。此FE组小鼠血浆apelin水平的显着降低可能与其脂肪组织apelin的表达水平相一致[34]。
4 结论
本实验中,F13A保留着结合与激活APJ受体的生物活性,是APJ受体的激动剂。4周有氧运动结合腹腔注射F13A,可促进骨骼肌apelin/APJ表达,激活AMPK—PGC-1α信号通路,进而提高UCP3蛋白表达。



