黄菲菲 王必慧 赵泳媚 冯英楠 陆利
1 山西医科大学人体解剖学教研室(山西太原 030001)
2 山西医科大学第二临床医学院(山西太原 030001)
神经干细胞(neural stem cells,NSCs)主要存在于中枢神经系统内,是一类具有自我更新及多向分化潜能的细胞。在成年哺乳动物脑内,NSCs主要存在于脑室室管膜下区(subventricular zone,SVZ)和海马齿状回(dentate gyrus,DG)等区域[1]。有研究显示,随着年龄增加,NSCs的增殖、分化能力逐渐下降,细胞活性明显下降,神经发生能力降低,神经退行性疾病的发生率显着提高[2],因此激活或维持NSCs潜能可能是延缓神经退行性疾病的有效策略。神经发生受内在或者外在多种因素的影响,越来越多的研究证明运动可以提高中枢神经系统的可塑性,促进神经发生,改善认知能力,发挥神经保护作用[3]。Winocur等[4]发现运动可以促进神经发生,改善化疗所引起的大鼠神经发生水平降低及认知功能低下。然而运动促进神经发生的机制尚未阐明。此外,目前已有研究证明蛋白酶体活性也与干细胞活力密切相关,蛋白酶体是一种高度保守的蛋白水解酶复合物,它能识别出与泛素结合的蛋白质,通过泛素-蛋白酶体通路调控细胞分化、生长、凋亡等过程,参与维持干细胞活力[5,6]。我们的前期研究结果证明叔丁基苯二酚可以激活人骨髓间充质干细胞(BMSCs)蛋白酶体活性,从而延缓因蛋白酶体功能障碍引起的BMSCs复制性衰老进程[7];相反,应用基因沉默技术下调蛋白酶体亚单位PSMB5表达水平会抑制人骨髓间充质干细胞增殖能力[8],提示蛋白酶体活性与干细胞活力有关。那么,运动促进神经发生是否与蛋白酶体活性有关呢?为此,我们观察运动后SVZ蛋白酶体活性的改变,并通过侧脑室注射MG132分析抑制蛋白酶体活性是否影响运动对神经发生的促进作用。
1 材料和方法
1.1 实验动物与分组
选取新生(Postnantal day 0,P0)、成年(Postnantal day 90,P90)及老年(Postnantal day 540,P540)清洁级BALB/c雄鼠,分为3个年龄组,每组12只。分离SVZ组织,提取总蛋白,应用荧光分光光度法分别检测其SVZ蛋白酶体活性。
90日龄、体重(30±3)g清洁级BALB/c雄鼠,取24只,随机分为运动组和安静组,运动组小鼠每日进行自主跑轮运动,安静组小鼠笼内安置有锁定的跑轮,以保证两组饲养环境一致。4周后取材,免疫荧光染色检测神经发生,提取总蛋白检测蛋白酶体活性表达水平,提取总RNA检测蛋白酶体亚单位PSMB1、PSMB2、PSMB5和PSMA3表达情况。另取24只随机分为MG132-运动组和二甲基亚砜(Dimethyl sulfoxide,DMSO)-运动组,分别进行为期4周的自主跑轮运动,并于运动前1天及运动第14天各进行一次脑立体定位注射MG132或等体积DMSO,运动完成后检测蛋白酶体活性和神经发生水平。以VitalView监测系统监测小鼠运动情况。
1.2 试剂与检测
1.2.1 试剂
山羊血清封闭液购自博士德生物有限公司,Ki67抗体购自abcam,DCX抗体购自CST,山羊抗兔594购自中杉金桥,DAPI购自罗氏公司,抗荧光淬灭封片剂购自Solarbio,BCA试剂盒购自康为,测蛋白酶体活性试剂盒为Millipore产品,RNA iso plus、反转录试剂盒购自Takara,MG132购自碧云天生物技术研究所。
1.2.2 蛋白酶体抑制剂MG132侧脑室定位注射
将小鼠以3%的水合氯醛(40 mg/kg)腹腔麻醉后,固定于瑞沃德脑立体定位注射仪,手术区备皮、消毒,正中线切开皮肤,剥离骨膜,于前囟前0.67 mm,旁开0.6 mm,垂直进针,深度为2.2 mm,即达侧脑室。每侧注入1 μl MG132(10 μg/μl,DMSO稀释),5 min内注完,缓慢拔针,2 min内拔出,缝合,消毒后保温饲养。
1.2.3 免疫荧光检测Ki67、DCX在SVZ区的阳性细胞数
采用3%的水合氯醛腹腔注射麻醉小鼠,以生理盐水、4%多聚甲醛溶液进行心脏灌注,随后进行15%、30%蔗糖梯度脱水,标本沉底表明脱水完全。采用OCT保护剂包埋组织,-20℃冷冻2 h后进行冰冻切片。染色前将玻片置于37℃烤箱烤干后,用0.3%Triton PBS洗两次,5 min/次,0.01 M PBS洗一次,5 min/次,将脑片浸泡在丙酮内,-20℃保存20 min,晾干后再洗三次,之后用10%NGS 37℃封闭1 h,兔源Ki67或DCX一抗4℃过夜,洗三次后荧光二抗抗兔594 37℃孵育2 h,DAPI(1∶1000)37℃孵育15 min,自来水洗净之后用抗荧光淬灭封片剂封片,Olympus荧光显微镜下观察、拍照,计数。
1.2.4 蛋白酶体活性检测
提取SVZ总蛋白,BCA法测定蛋白浓度,将30 μg总蛋白加入蛋白酶体活性检测反应体系,荧光酶标仪380 nm(激发光)/460 nm(发射光)处测定荧光强度,37℃孵育2 h,再次测定荧光强度,计算两次荧光强度差值,比较安静组与运动组,运动后注射DMSO组与MG132组的差值,进行统计分析。
1.2.5Real-time PCR(RT-PCR)实验
采用RNAiso Plus(TaKaRa)试剂提取 SVZ总RNA。运用分光光度法检测RNA质量和浓度。5×Prime Script RT Master Mix试剂盒将RNA反转录为cDNA。采用SYBR Green法,以反转录得到的cDNA(100 ng)为模板,在ABI StepOneTM Plus仪器检测,反应体系与条件参照SYBR Premix Ex TaqTM(TaKaRa)说明书。反应完毕后采用2-ΔΔCt法进行基因表达的相对定量分析。
1.3 统计学分析
采用SPSS 19.0软件进行统计分析,数据采用均数±标准误(mean±SEM)表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA),SNK-q检验进行组间两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 不同年龄小鼠SVZ蛋白酶体活性
P90、P540小鼠SVZ蛋白酶体活性较P0小鼠分别下降50.9%(P<0.01)、70.4%(P<0.01),提示随年龄增加,小鼠SVZ蛋白酶体活性显着下降(图1)。

图1 不同年龄小鼠蛋白酶体活性比较
2.2 运动提高成年小鼠SVZ蛋白酶体活性及其亚单位的表达
4周后,运动组小鼠SVZ的蛋白酶体活性较安静组增加39.8%(P<0.01,图2a);运动组小鼠蛋白酶体亚单位PSMB1、PSMB2、PSMB5和PSMA3的表达水平也较安静组分别增加9.1%(P<0.05)、21.7%(P<0.01)、25.4%(P<0.01)和10.1%(P<0.05)(图2b)。结果提示运动上调蛋白酶体活性及其亚单位表达水平。
2.3 侧脑室注射MG132抑制运动小鼠SVZ蛋白酶体活性
比较MG132-运动组与DMSO-运动组小鼠运动量,发现两组小鼠运动量差异无统计学意义(图3a);应用荧光分光光度法检测运动小鼠SVZ蛋白酶体活性,结果显示MG132-运动组小鼠SVZ蛋白酶体活性较DMSO-运动组降低35.5%(P<0.05,图3b),表明脑内注射MG132可以抑制运动小鼠SVZ的蛋白酶体活性。
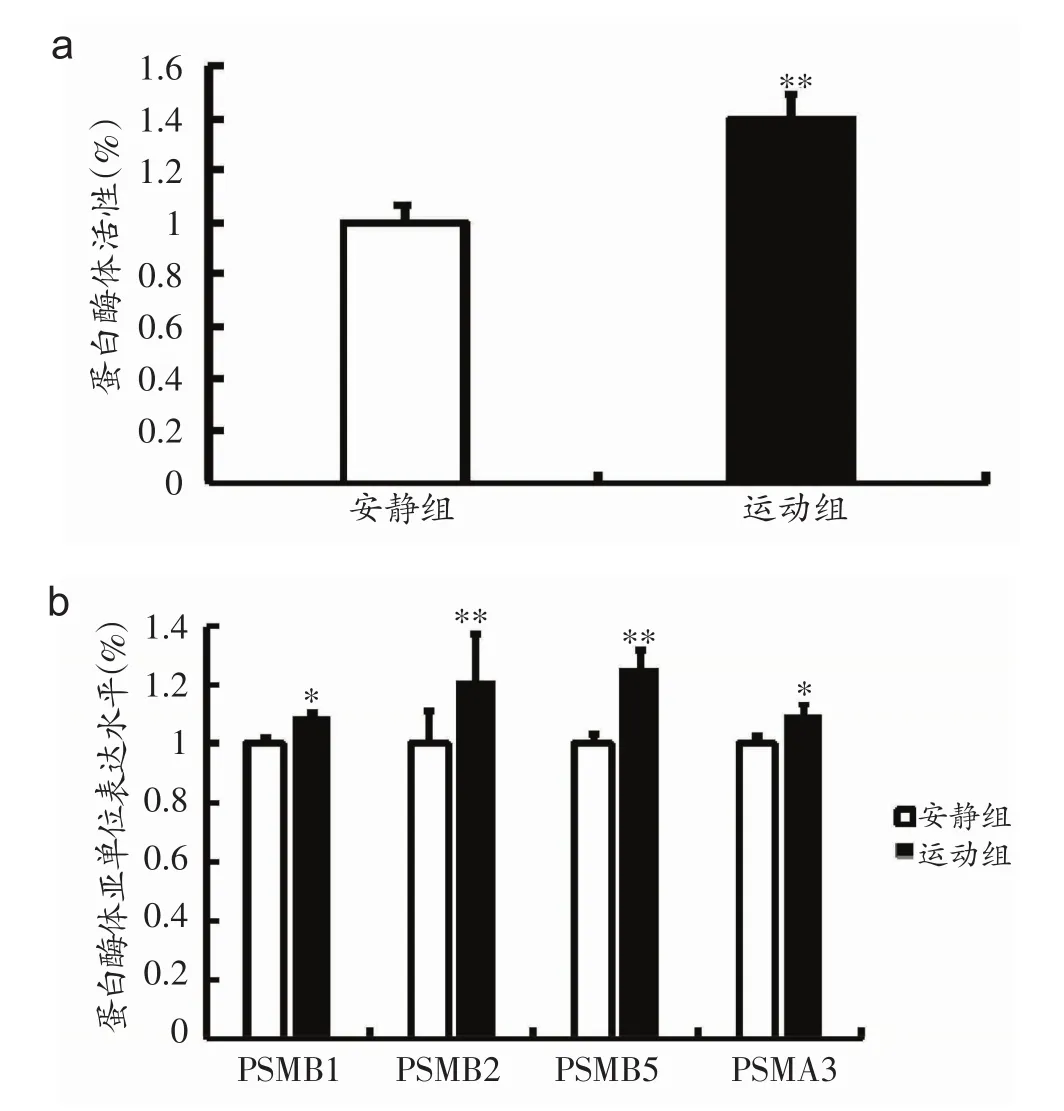
图2 运动上调蛋白酶体活性及其亚单位表达水平
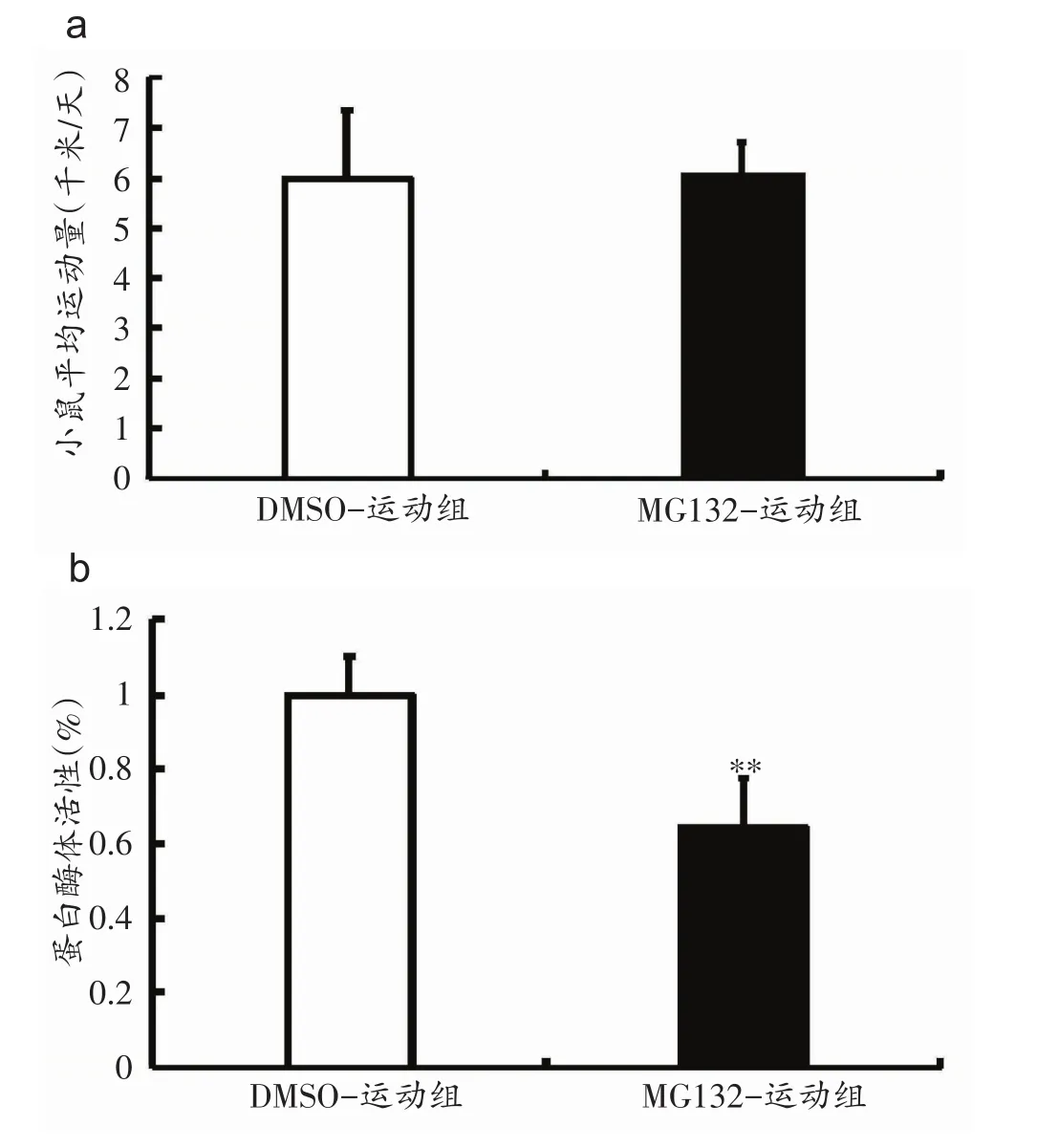
图3 MG132能够抑制运动对蛋白酶体活性的激活作用

图4 应用MG132抑制蛋白酶体活性能够拮抗运动对神经发生的促进作用
2.4 侧脑室注射MG132能够拮抗运动对神经发生的促进作用
Ki67免疫荧光染色结果显示,自主跑轮运动后小鼠SVZ区Ki67+的细胞数量较安静组增加32.4%(P<0.01,图4e),表明运动组小鼠SVZ区NSCs增殖能力提高;比较MG132-运动组和DMSO-运动组小鼠SVZ区Ki67+细胞数量,发现MG132-运动组较DMSO-运动组下降27.6%(P<0.001,图4a、4b、4f),表明抑制蛋白酶体活性后运动组小鼠SVZ区NSCs增殖能力下降。
DCX免疫荧光染色结果显示,自主跑轮运动后小鼠SVZ区DCX+的细胞数量较安静组增加78.3%(P<0.001,图4g),表明运动组小鼠的NSCs分化能力提高。同样,MG132-运动组小鼠SVZ区DCX+的细胞数量较DMSO-运动组下降51.5%(P<0.001,图4c、4d、4h),说明抑制小鼠SVZ区蛋白酶体活性后运动组小鼠SVZ区NSCs分化能力下降。上述结果表明运动能改善小鼠SVZ的神经发生,但抑制蛋白酶体活性后运动组小鼠SVZ区神经发生水平下降,说明运动上调蛋白酶体活性促进SVZ区神经发生。
3 讨论
NSCs是一类能自我更新并具有多种分化潜能的细胞,在适当条件下可分化为神经元、少突胶质细胞和星形胶质细胞。缺血缺氧等条件造成神经组织损伤后,NSCs可发生增殖、迁移,并分化为神经元和神经胶质细胞,促进神经系统的功能恢复[9]。但随着年龄增加,NSCs增殖、分化及存活能力降低,细胞活性明显下降,修复受损神经组织能力减弱,导致学习记忆能力下降及出现情感障碍,从而导致一系列神经退行性疾病的发生[2]。因此,激活或维持NSCs潜能可能是延缓脑老化,防治脑损伤的有效策略。
蛋白酶体是一种高度保守的蛋白水解酶复合物,它能识别出与泛素结合的蛋白质,在错误折叠蛋白或其他突变蛋白的降解中发挥作用。泛素-蛋白酶体途径是细胞内重要的非溶酶体蛋白降解途径,是调节各种细胞生物学过程的重要机制,参与调节细胞周期进程、细胞增生与分化以及信号转导等各种细胞生理过程,对干细胞“干性”维持具有十分重要的意义[5,6]。本课题组前期研究结果证明运用慢病毒感染人骨髓间充质干细胞使20S蛋白酶体β5亚单位表达水平降低时,细胞增殖能力下降[7];相反,运用18α-甘草次酸(18αglycyrrhetinic acid,18α-GA)上调蛋白酶体活性可以促进晚期骨髓间充质干细胞增殖[10],由此可见,蛋白酶体活性与骨髓间充质干细胞增殖能力密切相关,维持或激活蛋白酶体活性可能是改善细胞活力的重要途径。神经退行性疾病的共同特征是突变或损伤蛋白在细胞内或细胞外的异常聚集,清理毒性蛋白的泛素-蛋白酶体系统(ubiquitin proteasomesystem,UPS)的衰竭可能在神经退行性疾病发病机制中扮演主要角色[11]。Saez等[12]已经证实,随着年龄增长,蛋白内稳态渐进性丧失,错误折叠蛋白或损伤的蛋白在细胞内外聚积,导致神经退行性疾病的发生。Lee等[13]也证实,核因子E2相关因子1(Nuclear factor E2-related factor 1Nrf1)与蛋白酶体活性密切相关,敲除Nrf1后小鼠神经发生水平也下降,表明提高蛋白酶体活性是维持神经发生水平的有效途径。我们的结果也证明,随着年龄的增长,成年及老年小鼠SVZ蛋白酶体活性较新生鼠显着下降。因此,蛋白酶体活性与神经发生水平密切相关。
大量研究表明,运动可以促进神经发生,提高中枢神经系统的可塑性,发挥神经保护作用[14]。Saraulli等[15]证实长期运动具有神经保护作用,可以提高神经发生水平,维持脑的正常功能,减少或延缓神经退行性疾病的发生,延长寿命。Tirone等[3]证实,自主运动可以促进海马DG区神经发生增强,新生神经元数量增多,空间记忆能力改善,有效促进脑损伤后大脑的恢复。此外,该课题组通过构建抗增殖基因Btg1缺失模型研究运动是否可以改善SVZ区抗增殖基因Btg1缺失所致的神经发生水平下降,结果发现运动可以改善Btg1基因缺失小鼠SVZ的神经发生,维持正常细胞周期,维持神经干细胞活力,促进NSCs的迁移和分化,提高NSCs的自我更新能力[16]。我们的研究同样发现,运动4周后小鼠SVZ区Ki67+、DCX+数量较安静组明显增多,神经干细胞增殖、分化能力提高。此外,运动小鼠SVZ蛋白酶体活性及其亚单位表达水平也显着高于对照组,因此我们推测运动维持细胞活力、促进神经发生可能与蛋白酶体活性有关。MG132已被公认具有抑制蛋白酶体活性的作用[17],本课题组前期研究结果已证实,侧脑室注射MG132抑制蛋白酶体活性后,MG132-安静组小鼠神经发生水平下降[5]。本实验中我们通过检测MG132-运动组及DMSO-运动组小鼠蛋白酶体活性及神经发生水平,探究抑制蛋白酶体活性是否影响运动对神经发生的促进作用,结果显示MG132-运动组小鼠较DMSO-运动组SVZ蛋白酶体活性显着降低,SVZ区Ki67+、DCX+数量减少,神经发生水平降低,表明抑制蛋白酶体活性会拮抗运动对神经发生的促进作用,但其中的具体机制亟待进一步探讨。
4 总结
随年龄增长,蛋白酶体活性下降;P90小鼠运动4周后,SVZ蛋白酶体活性较安静组显着上升,同时神经发生水平提高;抑制运动组小鼠SVZ蛋白酶体活性使神经发生水平下降。结果表明运动上调蛋白酶体活性促进SVZ神经发生。



