谢慧 唐成林 赵丹丹 罗翱 吴梦佳 安荟羽 邱丽
1重庆医科大学中医药学院(重庆 400016)
2中医药防治代谢性疾病重庆市重点实验室(重庆 400016)
骨骼肌是人体主要的运动器官,在周围神经的支配下通过肌纤维的收缩和舒张调控机体的运动功能。不论是外部损伤(车祸伤、切割伤、冻伤、烧伤等)还是内源性疾病(糖尿病、肌萎缩侧索硬化症、脊髓性肌萎缩症等)[1]均可造成周围神经损伤,而周围神经受损则可导致骨骼肌失去神经支配。骨骼肌的这种长期的失神经状态会引起肌容量丧失、肌纤维重构、肌卫星细胞减少等病理改变[2,3],最终造成不可逆的失神经性肌萎缩,给患者的日常生活和工作带来严重影响。然而,目前对失神经肌萎缩发病机制的认识仍十分有限,并且缺少有效的治疗方法[4]。肌卫星细胞的增殖分化水平异常在失神经肌萎缩的发展中扮演着重要角色[5]。肌卫星细胞是骨骼肌的多能干细胞,对骨骼肌损伤后的修复再生起着重要作用。而成肌分化抗原(Myogenic differentiation antigen,Myod1)是肌卫星细胞分化的标志性分子,其表达的高低受多种因子和信号通路调节。微小RNA(MicroRNA,miRNA)是长约20~22 nt的非编码RNA,具有组织特异性。近年来在对多种肌肉特异性miRNA[5]的深入研究后发现,这些非编码RNA可以参与调控骨骼肌卫星肌细胞的增殖、分化,肌细胞的融合及凋亡等多种生命活动,如微小RNA 206(MicroRNA 206,Mir-206)[6]可以通过调控组蛋白去乙酰化酶4(Histone Deacetylase 4,HDAC4)的表达促进肌卫星细胞分化。而转化生长因子β1(Tansforming growth factor-β1,TGF-β1)/Smad3 信号通路可通过调控HDAC4的表达参与肌组织的发育、修复和再生等过程[7]。本课题组前期研究发现电针可能通过促进失神经大鼠腓肠肌中胰岛素样生长因子-1(Insulin like growth factor,IGF-1)的表达,抑制肌肉生长抑制素(Myostatin)的表达,从而促进肌卫星细胞增殖[8]。在前期研究的基础上,本实验通过予以失神经肌萎缩大鼠电针干预,判断电针干预是否能通过调控TGF-β1/Smad3信号通路及Mir-206、Myod1和HDAC4的表达水平,从而影响骨骼肌卫星细胞分化,减轻骨骼肌细胞容量和质量的丧失,延缓失神经肌萎缩的发展。
1 对象与方法
1.1 实验动物及分组
清洁级健康成年雄性SD大鼠24只,体质量250±50 g,由重庆医科大学动物实验中心提供。医学动物合格证号:SCXK渝2012-0002。代养于重庆医科大学动物实验中心SPF级动物房,分笼饲养,室温22±2℃,相对湿度50% ±5%,明暗12 h交替,自由饮水、摄食。大鼠适应性喂养1周后,按随机数字表法分为假手术组(n=8)、模型组(n=8)和电针组(n=8)。整个实验过程中动物的处置均符合重庆医科大学伦理委员会标准。
1.2 主要试剂及仪器
Trizol总RNA提取液、RR037A逆转录试剂盒、Mir-X miRNA逆转录试剂盒、SYBR Premix Ex Taq TM II、Myod1、HDAC4、Mir-206、TGF-β1、转化生长因子受体 1(Transforming growth factor-β receptor 1,TGF-βr1)、TGF-βr2、Smad3、Smad7和肌动蛋白(β-Actin)引物合成(日本TAKARA公司)、汉医牌无菌针灸针(北京汉医医疗器械中心)、SDZ-II型电子针治疗仪(苏州医疗用品有限公司)、柔软型实验大鼠固定器(温州原上草医疗科技有限公司)、AL204型电子天平(瑞士梅特勒-托利多公司)、低温高速离心机(德国西格玛公司)、Thermo ND2000超微量核酸蛋白测定仪(上海吉凯基因化学技术有限公司)、T100TMPCR仪、CFX ConnectTM荧光定量PCR检测系统(美国伯乐生命医学产品有限公司)、BX53普通正置显微镜、CellSens Standard图像采集软件(日本奥林巴斯公司)、Image-Pro Plus 6.0图像分析软件。
1.3 造模方法
通过手术横断坐骨神经的造模方法制备大鼠失神经性肌萎缩模型[8,9]:予以模型组和电针组大鼠4%水合氯醛(0.8 mL/100 g)腹腔注射麻醉,将大鼠固定后进行右侧后肢手术区域的备皮,于右侧股后正中行一长约6~8 mm的手术切口,显露股二头肌,钝性分离并暴露坐骨神经,剪断坐骨神经并制备1.5 cm的缺口,将两神经断端翻转180°后缝合于邻近肌组织,之后逐层缝合肌肉和皮肤。假手术组仅暴露坐骨神经但不行神经截断术。
1.4 针刺方法
造模后电针组大鼠予以柔软型实验大鼠固定器固定[10],并参照《实验针灸学》[11]的方法,用0.25 mm×13 mm的一次性无菌针灸针对其右侧足三里、环跳穴进行2 Hz、1.0 mA连续波的电针干预,进针5~7 mm,每次10 min,每日1次,每周6次,连续干预4周。假手术组和模型组大鼠每日予以相同方法固定但不予电针干预。
1.5 检测方法观察指标
1.5.1 取材
在第4周干预结束后,予以各组大鼠4%水合氯醛(0.8 mL/100 g)腹腔注射麻醉,完整剥离双侧腓肠肌,吸干其表面残留液体并称重;之后将腓肠肌组织分为两份,一份放入液氮罐中速冻后转移至- 80℃冰箱储存待测,另一份置于4%多聚甲醛溶液中固定,待包埋后进行形态学检测,取材结束后处死全部大鼠。
1.5.2 腓肠肌湿重比检测
取材时首先大体观察腓肠肌的饱满度。观察后完整剥离双侧腓肠肌并置于电子天平上称取肌湿重,以自身非电针侧作为对照,计算各组大鼠的腓肠肌湿重比。肌湿重比=术侧腓肠肌湿重/非术侧腓肠肌湿重[12,13]。
1.5.3 腓肠肌纤维横截面积检测
腓肠肌经 4%多聚甲醛固定后,经酒精梯度脱水、浸蜡、包埋后制备石蜡切片并进行HE染色。石蜡包埋、切片及HE染色均由重庆医科大学基础医学院组织切片室完成。每组选取8张不同组织的切片进行400倍光学显微镜观察,每张切片随机选取5个视野拍照,每个视野随机选取4个细胞,经Image Pro Plus 6.0图像分析软件计算各组大鼠腓肠肌纤维横截面积。
1.5.4 实时荧光定量PPCCRR法检测腓肠肌中肌卫星细胞相关分化因子 mmRRNNAA的相对表达量
取各组大鼠冰冻保存的腓肠肌组织样本约50 mg,用Trizol法提取总RNA;检测总RNA浓度及纯度后按RR037A逆转录试剂盒和Mir-X miRNA逆转录试剂盒操作步骤分别配置普通RNA和MirRNA的反应体系,置于T100TMPCR仪中进行逆转录反应,按照SYBR Green法配制Mix及反应体系后上机进行实时荧光定量PCR反应。通过CFX manager 3.1软件读取Ct值。以Folds=2-ΔΔCt表示模型组、电针组与假手术组目的基因表达的倍比关系,公式如下:ΔΔCt=[Ct(target gene)- Ct(β-Actin)]模型组/电针组- [Ct(target gene)-Ct(β-Actin)]假手术组,重复8次试验,计算平均值。上下游引物序列分别如下:

表1 引物序列
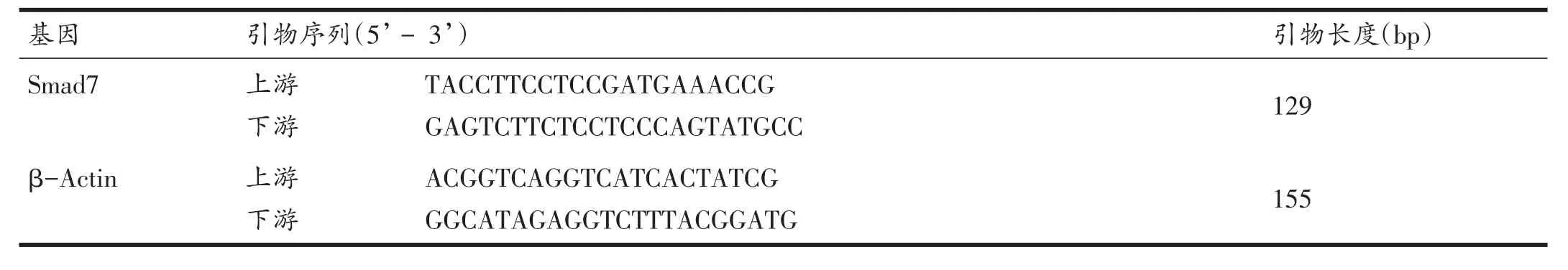
(续表1)
1.6 统计学分析
采用 SPSS 22.0统计软件进行分析,结果均用x±s表示。不同组间数据采用单因素方差分析,方差齐时多重组间两两比较均采用SNK-q检验进行显着性分析,方差不齐时采用Dunnett’s T3检验进行显着性分析。P<0.05为差异有统计学意义。
2 结果
2.1 腓肠肌湿重比
大体观察可见:与假手术组相比,模型组、电针组大鼠术侧腓肠肌饱满度明显减低,弹性减弱,色泽欠佳,且呈进行性肌萎缩。各组大鼠腓肠肌湿重比结果如图1所示,模型组大鼠腓肠肌湿重比低于假手术组,差异有统计学意义(P<0.05),电针组腓肠肌湿重比高于模型组,差异有统计学意义(P<0.05)。提示电针干预能有效延缓腓肠肌质量的丧失。

图1 各组大鼠腓肠肌湿重比比较(n n=8)
2.2 各组腓肠肌形态学比较
各组大鼠术侧腓肠肌病理结果及肌纤维横截面积结果如图2所示,各组大鼠腓肠肌横截面结构清晰,颜色及形态均正常。与假手术组相比,模型组大鼠术侧腓肠肌纤维萎缩变小,而纤维间隙扩大,且电针组肌纤维横截面积略大于模型组。各组大鼠术侧腓肠肌纤维横截面积结果比较如图3所示,模型组大鼠术侧腓肠肌纤维横截面积小于假手术组(P<0.05),而电针组大鼠术侧腓肠肌纤维横截面积大于模型组(P<0.05),提示电针干预可有效增加失神经萎缩肌纤维的横截面积。
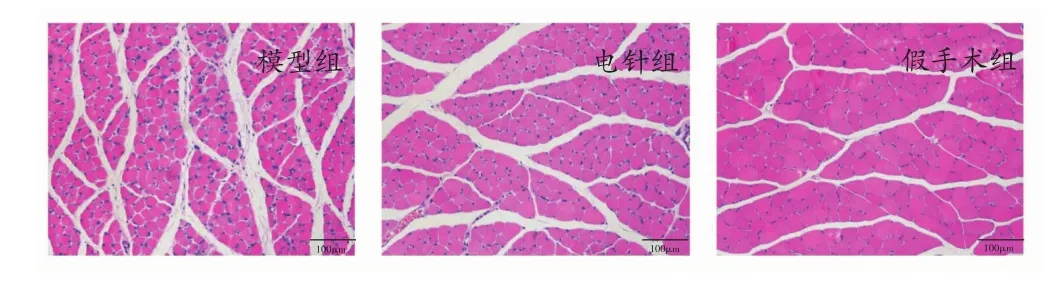
图2 各组大鼠术侧腓肠肌纤维的HE染色结果

图3 各组大鼠术侧腓肠肌纤维横截面积比较(n n=8)
2.3 各组大鼠术侧腓肠肌中肌卫星细胞分化相关因子mRNAmRNA的相对表达量
各组大鼠术侧腓肠肌中肌卫星细胞分化相关因子mRNA的相对表达量结果如图4所示:造模后第4周,模型组大鼠术侧腓肠肌中HDAC4、TGF-β1、TGF-βr1、TGF-βr2、Smad3 mRNA相对表达量均高于假手术组,差异有统计学意义(P<0.05),电针组的HDAC4、TGF-β1、TGF-βr1、TGF-βr2、Smad3 mRNA相对表达量低于模型组,差异有统计学意义(P<0.05)。模型组术侧腓肠肌中Myod1、Mir-206 mRNA相对表达量高于假手术组(P<0.05),而电针组腓肠肌中Myod1、Mir-206 mRNA相对表达量高于模型组,差异有统计学意义(P<0.05)。模型组术侧腓肠肌中Smad7 mRNA相对表达量低于假手术组(P<0.05),而电针组的Smad7 mRNA相对表达量高于模型组,差异有统计学意义(P<0.05)。这提示电针可能通过抑制 TGF-β1/Smad3信号通路,抑制 HDAC4,促进Myod1和Mir-206的表达,促进失神经肌萎缩大鼠肌卫星细胞的分化。

图4 各组大鼠术侧腓肠肌中肌卫星细胞分化相关因子mRNA的相对表达量比较(n n=8)
3 讨论
失神经性肌萎缩是指靶肌肉失去神经支配后所发生的肌纤维变细甚至消失的病理状态。实验中通常使用肌湿重比、肌纤维横截面积的减小[14]判断肌萎缩的程度。本实验通过横断大鼠右侧坐骨神经制备右下肢失神经性肌萎缩模型,观察电针干预对大鼠失神经肌萎缩的延缓作用。实验结果表明,电针干预“足三里”、“环跳”穴能有效延缓该侧腓肠肌湿重比和纤维横截面积的下降,提示电针干预能有效延缓失神经肌萎缩。中医学将失神经性肌萎缩归为“痿症”范畴,并提出“治痿独取阳明”的治疗大法,针灸对其疗效显着[15]。足阳明胃经为五脏六腑之海,有润养宗筋的作用,而宗筋有束骨利关节之功,足三里为阳明经合穴,功善舒筋活络、养筋活血,为下肢痿痹之临床要穴;环跳为足少阳胆经穴位,功善疏通经络、活血止痛,为活络下肢气血之临床常用穴。本实验电针干预足三里、环跳穴延缓大鼠的失神经肌萎缩可能是通过疏通气血、活络宗筋实现的。
失神经肌萎缩的调控机制复杂。研究表明,肌卫星细胞增殖分化水平异常是导致失神经肌萎缩的重要病理机制之一[16]。肌卫星细胞[17,18]是骨骼肌的多能干细胞,对骨骼肌的损伤后修复具有重要作用。骨骼肌在失去神经支配后[19],肌卫星细胞由原来的静息态进入激活态,在多种因子的作用下增殖、分化,最终发育为成熟肌细胞发挥其生物学作用。Myod1是生肌调节因子(Myogenic regulatory factors,MRFs)的一员[20],参与肌卫星细胞的初级分化,是肌卫星细胞分化的重要标志物。Mir-206是骨骼肌的特异性miRNA,对肌卫星细胞分化起着重要的调控作用。Su等[21]认为连续电针干预可能通过上调腓肠肌中Myod1和Mir-206的表达,促进肌卫星细胞分化,延缓失神经肌萎缩。本实验结果表明,在失神经支配的第4周,大鼠术侧腓肠肌中Myod1、Mir-206 mRNA的表达水平显着上调,而电针干预足三里、环跳穴则能进一步上调其表达水平,故推断电针干预足三里、环跳穴可能通过上调腓肠肌中肌卫星细胞的分化水平延缓失神经肌萎缩。
HDAC4目前被认为是肌卫星细胞分化的抑制因子[22,23],通过抑制 MRFS 家族成员(如 Myf5、MRF4 和myogeinn)的表达抑制肌卫星细胞分化。而TGF-β1/Smad3信号通路对肌卫星细胞的分化起着重要的调控作用:TGF-β1与其下游受体TGF-βr1/TGF-βr2结合后,通过Smad2/3蛋白将信号从细胞膜、细胞质传递到细胞核,之后可与其他核内因子协同激活或抑制靶基因的转录,而Smad7则是这一通路的抑制蛋白。研究表明TGF-β1可通过影响Smad3的表达调控HDAC4的表达水平,进而调控肌卫星细胞的分化[24],而抑制TGF-β1/Smad3信号通路则可以促进小鼠萎缩骨骼肌中肌卫星细胞的分化。Huang等[25]认为,TGF-β1/Smad3/HDAC4信息轴在失神经肌萎缩的发展进程中起着重要作用,而过表达Mir-206则可能通过抑制TGF-β1/Smad3/HDAC4信息轴上关键因子的表达,上调肌卫星细胞的分化水平,延缓失神经肌萎缩。本实验结果表明,在失神经支配的第4周,大鼠术侧腓肠肌HDAC4、TGF-β1、TGF-βr1、TGF-βr2、Smad3 mRNA的表达水平显着上调,电针干预能有效下调其表达水平;而术后4周大鼠术侧腓肠肌中Smad7 mRNA的表达水平显着下调,而电针干预能有效上调其表达,故推断电针干预足三里、环跳穴可能通过抑制TGF-β1/Smad3信号通路,抑制HDAC4的表达,促进腓肠肌Myod1和Mir-206的表达,促进肌卫星细胞的分化水平,延缓骨骼肌质量和体积的减少,进而延缓失神经肌萎缩的发展。
4 总结
综上所述,我们推断电针干预大鼠足三里、环跳穴能有效延缓腓肠肌的失神经肌萎缩,这一机制可能是电针通过抑制TGF-β1/Smad3信号通路,抑制HDAC4的表达,并促进腓肠肌Myod1和Mir-206的表达,促进肌卫星细胞分化,使失去神经支配的骨骼肌的质量和体积得以维持,最终延缓失神经肌萎缩。



