陈雪飞 李世田 李灵杰 张靓
北京师范大学体育与运动学院(北京 100875)
心力衰竭是指由心脏结构和功能异常导致心室收缩或舒张能力受损而引起的一系列病理生理变化的临床综合征[1]。随着人口老龄化及医疗药物、手段的改善,冠心病、高血压及其他心血管疾病患者生存时间延长,导致心力衰竭的发病率显着增加。美国心脏协会(American Heart Association,AHA)发布的心力衰竭管理指南中,以左心室射血分数(left ventricular ejection fractions,LVEF)降低50%为临界点,将心力衰竭分为射血分数降低的心力衰竭(heart failure with reduced ejection fraction,HFrEF)和射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)(LVEF ≥ 50%)[2]。其中HFpEF 的患病率约占全部心力衰竭的50%,其病因复杂、治疗效果不明显、预后差、死亡率高,受到越来越多专家学者的关注[3]。
心源性恶液质是导致心力衰竭死亡的重要诱因。恶液质是一种严重的并发症,多发于各种慢性疾病的晚期,包括癌症,多种器官特异性炎症疾病或是心血管疾病[4]。多项研究发现心力衰竭时骨骼肌萎缩[5],肌纤维类型改变[6],蛋白质含量减少[6];白色脂肪组织的重量减轻,细胞体积变小,脂滴减小,胞内线粒体的数量增加;褐色脂肪细胞体积减小,褐色化标志基因解偶联蛋白1(uncoupling protein 1,UCP-1)表达上调达4倍[7]。
良好的运动习惯对于心血管疾病的发生及发展具有强大的保护作用[8]。研究表明,运动可以抑制心力衰竭时心源性恶液质的发展[9],本实验室前期研究也发现,在心力衰竭发生后,中小强度的跑台运动显着增加心力衰竭大鼠骨骼肌和脂肪组织重量,调节脂肪组织的代谢异常和骨骼肌萎缩,改善心源性恶液质[10]。有研究[11]发现,维持锻炼的中年受试者在65 岁之后由于心力衰竭住院的风险降低,中年时身体活动量每增加1个代谢当量(metabolic equivalent,MET),老年因心力衰竭住院的风险会降低17%。这提示,在心力衰竭发生前运动对心力衰竭的发展可能有防治作用,但是目前关于心力衰竭发生前运动对恶液质的影响和机制的研究较少。鉴于此,本研究以腹主动脉缩窄(abdominal aortic coarctation,AAC)诱导的射血分数保留型心力衰竭大鼠为模型,观察AAC 术前4 周的跑台运动干预对大鼠心脏功能、心源性恶液质的影响,观察脂肪组织表型转变,测定炎症调节因子C 反应蛋白(C-reactive protein,C-RP)、白细胞介素-6(interleukin-6,IL-6)及脂肪组织炎症的改变,探究术前运动干预对心力衰竭时机体恶液质的防治作用和可能机制。
1 材料与方法
1.1 实验动物与分组
5 周龄雄性Spraque-Dauley(SD)大鼠购于北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006。动物分笼饲养,室内温度为22℃± 5℃,湿度为50% ± 10%,明暗交替周期为12 h,自由进食和饮水。适应性饲养1 周,待体重达220± 10 g时,随机分成假手术对照组(CON组,n=8)、腹主动脉缩窄组(AAC 组,n=8)和跑台运动干预加AAC 组(E+AAC 组,n=8)。E+AAC 组进行持续4 周的跑台运动,跑台速度26 m/min,每次运动40 min,每周5次,持续4周,每次训练在下午6点至8点间进行,不使用声、光、电等刺激手段。4 周后,CON 组进行假手术,AAC组和E+AAC组进行AAC手术。
1.2 腹主动脉缩窄术诱导的心力衰竭大鼠模型建立
术前禁食12 h,自由饮水。大鼠用戊巴比妥钠(50 mg/kg)腹腔注射麻醉,使其仰卧,固定。腹左侧备皮,用3%碘伏消毒,于左肋弓下缘0.5 cm、腹正中线旁0.5 cm 处行1.5~2.0 cm 纵切口,逐层分离皮下组织、进入腹腔。用生理盐水纱布将肠管推向腹腔右侧、隔离,同时用生理盐水浸湿纱布将胃体、脾脏向上轻推隔离,可显露后腹膜及左侧肾脏。找到左肾动脉,在左肾动脉上方分离腹主动脉,AAC组和E+AAC组用银夹造成腹主动脉部分狭窄(银夹内径0.7 mm),CON 组仅分离血管,腹腔内滴入青霉素(40 万U/ml)适量,逐层缝合、关腹[12]。
1.3 大鼠超声心动图测定
术后6 周,使用VisualSonics Vevo@2100 小动物超声影像系统(Fujifilm VisualSonics,加拿大)测定各组大鼠心功能。测前腹腔注射戊巴比妥钠(50 mg/kg)麻醉大鼠,胸部备皮,仰卧位将头部及四肢固定在木板上,将探头置于左前胸,与前正中线呈30°左右的夹角,显示胸骨旁左室长轴切面;探头顺时针旋转90°可显示左室短轴切面图像。于胸骨旁左室长轴切面二维测量左室室壁厚度等;在二维引导下,将取样线置于左室健索水平,取M型曲线,进行心功能测量。超声心动图测量指标包括:左室舒张末期内径(left ventricular inner dimension diastolic,LVIDd)与收缩末期内径(left ventricular inner dimension systole,LVIDs);左室舒张末期前壁厚度(left ventricular anterior wall diastolic,LVAWd)与后壁厚度(left ventricular posterior wall diastolic,LVPWd);左室射血分数(left ventricular ejection fraction,LVEF)。所有测值均测量3 个心动周期取平均值。
1.4 取材
超声心动图测定结束后,各组大鼠禁食过夜,自由饮水,腹腔注射戊巴比妥钠(Sigma,美国)(50 mg/kg)麻醉。经腹主动脉取血,用于ELISA 测试。动物处死后,分离心脏组织、比目鱼肌、腓肠肌、内脏脂肪(附睾脂肪)、皮下脂肪(腹股沟脂肪)和褐色脂肪(背部肩胛骨间脂肪),分别称重心脏组织、比目鱼肌、腓肠肌、内脏脂肪、皮下脂肪组织并记录。取部分左心室、脂肪组织和骨骼肌放入4%多聚甲醛中固定,用于后续的染色,其他部分放入-80℃保存用于后续mRNA的测定。
1.5 ELISA法检测IL-6、C-RP水平
腹主动脉取血,缓慢注入含有10%EDTA-2Na 100 μl(Sigma,美国)的试管中混匀,4℃、3000 rpm/min离心10 min,分离血浆。按ELISA试剂盒(华英生物,北京)要求步骤测定C-RP和IL-6浓度,在反应结束后15 min内用酶标仪在450 nm波长处测量各孔光密度值,并计算血浆中C-RP和IL-6的浓度。CRP的灵敏度<0.05 pg/ml,曲线范围0~10 mg/ml,批内变异系数<8%,批间变异系数<10%;IL-6的灵敏度<3 pg/ml,曲线范围0~800 pg/ml,批内变异系数<4.5%,批间变异系数<8%。
1.6 HE染色观察脂肪组织形态
将大鼠脂肪组织在4%多聚甲醛中固定24 h后,进行梯度酒精脱水,二甲苯浸泡透明,再用石蜡浸泡6 h后进行包埋,用切片机将包埋好的组织块切成5 μm厚度贴在载玻片上,用于后续的染色观察。石蜡切片放在65℃的烘箱中烤片1 h,二甲苯浸泡20 min,共两次。依次用100%、95%、75%、50%乙醇、PBS 复水。使用苏木精染色20 s 后,用蒸馏水漂洗2~3 次,再用伊红染色20 s,蒸馏水漂洗2~3 次。依次用75%、95%、100%乙醇脱水(各两次,每次20 s),二甲苯透明(两次,每次2 min),中性树胶封片,常温保存。随机抽取各组动物切片(n=3),使用奥林巴斯BX51系统显微镜(OLYMPUS,日本)分别在40×视野下进行观察组织结构。
1.7 天狼星红染色检测心肌纤维化
将大鼠心肌组织在4%多聚甲醛中固定24 h后,进行梯度酒精脱水,二甲苯浸泡透明,再用石蜡浸泡6h后进行包埋,用切片机将包埋好的组织块切成5 μm厚度贴在载玻片上,用于后续的染色观察。石蜡切片放在65℃的烘箱中烤片1 h,二甲苯浸泡20 min,共两次。依次用100%、95%、75%、50%乙醇、PBS 复水。使用苏木精染色20 s后,用蒸馏水漂洗2~3次,天狼星红染色液滴染1 h,蒸馏水漂洗2~3次。依次用75%、95%、100%乙醇脱水(各2 次,每次20 s),二甲苯透明(2次,每次2分钟),中性树胶封片,常温保存。随机抽取各组动物切片(n=3),使用奥林巴斯BX51 系统显微镜(OLYMPUS,日本)在10×和20×视野下进行观察心肌纤维化情况。
1.8 Real-time PCR检测脂肪组织中目的基因表达
使用动物组织总RNA 提取试剂盒(TianGen Biotech,北京)提取组织总RNA,使用反转录试剂盒(Tian-Gen Biotech,Beijing)进行逆转录。real-time PCR反应体 积 共20 μl:Super Real Pre Mix Plus (SYBR Green)体 系(TransGene Biotech,Beijing)15 ml,10 mmol/L的上下游引物各0.5 μl,cDNA模板5 μl。所有引物均由生工生物工程(上海)股份有限公司合成。经94℃30 s,94℃5 s,60℃34 s,热循环40 次。Realtime PCR 于LightCycler96 荧光定量PCR 仪(Roche,Switzerland)上进行,以GAPDH 作为内参,具体检测基因包括:褐色化标志基因UCP-1 和过氧化物酶体增殖物激活受体γ辅助激活因子α( peroxisome proliferatoractivated receptor γ coactivator-1α,PGC-1α),白色脂肪标志基因脂联素(adiponectin)、瘦素(leptin);炎症类基因:M2 型巨噬细胞标志基因白介素10(interleukin-10,IL-10),血红蛋白清道夫受体(cysteine-rich scavenger receptor type 1 M130,CD163),M1 型巨噬细胞标志基因诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)。采用2-ΔΔCT法进行计算。所用引物序列见表1。
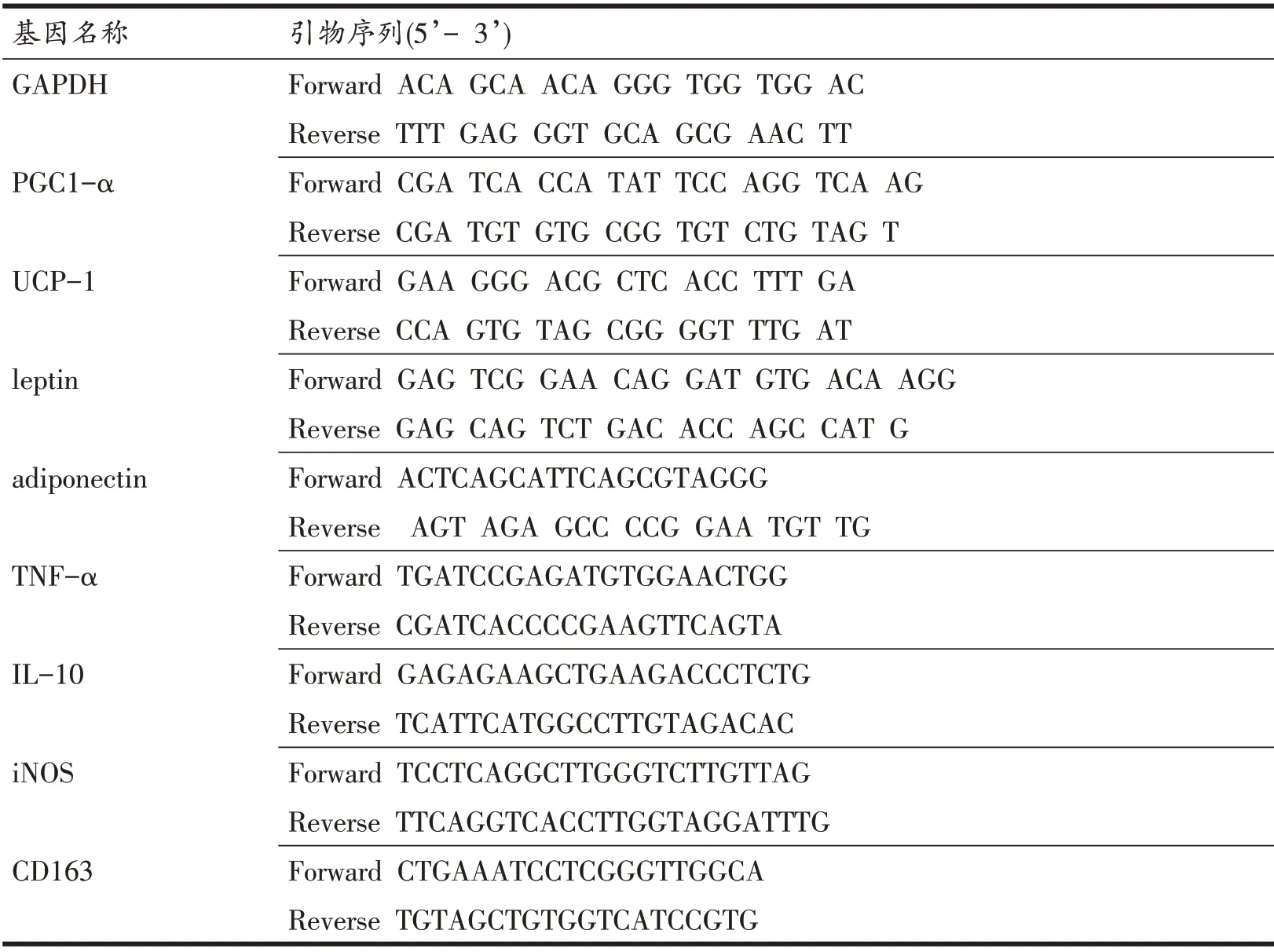
表1 real time PCR引物序列
1.9 统计方法
数据采用PRISM 6.0软件进行统计分析。实验结果以均数±标准差(±s)表示。组间差异采用单因素方差分析,方差分析后采用多重比较检验比较三组两两之间是否具有显着性差异,多重比较采用Newman-Keuls检验,P<0.05为差异具有统计学意义。
2 结果
2.1 运动对腹主动脉缩窄大鼠心脏结构和功能的影响
与CON 组相比,6 周AAC 大鼠的心重/体重显着升高(图1A)(P<0.01),LVIDs 和LVIDd 显着增加(图1B、C)(P<0.001 和P<0.05),LVAWd 和LVPWd 显着增加(图1D、E)(P<0.05 和P<0.01),LVEF 显着降低但仍大于50%(图1F)(P<0.01),心肌天狼星红染色结果表明AAC组大鼠心肌出现纤维化(图1G)。与AAC组相比,E+AAC 组大鼠心重/体重显着下降(图1A)(P<0.01),LVIDs 和LVIDd 显着降低(图1B、C)(P<0.01 和P<0.05),LVAWd 显着降低(图1D)(P<0.05),LVEF 显着提升(图1F)(P<0.05),天狼星红染色结果显示心肌纤维化有所改善(图1G),提示运动改善了大鼠的心脏肥大及心肌纤维化。
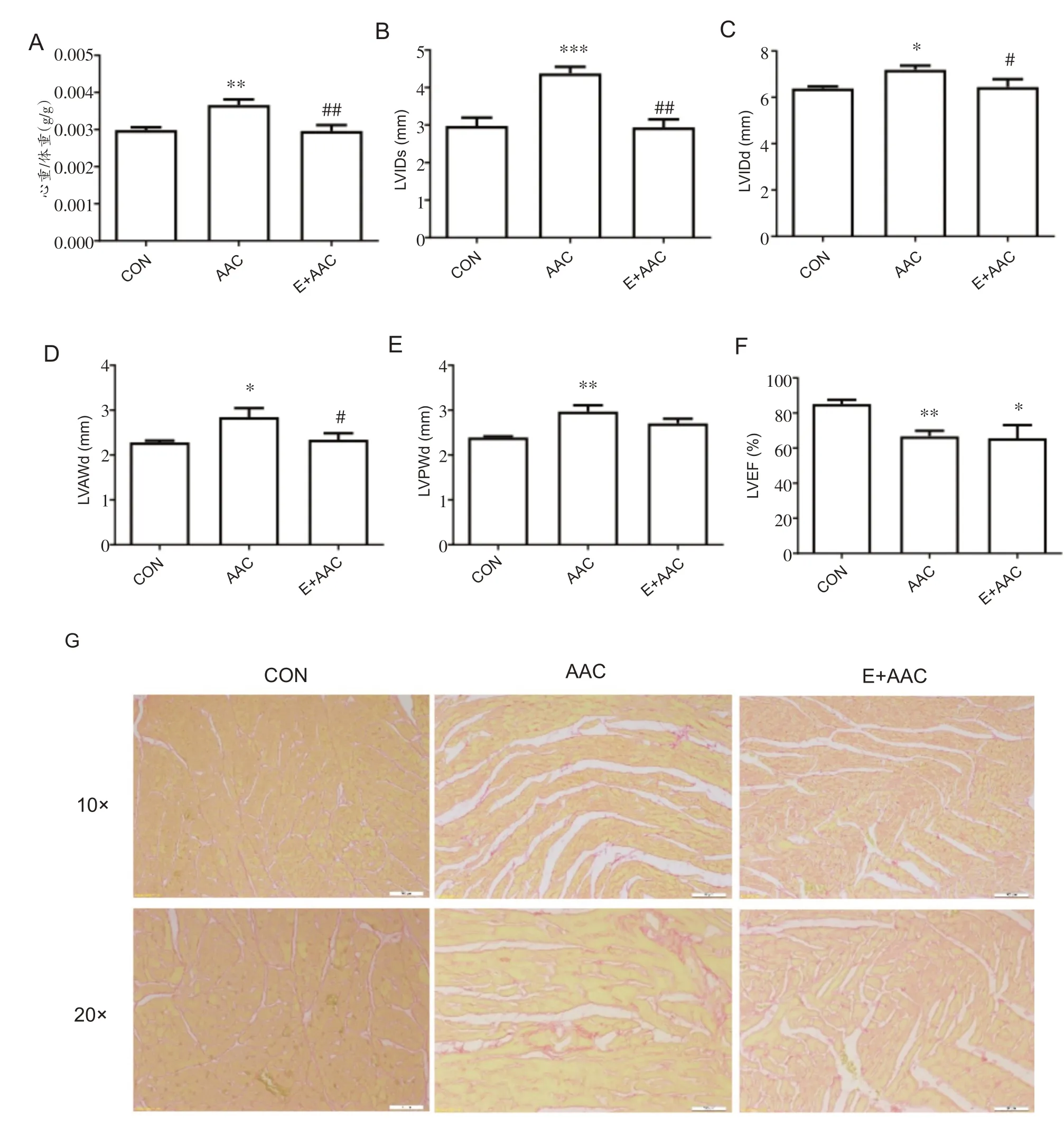
图1 各组大鼠心脏结构和功能指标比较
2.2 运动对腹主动脉缩窄大鼠体重、骨骼肌和脂肪重量的影响
与CON 组相比,AAC 组大鼠体重显着下降(P<0.05),皮下脂肪和内脏脂肪的重量显着下降(P<0.001和P<0.05),比目鱼肌和腓肠肌的重量均显着下降(均P<0.01),提示AAC 大鼠出现心源性恶液质。与AAC组相比,E+AAC组大鼠体重显着增加(P<0.05),皮下脂肪重量显着上调(P<0.05),内脏脂肪、比目鱼肌和腓肠肌重量有所增加,但差异无统计学意义(表2)。
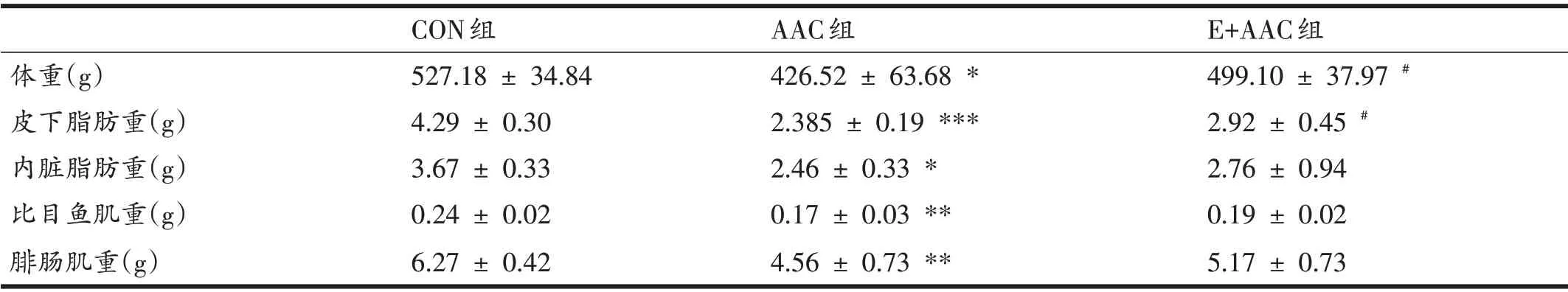
表2 各组大鼠体重、骨骼肌以及脂肪重量比较
2.3 运动对AAC大鼠脂肪组织形态和表型的影响
与CON 组相比,AAC 组大鼠褐色脂肪组织中细胞体积减小,脂滴变小(图2A),UCP-1 和PGC-1α的mRNA 表达显着增加(图3A)(均P<0.05),leptin 的mRNA 表达显着下调(图3A)(P<0.05);皮下脂肪组织细胞横截面积减小(图2B),adiponectin mRNA 表达显着下调(图3B)(P<0.01);内脏脂肪组织中细胞横截面积减小(图2C),adiponectin和leptin mRNA表达显着下调(图3C)(P<0.01,P<0.001)。
与AAC组相比,E+AAC组大鼠褐色脂肪组织中细胞形态恢复正常,脂滴变大(图2A),UCP-1 和PGC-1α的mRNA表达显着减少(图3A)(均P<0.05);皮下脂肪组织中细胞形态无显着变化(图2B),leptin的mRNA表达显着上调(图3B)(P<0.05);内脏脂肪组织中细胞形态无显着改变(图2C),adiponectin mRNA 表达显着上调(图3C)(P<0.05)。
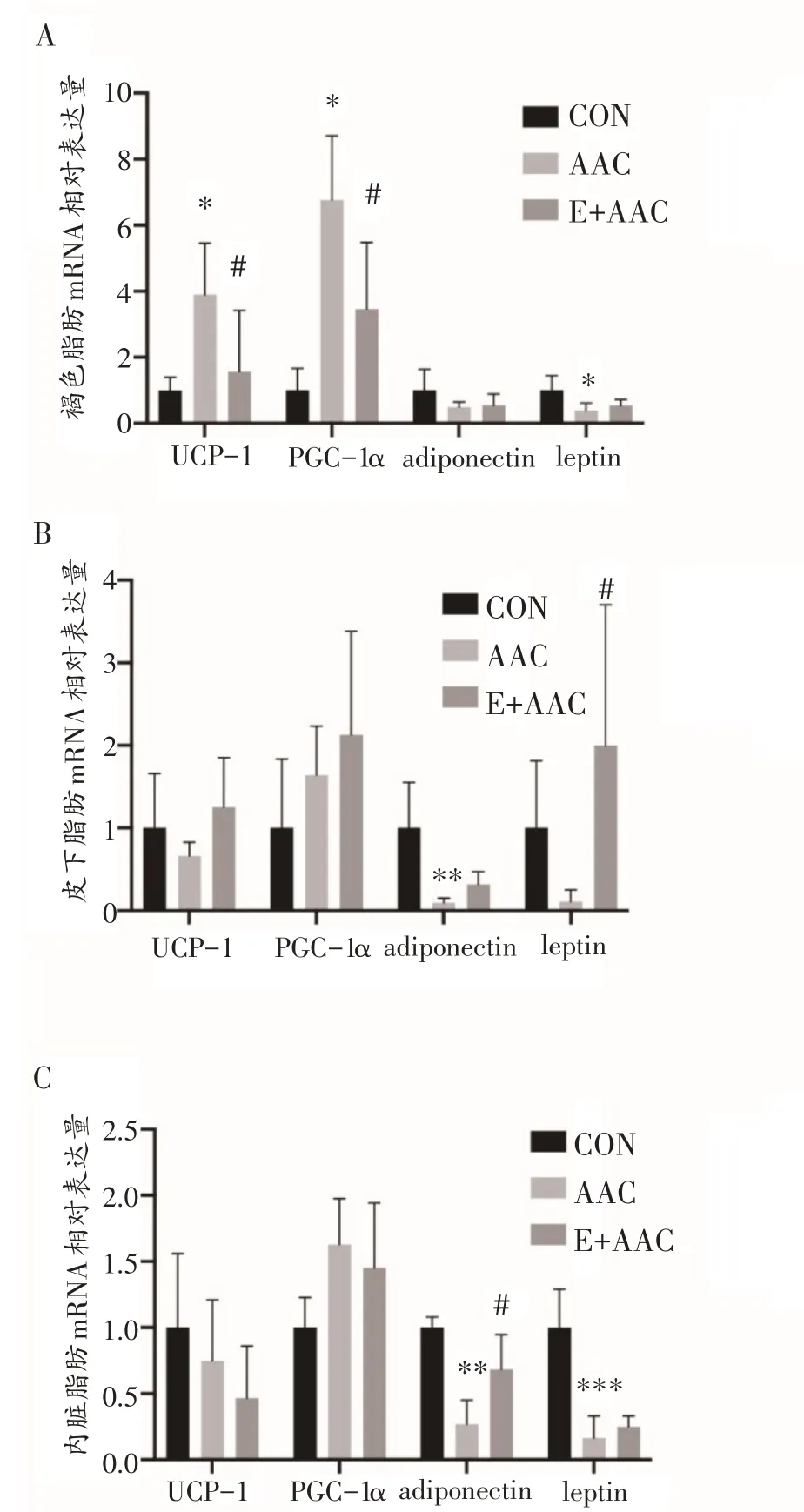
图3 大鼠脂肪组织UCP-1、PGC-1α、adiponectin和leptin基因表达的变化
2.4 运动调节AAC大鼠机体的慢性炎症
与CON 组相比,AAC 组大鼠血浆中C-RP 和IL-6水平显着上调(图4A、B)(均P<0.001),表明机体处于慢性炎症状态。褐色脂肪中IL-10和CD163 mRNA表达表达显着上调(均P<0.05),iNOS和TNF-α mRNA表达显着上调(图5A)(P<0.01 和P<0.001),在皮下脂肪中IL-10、iNOS和TNF-α mRNA表达显着上调(图5B)(均P<0.05),内脏脂肪中IL-10、CD163和iNOS mRNA表达显着上调(图5C)(均P<0.05),脂肪组织中炎症水平显着上调。与AAC组相比,E+AAC组大鼠血浆中CRP和IL-6水平显着下调(图4A、B)(均P<0.001),褐色脂肪中IL-10、CD163、iNOS和TNF-α mRNA表达均显着下调(图5A)(P<0.05,P<0.05,P<0.05和P<0.01),皮下脂肪组织中IL-10、iNOS和TNF-α mRNA表达显着下调(图5B)(均P<0.05),以上结果表明术前运动干预能够有效减轻心力衰竭时脂肪组织炎症和机体慢性炎症。
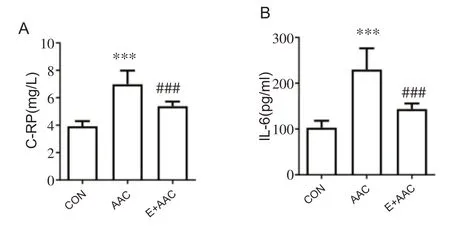
图4 大鼠血浆中C-RP、IL-6水平比较
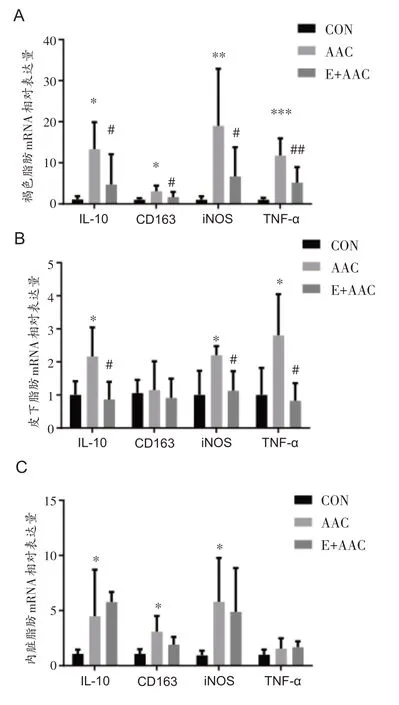
图5 大鼠脂肪组织中IL-10、CD163、iNOS和TNF-α基因表达的变化
3 讨论
3.1 运动对心力衰竭发展的预防作用
运动对心血管健康的促进作用已成为共识。有研究表明,良好的身体锻炼习惯对心力衰竭的发生具有保护性作用[8]。运动可以改善心脏的结构和功能,降低心力衰竭的风险。一项为期12年、对2925人的健身状况与心脏功能的纵向研究发现,较高的运动强度与心脏舒张功能障碍的发生率和心脏重塑的患病率成反比[13]。与健康久坐的年轻人群相比,健康但久坐的老年人群出现左室顺应性,左室舒张功能异常[14]。本研究在AAC手术前,对大鼠进行4周的跑台运动干预,发现大鼠心室壁厚度、舒张与收缩末期左心室内径均显着降低,心肌纤维化程度降低,提示运动对心力衰竭发生后心脏肥大和心功能下降有较好的预防作用。
3.2 运动对心源性恶液质的预防作用
肥胖通常与心血管疾病,尤其是心力衰竭的发病率成正相关,但心力衰竭时,肥胖对于患者的预后更为有利,这种现象被称为“肥胖悖论”[15],可见脂肪组织是改善心力衰竭至关重要的靶点。研究发现,心力衰竭患者脂肪组织存在代谢失衡现象,导致体重减轻,心源性恶液质发展[16]。在肾切除后4 周醛固酮诱导的C57小鼠HFpEF 模型中,小鼠皮下脂肪和内脏脂肪中细胞体积明显减小,脂肪组织中UCP-1、Cidea 等褐色化标志基因表达显着上调,内脏脂肪组织中Adiponectin、leptin等白色脂肪标志基因的表达显着下调,白色脂肪组织出现明显的褐色化[17]。Panagia 等[18]发现在心梗小鼠模型,褐色脂肪组织体积显着减小,UCP-1 mRNA表达显着上调,褐色脂肪组织过度激活。运动对心力衰竭时脂肪组织褐色化具有明显的抑制作用。有研究发现4 周跑台运动能够改善心力衰竭诱导的脂肪组织重量的下降,抑制褐色脂肪组织的过度激活,改善机体恶液质[10]。本研究结果显示,心衰时大鼠体重和骨骼肌重量下降,白色脂肪组织重量降低、细胞横截面积减小,褐色脂肪组织脂滴变小、褐色化标志基因UCP-1和PGC-1α表达上调,出现褐色脂肪的过度激活,提示脂肪组织出现恶液质现象;心力衰竭发生前进行跑台运动能够上调体重和皮下脂肪组织重量,褐色脂肪组织脂滴增大,褐色化标志基因显着下调,其过度激活受到明显抑制,骨骼肌重量有所增加但差异无统计学意义。以上结果提示术前中小强度的运动显着抑制了心力衰竭时脂肪组织的恶液质,减缓了心源性恶液质的发生。
3.3 运动改善大鼠心源性恶液质的炎症机制
心源性恶液质受多种因素的调节,氧气运输与利用障碍、氧化应激、细胞凋亡及自噬和内分泌紊乱都会导致机体出现恶液质,其中炎症水平升高是重要机制之一[19]。脂肪组织炎症水平的升高会导致机体各项功能发生紊乱,影响其它的器官和组织,最终加剧恶液质的发展。在高脂诱导的肥胖小鼠中,附睾脂肪TNF-α、IL-1β、MCP1、F4/80基因的表达显着上调,表明脂肪组织出现炎症[20]。心力衰竭患者通常伴有慢性低水平的全身炎症,这对于脂肪组织和骨骼肌都会产生持续的影响。本研究测定了脂肪组织的炎症因子表达的变化,发现脂肪组织产生的大量炎症因子可能是心力衰竭时慢性炎症的主要来源。Shimizu等[21]报道胸主动脉缩窄诱导的小鼠心力衰竭模型中,内脏脂肪中发生了巨噬细胞的浸润,促炎因子TNF-α和MCP1 mRNA 表达显着上调,内脏脂肪组织的慢性炎症会加剧心力衰竭的发展。本研究中,AAC诱导的心力衰竭大鼠,血浆中C-RP 和IL-6 水平显着上调,脂肪组织中炎症因子上调,表明大鼠体内炎症反应显着增强。运动作为治疗恶液质的有效干预手段之一,能够通过减轻氧化应激,抑制骨骼肌凋亡,抑制蛋白质降解,以及减轻机体炎症等多种作用机制,改善骨骼肌萎缩和脂肪组织的褐色化[10,19,22]。但目前关于运动改善心源性恶液质的机制尚未明了。本研究发现术前运动干预显着抑制了AAC大鼠血浆中C-RP、IL-6的水平和脂肪组织中促炎因子的表达。巨噬细胞被认为是脂肪组织中炎症发生的关键细胞。巨噬细胞根据其极化状态的不同可以分为M1 型(经典活化)或M2 型(选择性活化)巨噬细胞[23]。M1 型巨噬细胞的增加会导致TNF-α和IL-6 等各种促炎细胞因子的表达升高,加剧脂肪组织炎症[24]。有研究发现在脂肪组织中M2型巨噬细胞极化后,释放抗炎细胞因子激活脂肪细胞中的β肾上腺素受体,促进产热基因的表达如UCP-1、PGC1-α等,导致脂肪组织褐色化[25]。本研究发现在心衰时脂肪组织中M1 和M2型巨噬细胞标志基因的表达均显着增加,运动干预能够抑制M1和M2巨噬细胞的极化。以上研究结果提示运动可能是通过下调脂肪组织的炎症水平和抑制脂肪组织M1 和M2 巨噬细胞的激活,从而降低机体慢性炎症水平,改善脂肪组织褐色化和心源性恶液质。
4 结论
AAC诱导的心力衰竭大鼠心肌肥大、心功能下降、体重下调、骨骼肌重量和白色脂肪组织重量降低、褐色脂肪组织过度激活,发生明显的心源性恶液质;术前运动干预可以改善AAC 诱导的心肌肥大、抑制褐色脂肪组织的过度激活,减缓脂肪组织恶液质的发展;运动对机体慢性炎症的调节,可能是运动抑制脂肪组织恶液质的潜在机制。



