邵安健,邵宗仲,陈海松,高玉明,王和风
(安徽省绩溪县人民医院,安徽绩溪 245300)
人体其他组织脏器恶性肿瘤非浸润性的胃转移临床极其罕见[1-2]。笔者现将2例转移性胃癌的临床诊断过程报道如下。
1 临床资料
病例1,女性70岁,因头昏、乏力、气短3月渐加重,2008年5月15日首次就诊,重度贫血血红蛋白(HGB):47 g·L-1,仅住院3 d,未明确诊断即出院。2008年6月12日第2次以贫血再次入院,胃镜检查发现胃体部两处不相连的乳头状隆起新生物(见图1),大小分别约为1.5 cm ×1.5 cm、2.5 cm×2.0 cm,表面有糜烂及白色污苔,底透淡红,隆起新生物病灶组织边界清晰,与周边胃黏膜组织色泽不一致。内镜下常规活检病理(见图2)报告:鳞上皮样组织中—重度不典型增生,疑为鳞状细胞癌(鳞癌),建议再送检。后选择外科手术治疗,大病理提示透明细胞癌胃转移。
病例2,男性71岁,因腹胀、纳差、头昏、乏力、消瘦月余,于2011年5月13日就诊时:查血HGB:76 g·L-1;肝胆超声检查提示:肝实质性占位;腹部CT提示:肝、脾多发性占位;胃镜检查:发现胃体部有一椭圆形扁盘状新生物(见图3),大小约3.0 cm×2.5 cm ×1.0 cm,表面糜烂充血水肿,有一纵向的溃疡灶位于该新生物的中下部,溃疡灶表面有污苔及血痂。该隆起新生物病灶组织边界清晰,与周边胃黏膜组织色泽不一致,内镜下活检其组织质地稍脆。以肝占位、胃体新生物被收住院,进一步检查临床诊断为肺癌肝、胃转移。
2 诊治方法
病例1,胃镜检查食管、贲门部均未见异常,胃体部病变组织病理报告:鳞上皮样组织,疑为鳞状细胞癌。病理科建议再送检,内科医师准备再次通过胃镜等离子射频套切获取更大块组织标本后送病理,外科医师考虑胃癌诊断明确,有手术指征。术前检查胸部X线未见异常,血肿瘤标志物癌胚抗原(CEA)、甲种胎儿球蛋白(AFP)、CA199,CA125皆正常。于2008年6月23日行胃癌根治手术。术后病理(图4)报告:胃体部双发蕈伞型恶性肿瘤(不排除转移癌)。病理科医生报告癌细胞呈透明细胞改变,建议行肾脏影像学检查。2008年7月7日患者门诊随访行腹部CT增强扫描,报告:左肾下极有大小约3.4 cm×4.5 cm占位性病变,考虑原发肾癌。结合胃镜病理,临床明确诊断为左肾透明细胞癌胃转移。2008年7月14日以:“胃癌术后,肾癌”第3次住院治疗,未发现胃以外其他组织脏器转移。患者于2010年4月死亡。本例以腹胀、乏力、重度贫血等症状就诊,门诊询问后发现有黑便史。在胃大部切除术后病理提示下,才发现原发肾脏肿瘤病灶。由于患者无明显腰胀、血尿等表现,加上临床医生病史采集欠详实、体检未做到系统全面,以及对转移性胃癌缺乏认识等多因素制约,患者的原发肾癌未能被及时诊断,影响了治疗和预后。病例2,胃镜活检病理(见图5)报告:鳞癌。胃原发性鳞癌是一种十分罕见的胃癌类型,占比不足胃癌的1%[3]。胃的原发性鳞癌内镜下无特异表现[4],且大多发生于胃窦部[5]。转移性胃癌胃镜检查主要呈隆起的中间有溃疡的病灶[6]。本例病灶在胃体部,其食管光滑无溃疡或增生病灶等癌变征象,不考虑食管来源的鳞癌。考虑到临床上鳞癌常见于肺脏组织,嘱行胸部X线检查,发现右上肺肿块影,进一步行胸部CT增强扫描提示:右上肺叶结节影,大小约5.0 cm,考虑右上肺周围型肺癌。对腹部CT片再读,其肝脾多发占位符合转移癌影像特征。查血 CEA:23.0 μg·L-1,CA199:680.55 U ·mL-1,AFP 正常,HBsAg(-)。2011年5月17日临床明确诊断:右上肺癌伴肝脾及胃广泛转移。行保守、支持治疗,患者于2011年6月25日死亡。本例双发癌或胃癌肝、肺转移都作了鉴别和排除。患者病程中有黑便史,但咳痰、胸痛等呼吸道症状不明显,亦无咯血。
3 结果
本组转移性胃癌患者均以非典型的恶性肿瘤原发组织脏器相应疾病的临床症状表现就诊。胃镜检查均发现胃体部息肉样隆起病变,病灶组织边界清楚。胃镜活检组织病理难以确定胃的原发或转移性癌,且其病理都表现鳞状细胞癌特征。影像学检查发现了肿瘤原发组织脏器病灶。
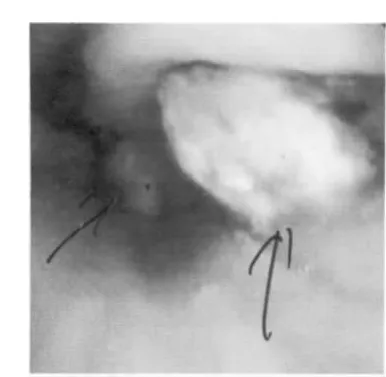
图1 病例1胃镜检查
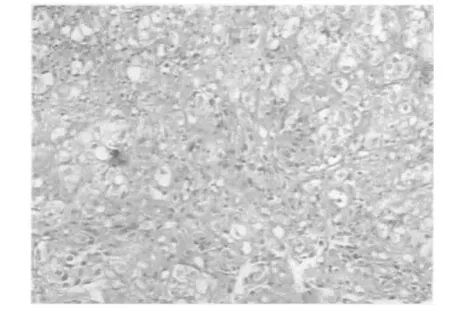
图2 病例1胃镜活检病理图
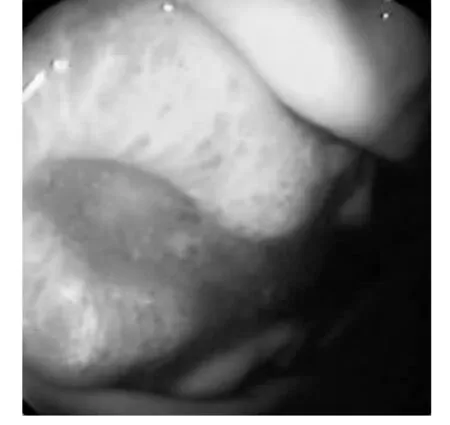
图3 病例2胃镜检查
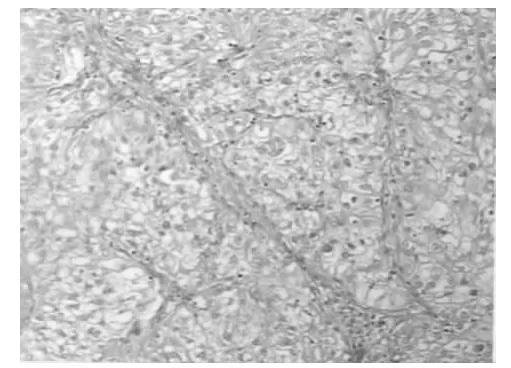
图4 病例1术后病理图

图5 病例2胃镜活检病理图(HE染色100)
现回顾并行病理免疫组化检测结果:病例1,考虑为透明细胞癌胃转移,其肾癌标记物CD10、Vim阳性,RCC、CK7、CK20阴性表达。RCC为肾细胞癌特异性标记,据报道80%或更多的透明细胞性肾细胞和乳头状肾细胞癌阳性表达,而嫌色细胞癌阴性;CD10做为辅助诊断指标之一,在89%的肾细胞癌病例中表达;Vim在肾细胞癌中常呈强阳性表达;CK7在透明细胞癌中通常阴性而在嫌色细胞癌中阳性表达。综合本病例左肾明确占位病史,胃手术病理组织学示泡巢状结构,胞浆淡染,局部胞浆嗜酸性染色,有薄壁血管构成的网状结构,无核周空晕,肿瘤组织与周围胃黏膜之间没有明确的异型腺上皮过渡,结合免疫标记,考虑肾透明细胞癌胃转移。病例2,胃黏膜肿瘤组织CK高、CK5/6、P63阳性,CK7、CK20、Napsin、TTF1 及 Villin 阴性表达。CK 高、CK5/6、P63为明确的鳞状细胞癌标记;CK7临床常用于标记肺腺癌、卵巢癌等;CK20、Villin常用于标记胃肠道腺癌;Napsin抗体与TTF1联用以区别原发性肺腺癌与其他器官源性腺癌。本例病理组织学特征倾向鳞状细胞癌,血CEA、CA199增高,AFP正常,HBsAg(-),结合右上肺单发占位、肝脾多发占位病史,综合免疫标记结果,可支持诊断为肺鳞状细胞癌胃及肝脾多发转移。
4 讨论
临床上一旦发现转移性胃癌已属原发肿瘤晚期,预后差[1],也没有统一的治疗方案。有报道称[7],手术治疗只能改善转移性胃癌患者的局部症状,并不能延长生存期。肾癌胃转移恶性程度高,手术彻底切除转移病灶是主要治疗方法,可防止肿瘤再次引起消化道出血,术后是否免疫治疗尚无定论[8]。肺癌在临床较为常见,肺癌初期症状多不明显,加上肺部血运丰富易发生转移[9]。肺癌胃转移多伴有脑、骨、肝等多处转移,不推荐手术治疗,除非为了控制出血[10]。是否为转移性胃癌决定着患者的预后及临床治疗方案的选择,因此,识别和诊断胃内形态鲜见的新生物,以及病理类型少见的胃癌是否为转移性胃癌是必要的。
本组2例转移性胃癌有以下特点:(1)患者就诊前没有任何组织肿瘤诊断、治疗的病史提供;(2)2例原发病灶均不明,均是以腹胀不适、出血(黑便)、贫血(头昏、乏力)等消化道症状就诊;(3)胃内转移病灶皆为胃体部突起于胃黏膜表面的息肉样的增生组织病灶,病灶与周边胃黏膜组织界限清晰,与周边胃黏膜的色泽也不一致。而且与平常内镜所见原发性胃癌,常见胃息肉、平滑肌瘤及间质瘤等增生型病灶有显着的形态学的差异;(4)一个以上相似病灶之间并不相连;(5)内镜活检病理皆不能十分清晰地判断为转移癌,但都有鳞状细胞癌样或低分化癌的特征倾向。
国内转移性胃癌临床报道多为个案报道[2],2007年以来报道逐渐增多。有文献认为消化系外其他组织脏器恶性肿瘤的非浸润性胃转移,以原发恶性黑色素瘤和乳腺癌来源病例数相对多见,其次是原发肝癌、肺癌等[1,11]。但从万方等数据库检索统计,1990—2013年国内涉及转移性胃癌的全部文献30篇,剔除重复病例,共报道患者34例,其原发癌依次是恶性黑色素瘤14例,原发肝癌8例、肺癌6例、肾脏透明细胞癌4例、乳腺癌胃转移2例,乳腺癌胃转移更为罕见。
由于转移性胃癌缺乏特异性临床表现,因此对以贫血、消化道出血症状就诊,胃镜检查发现隆起型的增生组织病灶,肉眼判断为恶性者,不能仅作原发性胃癌的判断。尤其要注意:(1)病灶在胃底、胃体部,异样、鲜见的隆起样新生物,边界清楚,表面粗糙,质感不同于胃黏膜组织,病灶形态、类型与常见的原发性胃癌不同者;(2)息肉样、间质瘤样隆起恶性病灶;(3)类似上述病灶多发者。若是转移性胃癌,常能同期发现原发脏器组织肿瘤病灶。因此,必要时肺、肾、肝等脏器的影像学检查不能遗漏,以便发现其他组织脏器肿瘤。
获取原发癌的病理组织学和/或细胞学诊断,对判断转移性胃癌与原发病灶的同源性,在诊断方面显然比对胃内病灶病理的免疫组织化学检测更直接,且具说服力。故对那些微创下就可以获取原发癌的病理组织学和/或细胞学诊断结果者,应该尽可能地做到这一点。
国外报道转移性胃癌内镜病理确诊率仅为15.6%[12],对活检组织取材少而不利病理诊断的病例,可利用等离子射频圈套套切隆起病灶,获取比常规活检更大的病变组织,乃至整个隆起的病变组织送病理,可以得到更为准确的病理诊断[13]。病理免疫组化检测在国内基层医院难以普及,目前许多县级医院未开展该项技术,而且对每一例胃镜活检提示癌变的病理都进行免疫组化检测既不现实,也不必要,毕竟转移性胃癌在临床上罕见。但对被列为重点识别对象的,内镜活检病理提示:“有鳞状上皮样、鳞状细胞癌、低分化癌”等非原发胃癌常见病理类型者,加上影像学检查发现其他组织脏器肿瘤时,则有必要进行病理免疫组化检测,以确定原发肿瘤或转移癌,以防止漏诊、误诊。多发肝癌胃转移易误诊为胃癌的肝转移[14],肺癌胃转移也会有这样的问题,通过免疫组化可做出诊断。以上2例临床诊断转移性胃癌,其病理皆为事后送江苏省中医院进行免疫组化检测,才进一步证实了转移性胃癌的临床诊断。
转移性胃癌的临床诊断相对复杂和困难,为了提高转移性胃癌的临床识别和诊断,应加强内镜医生对转移性胃癌的识别意识和对胃腔特殊病灶的识别能力;体格检查时应认真、仔细,注重与病理科医生的沟通,必要时还需行胃镜活检病理免疫组化检测。
[1] 刘艳萍,金 博,王琦三.不同原发部位胃转移癌12例[J].世界华人消化杂志,2012,20(22):2092-2096.
[2] 段纪成,杨家和,岳海燕.原发性肝癌胃转移的诊断与治疗(附2例报道与文献复习)[J].肝胆外科杂志,2013,21(5):339-400.
[3] Juan Rosai,回允中 主译.阿克曼外科病理学[M].9版.沈阳:辽宁教育出版社,1999:637-638.
[4] 毛庆东,张晓娟,张海燕,等.胃原发性鳞状细胞癌一例[J/CD].中华临床医师杂志(电子版),2013,7(10):4625-4626.
[5] 程 骏,韩少良,吴秀玲.原发性胃腺鳞癌和胃鳞癌的临床病理特点分析[J].中华普通外科杂志,2009,24(5):359-361.
[6] 邱江锋,林天胜,吴培仁,等.原发性肝细胞肝癌胃转移一例[J].中华胃肠外科杂志,2008,11(5):506.
[7] Wu MH,Lin MT,Lee PH.Clinicopathological study of gastric metastases[J].World J Surg,2007,31(1):132-136.
[8] 吴承耀,张振声,许传亮,等.肾透明细胞癌胃转移的诊断和治疗(附1 例报告)[J].第二军医大学学报,2011,32(5):575-577.
[9] 吴志德.肿瘤标志物在肺癌联合诊断的临床应用分析[J].安徽医药,2013,17(5):793-795.
[10]陈俊妮,袁 波,张艳丽,等.原发性肺癌胃转移1例[J].广东医学,2012,33(10):1369.
[11]廖 峰,刘秀峰,黄 勇,等.原发性肝癌肺转移、脑转移及胃转移1 例[J].现代肿瘤医学,2009,17(11):2229-2230.
[12] Oda,Kondo H,Yamao T,et al.Metastatic tumors to the stomach:analysis of 54 patients diagnosed at endoscopy and 347 autopsy cases[J].Endoscopy,2001,33(6):507-510.
[13]邵安健,曹红枝,朱志杰,等.等离子射频治疗消化道疾病111例临床观察[J].皖南医学院学报,2011,30(5):380-382.
[14]朱丽花,周 毅,王 亮.原发性肝细胞癌胃转移1例[J].实用医学杂志,2009,25(9):1395.



