徐 轲,张妍蓓,张晶晶
(1.安徽医科大学第一附属医院老年呼吸内科,安徽合肥 230022;
2.安徽医科大学第二附属医院肾脏内科,安徽合肥 230601)
小细胞肺癌(small cell lung cancer,SCLC)约占新发肺癌的15%左右,是一种高侵袭性肿瘤,生长迅速,易早期发生远处转移,预后差[1]。近几十年来,非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗获得了突飞猛进的进展,然而SCLC的治疗仍是以联合铂类的化学治疗为主。第一代铂类药物顺铂(cisplatin,DDP)有明显的毒副作用和治疗诱导性耐药等缺点,限制了其在临床的应用[2],因此探索可替代DDP且毒副作用小的新型铂类药物及其为基础的治疗方案一直是提高SCLC疗效的研究方向。洛铂(lobaplatin,LBP)是新型的第三代铂类抗癌药物,它的毒副作用相对较轻且与DDP无交叉耐药性[3]。但是LBP在SCLC治疗方面目前仍缺少大规模的临床研究,参考价值有限,所以我们拟采用Meta分析的方法,系统评价含LBP的化疗方案治疗SCLC的疗效和相关副作用,为临床提供决策依据。
1 资料与方法
1.1 纳入标准
1.1.1 研究类型 国内外公开发表的以LBP为基础的化疗方案治疗SCLC的随机对照研究(randomized controlled trials,RCT)。
1.1.2 研究对象 纳入标准:(1)经病理学或细胞学确诊证实的原发性SCLC患者,(2)且卡氏评分≥60分或体力状况(ECOG)评分为≤2分,(3)无化学治疗禁忌证,常规检查无异常。排除标准:①同时伴有其他恶性肿瘤,②同时伴有严重内科疾病或感染。
1.1.3 结局指标 主要结局指标:客观缓解率(objective response rate,ORR);次要结局指标:(1)白细胞计数减低发生率,(2)血红蛋白计数减低发生率,(3)血小板计数减低发生率,(4)胃肠道症状发生率。
1.2 文献检索 计算机检索 MEDLINE、Cochrane Library、EMBASE 等外文数据库和 CBM、CNKI、万方等中文数据库(检索时间限度:建库 -2014.11)。英文检索词:“Lobaplatin”“LBP”“small cell lung cancer”“SCLC”,中文检索词:“洛铂”“小细胞肺癌”“肺癌”“肺肿瘤”“化疗”。
1.3 文献筛选和资料提取 由两名评价者分别浏览和阅读获取文章进行相关信息和数据资料提取,并交叉核对。通过协商或由第三名评价者解决有分歧而不能确定的研究是否入选。提取信息和数据包括:文献发表的时间;LBP组和对照组的治疗方案;药物使用剂量;纳入标准和排除标准;随机方式;样本量;年龄;临床分期;主要和次要结局指标;中位生存期;失访及随访记录;不良反应。
1.4 质量评价 两位评价员独立选择试验、提取资料,按改良后的Jadad量表对RCT的质量进行评价[4],对于每一个研究结果的内容分为“低度偏倚”“高度偏倚”和“不清楚”。总评7分,1~3分判为低质量,4~7分判为高质量。
1.5 统计学方法 使用Stata 12.0软件对收集的数据实行 Meta分析。使用相对危险度(relative risk,RR)作为计数资料疗效评价统计指标,各效应量都以95%可信区间(confidence interval,CI)表示。采用χ2检验对入选文章结果之间的异质性实行统计学分析。当各研究相互之间没有统计学异质性(P>0.1,I2<50%)时,Meta分析按固定效应模型(fixed effect model)进行;当相互之间有统计学异质性(P≤0.1,I2≥50%)时,Meta分析按随机效应模型(random effect model)进行,同时运用亚组分析对异质性来源进行分析。
1.6 发表偏倚的评价 使用Begg’s检验为基础的漏斗图(funnel plot)和计算检测来评定数据之间是否存在发表性偏倚[5]。
2 结果
2.1 文献检索结果 所有数据库共检出相关的研究552篇,去掉重复结果后通过浏览文章题目和摘要初步入选14项研究,进一步全面阅读后排除非RCT研究,最终入选 9 项研究[6-14]。9 项 RCTs总计纳入510例患者(LBP组267例,对照组243例)。其中,治疗组和对照组分别为LBP+依托泊苷(etoposide,VP-16)和 DDP+VP-16 的文献 6 篇[7,10-14],LBP+伊立替康(irinotecan,CPT-11)和 DDP+CPT-11 的文献 2 篇[6,9],LBP+CPT-11 和 CBP+CPT-11的研究1篇[8]。纳入分析的研究中LBP组和对照组的基线资料均有可对比性,入选文章的基本资料见表1。
2.2 纳入文献质量评价结果 纳入的9项RCTs中,全部采用随机对照方法,但是只有 5 项[6-8,11,14]注明了利用随机数字表方法,所有研究均无失访/退出病例,有无ITT分析、是否选择性报道结果、是否采用盲法均未作描述。
2.3 Meta 分析结果
2.3.1 ORR 9项研究(510例患者)均报道了ORR[6-14],相互之间没有统计学异质性(P=0.434,I2=0)。Meta分析结果表明,LBP组和对照组之间ORR 相比无统计学差异[RR=1.06,95%CI(0.92,1.21),P=0.43],提示含 LBP 的化疗方案与对照组相比对SCLC的疗效相当(图1)。同时我们分别按照LBP组具体干预措施方案的不同、对照组铂类用法及用量、各研究入组例数、初治或复治分别进行疗效评价的亚组分析,结果显示对于不同的干预措施方案使用LBP联合CPT-11的化疗方案与对照组相比ORR差异有统计学意义[RR=1.43,95%CI(1.00,2.05),P=0.043];而对初治和复治患者进行亚组分析后表明,对于复治患者使用含LBP化疗方案与对照组相比ORR差异有统计学意义[RR=1.43,95%CI(1.00,2.05),P=0.042](图2)。
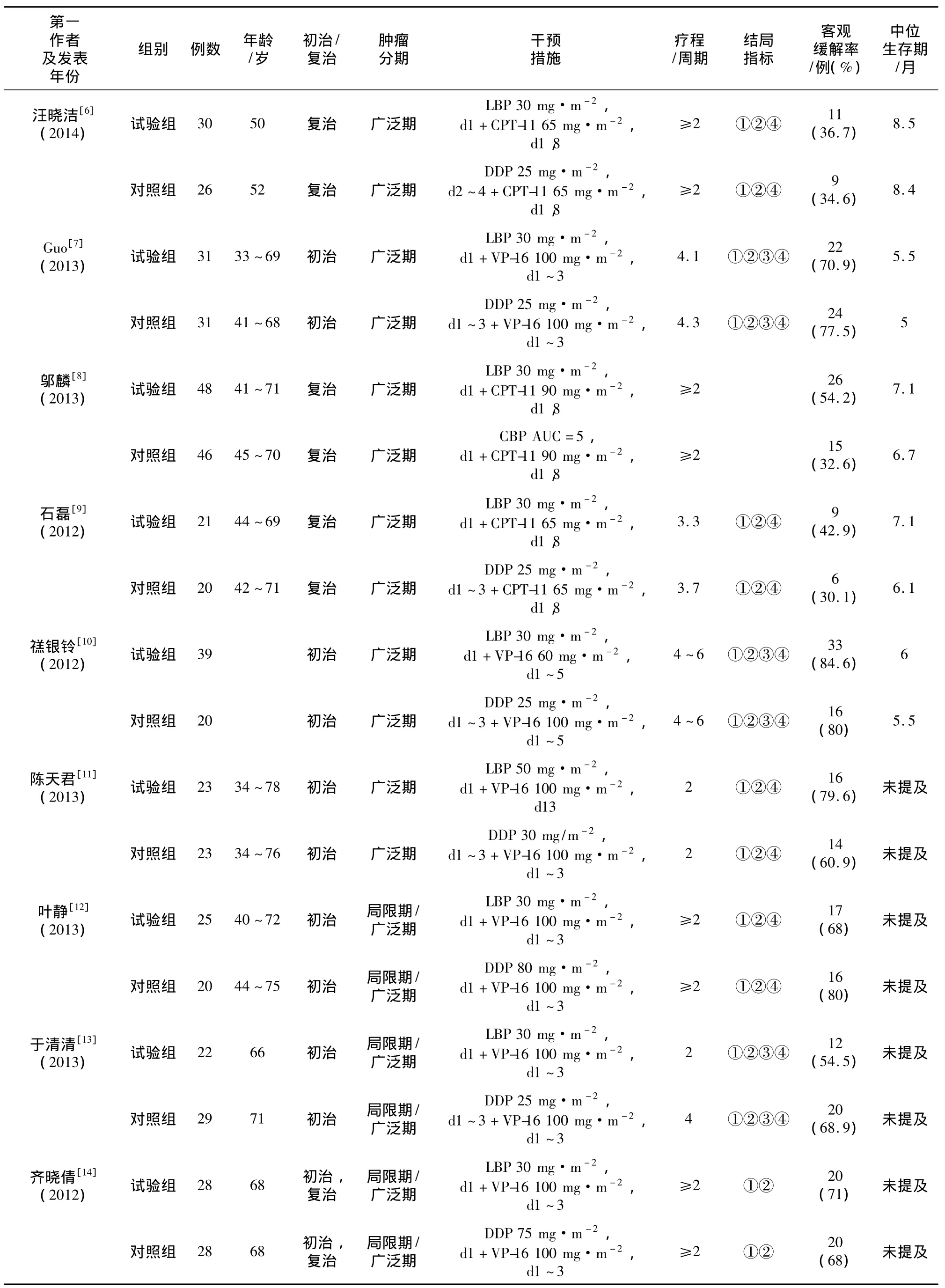
表1 纳入研究基本信息
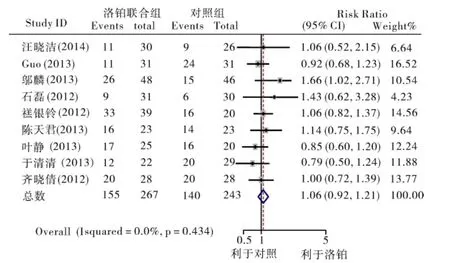
图1 两组患者客观缓解率的Meta分析森林图
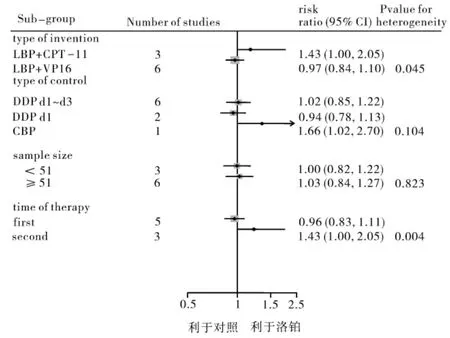
图2 客观缓解率的亚组分析森林图
2.3.2 Ⅲ/Ⅳ级白细胞减低发生率 8项研究(416例患者)报道了Ⅲ/Ⅳ级白细胞减低发生率[6,7,9-14],相互之间没有统计学异质性(P=0.822,I2=0)。Meta分析结果表明,两组患者Ⅲ/Ⅳ级白细胞减低发生率无统计学差异[RR=1.01,95%CI(0.74,1.38),P=0.94],提示含 LBP 的化疗方案与对照组治疗SCLC相比Ⅲ/Ⅳ级白细胞减低发生率相当。
2.3.3 Ⅲ/Ⅳ级血小板减低发生率 8项研究(416例患者)报道了Ⅲ/Ⅳ级血小板减低发生率[6,7,9-14],相互之间没有统计学异质性(P=0.778,I2=0)。Meta分析结果表明,两组患者Ⅲ/Ⅳ级血小板减低发生率无统计学差异[RR=1.42,95%CI(0.78,2.58),P=0.25],提示含 LBP 的化疗方案与对照组治疗SCLC相比Ⅲ/Ⅳ级血小板减低发生率相当。
2.3.4 Ⅲ/Ⅳ级血红蛋白减低发生率 4项研究(213例患者)报道了Ⅲ/Ⅳ级血红蛋白减低发生率[7,9,10,13],相 互 之 间 没 有 统 计 学 异 质 性 (P=0.725,I2=0)。Meta分析结果表明,两组患者Ⅲ/Ⅳ级血红蛋白减低发生率无统计学差异[RR=0.82,95%CI(0.34,1.97),P=0.615],提示含 LBP的化疗方案与对照组治疗SCLC相比Ⅲ/Ⅳ级血红蛋白减低发生率相当。
2.3.5 Ⅲ/Ⅳ级胃肠道症状发生率 7项研究(360例患者)报道了Ⅲ/Ⅳ级胃肠道症状发生率[6,7,9-13],相互之间没有统计学异质性(P=0.723,I2=0)。Meta分析结果表明,两组患者Ⅲ/Ⅳ级胃肠道症状发生率相比差异有统计学意义[RR=0.17,95%CI(0.09,0.32),P <0.001],提示含 LBP 的化疗方案与对照组治疗SCLC相比Ⅲ/Ⅳ级胃肠道症状发生率少。
2.4 发表偏倚分析 本Meta分析中,所有纳入研究均报道了含LBP的化疗方案与对照组化疗方案的客观缓解率。为全面反映纳入研究的情况,采用客观缓解率对入选研究进行发表偏倚分析。应用RR值的自然对数及其标准误建立的漏斗图来评估发表性偏倚(图3),Begg’s检验的结果表明没有明显的发表偏倚(Z=0.73,P=0.466)。
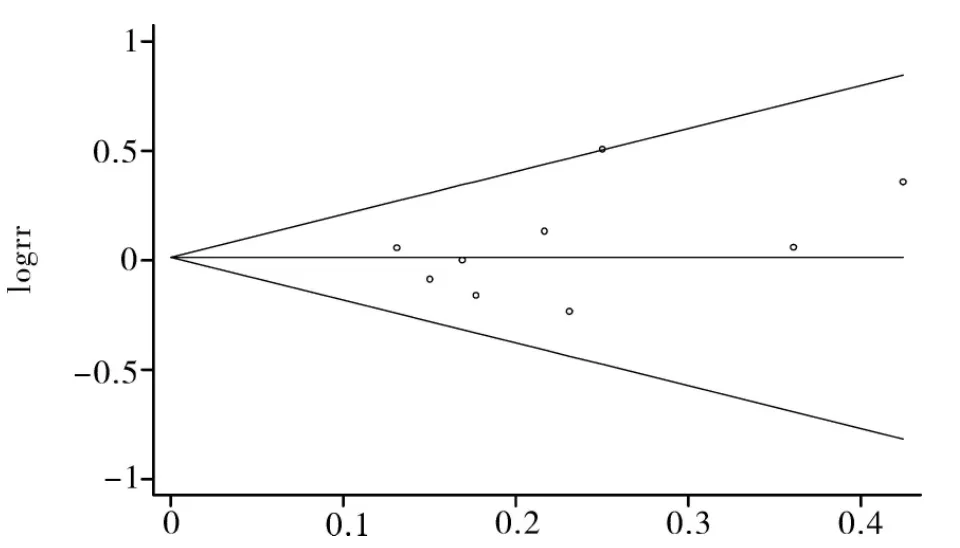
图3 Begg’s法检测发表偏倚的漏斗图
3 讨论
作为肺癌分类中的一种,SCLC临床特点较为特殊,SCLC指南指出:少数的早期SCLC可以手术治疗,与NSCLC相比分子生物治疗在SCLC中的应用疗效仍不乐观,因此多数SCLC患者的治疗仍然是以铂类为基础的化学治疗为主的内科综合治疗[15]。但是目前常规使用的化疗方案中所包含的DDP,因为高耐药性以及肝肾毒性和胃肠道反应等副作用限制了其临床使用,尤其是严重的消化道反应让一些患者难以完成治疗。LBP属于第三代铂类抗癌新药,2005年在国内获得批准上市。基础研究已证实,LBP具有稳定性好,溶解度高,抗瘤活性强,毒性较小等特点,特别是与DDP之间无交叉耐药性[16]。
本Meta研究纳入9项相关研究,分析表明使用含有LBP的联合化疗方案与对照组相比,两者之间的客观缓解率相当。但是在进行相关副作用的分析中发现,尽管血细胞三系减少的副作用在两组之间相当,但是发生严重胃肠道反应的风险LBP组与对照组相比有统计学差异[RR=0.17,95%CI(0.09,0.32),P <0.001],提示 LBP 所带来的副作用较轻,患者更容易耐受。这可能由于LBP在肿瘤内的药物浓度分布高,而在其他部位的分布浓度低[17]。并且LBP具有高度的水溶性,24 h尿排泄率为70%,因此可快速经过肾小球滤过,不易在体内积蓄,不良反应少[18]。
值得注意的是,进一步亚组分析时,在对初治和复治的疗效评价中发现,LBP方案相对于对照组方案,在复治患者中具有控制病情的优势[RR=1.43,95%CI(1.00,2.05),P=0.004],这可能与LBP与DDP交叉耐药性少有关,表明含LBP化疗方案对于复治患者具有更大的优势。而亚组分析中另一个发现是,LBP联合CPT-11的方案疗效优于对照组[RR=1.43,95%CI(1.00,2.05),P=0.045],而LBP联合VP-16的方案与对照组相比两组客观缓解率没有统计学差异,其原因可能由于LBP联合CPT-11方案的入组研究均用于复治患者。在对于不同对照方案的亚组分析中发现,LBP联合CPT-11较CBP联合CPT-11客观缓解率有统计学差异(RR:1.66,95%CI:1.02,2.70)。但是基于仅有一篇文献报道,临床上还需要进一步的大样本量实验进行验证。
本Meta分析纳入的9项研究均为RCT,都没有隐藏分配方案,且都没有应用意向性分析和选择性的报道结果,可能会引起结果的偏倚。此外纳入的9项研究方法学质量相对较低,多数未具体描述随机分组方法和盲法,由于肿瘤化疗的特殊性,所以很难施行盲法和随机方法的隐藏,从Meta分析的漏斗图来看,Begg’s检验结果表明不存在明显的发表性偏倚,说明本Meta分析结果尚可靠,可以给SCLC临床治疗提供有价值的循证医学证据。
综上所述,含LBP的化疗方案与对照组方案相比,近期治疗SCLC的客观缓解率相当,但是Ⅲ/Ⅳ级胃肠道副反应与对照组相比方案显着减少,提高了临床使用耐受性,并且以LBP为主的化疗方案在复治患者中的疗效更优于对照组方案。但是由于纳入研究的样本量较小、质量偏低,建议今后研究者开展更加规范、严谨的随机对照实验来进一步研究。
[1] Van meerbeeck JP,Fennell DA,De ruysscher DK.Small-cell lung cancer[J].The Lancet,2011,378(9804):1741 -1755.
[2] 潘 刚,金正瑞,韩军侠.IL-2联合α-干扰素与单药顺铂治疗恶性胸腔积液的比较研究[J].安徽医药,2014,18(2):349-351.
[3] Yu P,Liu YE,Ren XC,et al.A phase I clinical trial of dose escalation of lobaplatin in combination with fixed?dose docetaxel for the treatment of human solid tumours that had progressed following chemotherapy[J].Oncology Letters,2015,9(1):67 -74.
[4] Jadad AR,Moore RA,Carroll D,et al.Assessing the quality of reports of randomized clinical trials:is blinding necessary?[J].Control Clin Trials,1996,17(1):1 -12.
[5] Egger M,Smith GD,Schneider M,et al.Bias in meta - analysis detected by a simple,graphical test[J].BMJ,1997,315(7109):629-634.
[6] 汪晓洁,寿 涛,李丽华,等.洛铂联合伊立替康二线治疗小细胞肺癌的临床研究[J].重庆医学,2014,43(18):2294 -2296.
[7] Guo WF,Liao GQ,Gao HJ,et al.Randomized comparison of lobaplatin plus etoposide and cisplatin plus etoposide chemotherapy in patients with extensive - stage small cell lung cancer[J].Chinese-German J Clin Oncol,2013,12(8):365 -368.
[8] 邬 麟,蒲兴祥,王倩之,等.伊立替康联合洛铂或卡铂二线治疗广泛期小细胞肺癌94例临床观察[J].肿瘤学杂志,2013,19(11):872-876.
[9] 石 磊.洛铂联合伊立替康治疗复发或进展广泛期小细胞肺癌的临床观察[D].遵义:遵义医学院,2012.
[10]禚银玲,李世云,赵晨晴,等.洛铂联合依托泊苷治疗广泛期小细胞肺癌的临床疗效观察[J].山东医药,2012,52(14):61-62.
[11]陈天君,高 飞,孙忠民,等.依托泊苷联合洛铂或顺铂治疗广泛期小细胞肺癌的对照研究[J].西安交通大学学报(医学版),2013,34(2):198 -209.
[12]叶 静,陆友金,赵 卉.洛铂联合依托泊苷治疗小细胞肺癌的临床疗效[J].临床肺科杂志,2013,18(9):1641 -1643.
[13]于清清,王明玉.洛铂或顺铂联合依托泊苷治疗初治小细胞肺癌临床疗效的观察[J].肿瘤药学,2013,3(2):107 -110.
[14]齐晓倩,魏长宏,吴贵存,等.洛铂、顺铂分别联合足叶乙甙治疗老年小细胞肺癌对照研究[J].武警后勤学院学报(医学版),2012,21(4):258 -272.
[15] Kalemkerian GP,Akerley W,Bogner P,et al.Small cell lung cancer[J].Journal of the National Comprehensive Cancer Network,2013,11(1):78 -98.
[16]凌宇锋,隋东虎,程 颖.一类抗肿瘤新药洛铂治疗小细胞肺癌临床研究进展[J].中国新药杂志,2014,23(2):184 -188.
[17]史 健,袁志芳,刘伟娜,等.国产注射用洛铂在恶性肿瘤患者体内药动学的研究[J].中国药学杂志,2007,42(24):1888-1891.
[18]孙 旭,隋东虎,吴小华.一类抗肿瘤新药洛铂治疗卵巢癌研究进展[J].中南药学,2012,10(12):899 -902.



