黄其峰,赵寅生,邵璇璇,金玉亮
(中国人民解放军第一零五医院检验科,安徽 合肥 230031)
肝细胞癌(HCC)是全球排名第6位的恶性肿瘤,年均新增56万例,病死率位列恶性肿瘤的第3位[1],其中来自中国的病例占全球的50%以上[2]。由于肿瘤发现较晚且缺乏有效诊断,HCC术后的5年生存率为40%~50%,术后累计的5年复发率为75%~100%[3-4]。然而甲胎蛋白(AFP)作为早期的诊断指标,敏感性不足,需要其他指标进行联合诊断[5]。因此,有必要进一步提高HCC诊断阳性率,同时加强HCC术后复发的监控。乙型肝炎是HCC发生及预后的最重要危险因素之一[6]。血清γ-谷氨酰转肽酶(GGT)是常规肝功能检测项目,在肝胆疾病的诊断中,GGT作为敏感性指标已被临床医学界公认,但血清GGT与肝癌术后复发的关系研究较少,有其不足,需要进一步探讨。本研究在评价血清GGT诊断乙型肝炎相关肝细胞癌 (HBV-HCC)效能的基础上,进一步探索血清GGT作为HBV-HCC术后复发预测指标的价值,从而更好的判断肝癌预后。本研究得到了医院伦理委员会批准。
1 资料与方法
1.1 一般资料
收集2009—2015年在解放军第一零五医院接受手术切除的330例HBV-HCC、90例乙型肝炎相关肝硬化 (HBV-LC)及90例慢性乙肝肝炎(CHB)患者病例资料。所有病例均应满足乙肝表面抗原阳性6个月以上,其中HBV-HCC患者由临床病理报告作为最终诊断标准。同时收集患者首次就诊时临床检查及检验结果,并进行分析。
1.2 检测方法
常规生化检测使用西门子Adiva2400全自动生化分析仪及配套试剂,血清GGT检测为速率法。乙肝表面抗原、AFP使用雅培Architect i2000微粒子化学发光仪及配套试剂。所以项目均质控在控。
1.3 手术指征和随访方式
肝癌患者手术指征包括:(1)年龄<80岁;(2)术前评估肿瘤可切除;(3)预计术后剩余肝脏在正常肝脏中>30%,在肝硬化患者中>50%;(4)肝功能Child-Pugh评分≤7分。所有肝癌患者术后均接受常规随访:术后2年内每2个月检查一次肝功能、腹部超声和血清AFP检查。随访期间出现AFP异常升高或B超检查提示术后肝脏占位性病变可疑复发者,即行腹部增强CT、磁共振(MRI)或肝血管造影检查。明确为复发者,将AFP再次异常升高或影像学出现新发肿块的时间为复发时间。随访终点为患者死亡时间或术后12个月时间。肝炎和肝硬化无随访记录。患者均签署了知情同意书。
1.4 统计学方法
使用SPSS19.0进行数据分析。计量资料用t检验或Mann-Whitney U检验进行比较,分类变量通过χ2检验或Fisher′s精确检验比较计算。单因素分析采用ANOVA检验、t检验、Kaplan-Meier法绘制生存曲线、Log-rank检验生存率差异;多因素分析采用Cox比例风险模型。1年肿瘤复发是主要的研究终点,肿瘤复发时间为从手术到术后第一次诊断复发或转移时间。所有检验为双边检验,P<0.05认为差异有统计学意义。
2 结果
2.1 患者临床基本特征
HBV-HCC、HBV-LC及CHB患者相关临床资料见表1,三组患者年龄、性别、AFP、白蛋白、天冬氨酸氨基转移酶、血小板等常见肝功能指标差异有统计学意义(P<0.05)。
2.2 乙型肝炎相关肝病中血清GGT水平比较
HBV-HCC组、HBV-LC和CHB组血清GGT水平分别为94.2、78.3、34.7 U·L-1,HBV-HCC组显着高于HBV-LC和CHB组(P<0.05),且HBV-LC组与CHB组差异有统计学意义(P<0.05),见图1A。
2.3 血清GGT联合AFP检测可提高HBV-HCC组患者检出率
以GGT>60 U·L-1和AFP≥20 μg·L-1作为阳性截断值(cut-off)值。在HBV-HCC组中,GGT阳性率达49%,AFP的阳性率为57.9%,联合GGT和AFP两项指标时,共有76.7%的HBV-HCC患者阳性,远高于单个指标,如图1B表示。
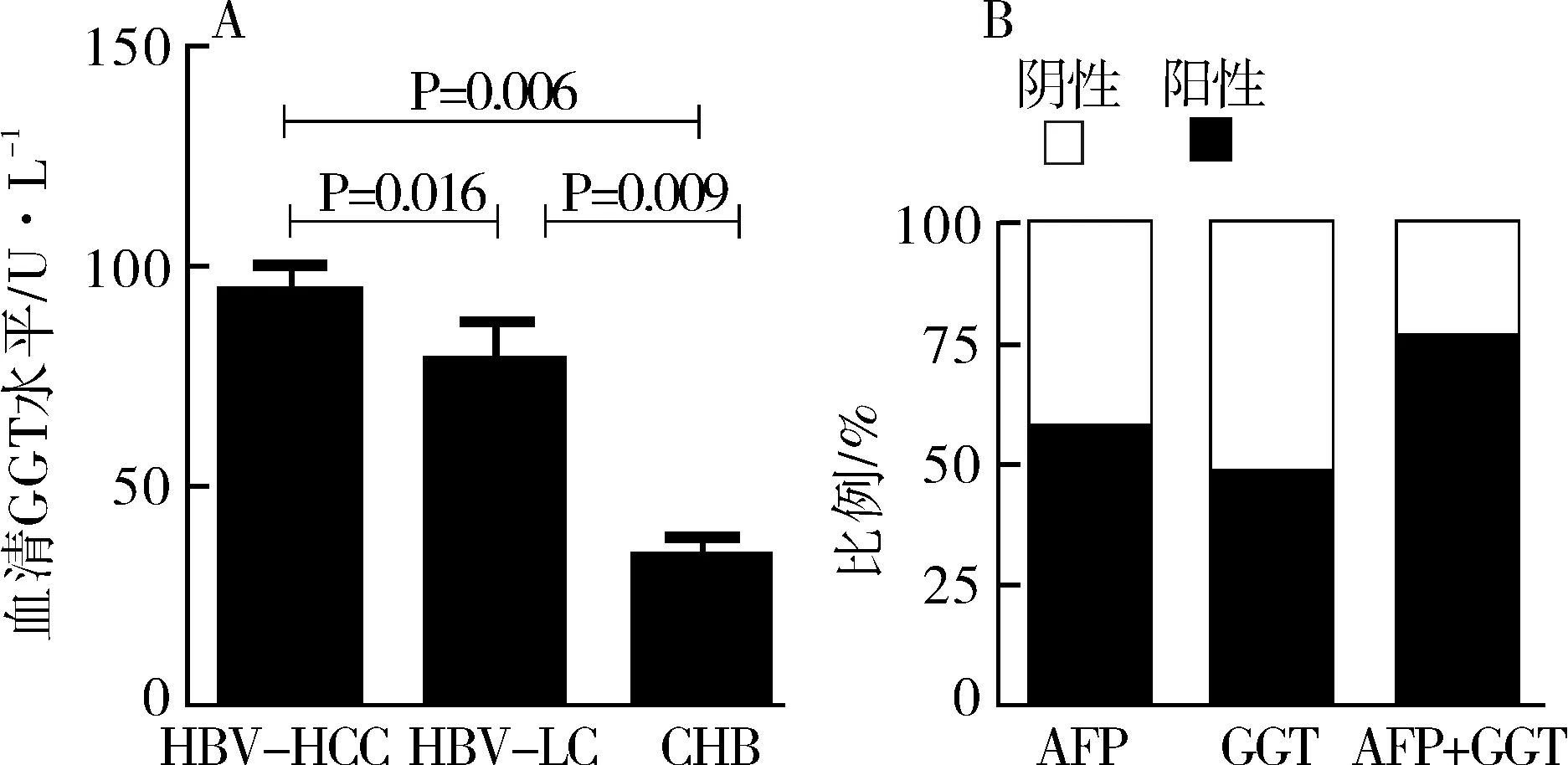
>注:A.HBV-HCC组、HBV-LC和CHB组血清GGT水平比较;B.HBV-HCC患者AFP及GGT阳性率比较。
图1乙型肝炎相关肝病患者血清GGT水平比较
2.4 血清GGT鉴别乙肝相关肝病诊断效率评价
血清GGT鉴别诊断HBV-HCC与CHB时,ROC曲线下面积(AUC)=0.764,95%CI(0.686~0.843),具有一定的鉴别作用,但在鉴别诊断HBV-HCC与HBV-LC患者时,AUC=0.579,效果一般。血清GGT鉴别HBV-LC与CHB时,AUC=0.669,也有较好的效果,见表2。
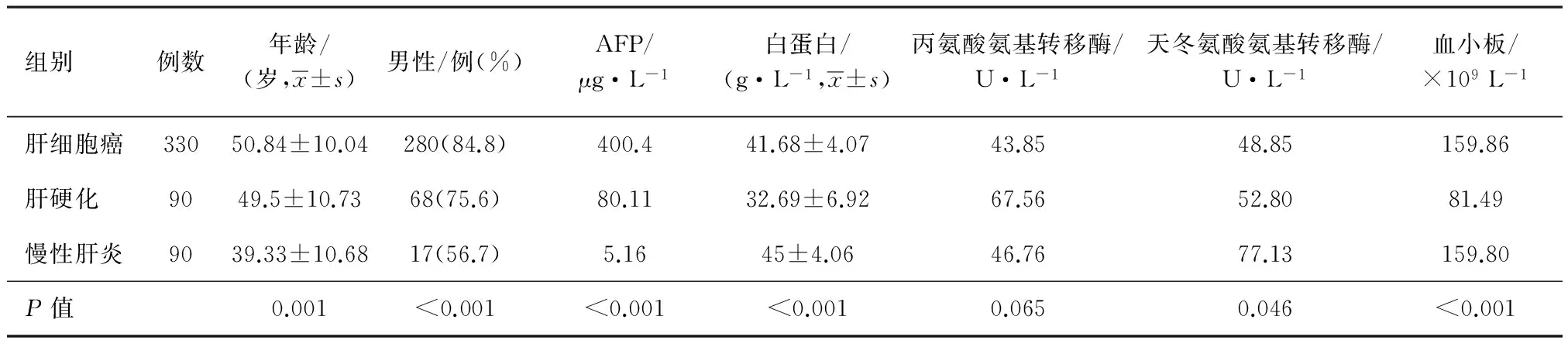
表1 乙肝相关肝病患者基本信息
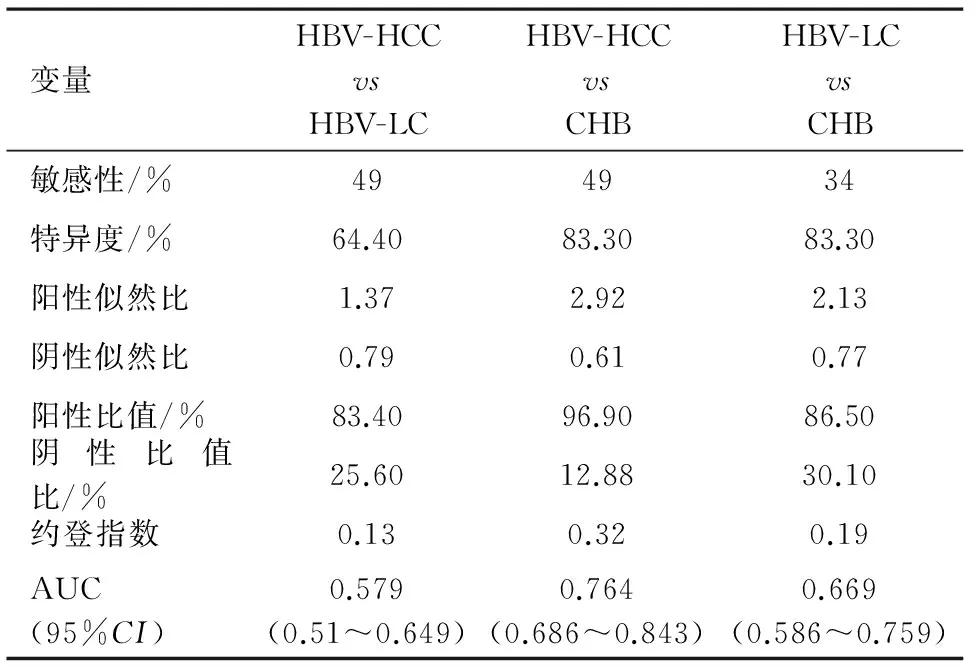
表2 GGT在乙型肝炎相关肝病中的诊断评价
2.5 不同血清GGT水平HBV-HCC患者术后复发率比较
不同血清GGT水平HBV-HCC患者术后复发累积风险如图2所示,高表达GGT组HBV-HCC患者术后早期复发率为36.0%(58/161),低表达GGT组为19.5%(33/169)。Kaplan-Meier生存曲线及Log-rank法分析表明高血清GGT水平≥60 U·L-1HBV-HCC患者术后肝癌更易复发(P=0.05)。
2.6 HBV-HCC患者术后肿瘤复发的危险因素分析
以本研究资料为样本,以患者是否术后肿瘤复发为应变量,以各种可能影响因素为自变量,分别通过单因素分析(Log-rank法分析)和多因素分析(COX分析),探讨HBV-HCC患者术后复发危险因素。结果表明,肿瘤转移、肿瘤直径≥3 cm、血管栓塞及GGT≥60 U·L-1是肿瘤复发的独立危险因素,见表3。
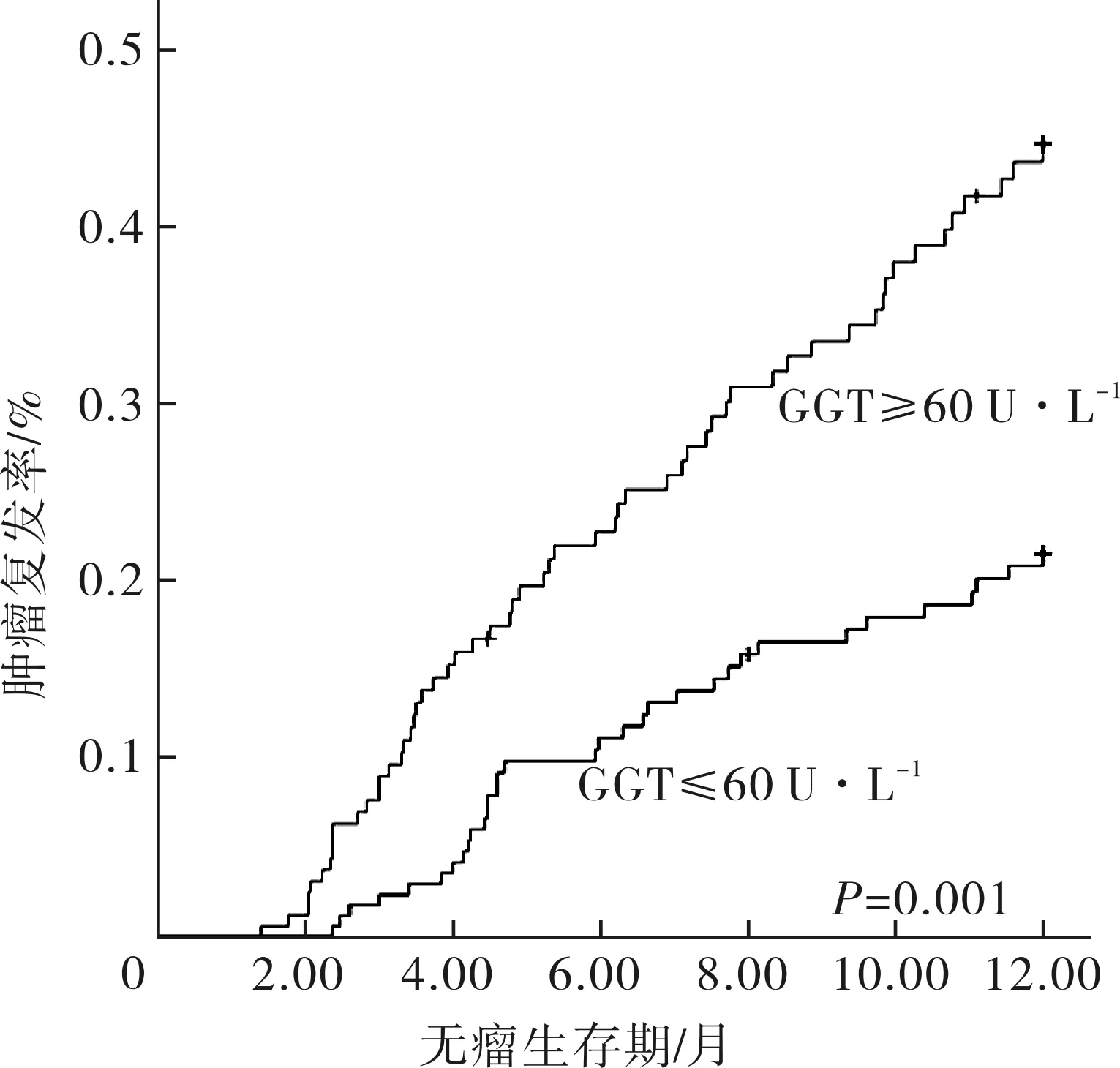
图2 不同血清GGT水平HBV-HCC患者术后复发Kaplan-Meier曲线
3 讨论
HCC是世界上最常见、恶性程度较高的一种恶性肿瘤,早期诊断效率低,预后较差。血清GGT主要由肝脏产生,在肝癌中,肝脏肿瘤压迫胆管导致胆汁液排出受阻时,肝细胞内GGT水平上升,同时肝癌细胞死亡也可释放出大量的GGT,从而造成血清GGT水平明显升高,故而GGT持续升高应警惕肝癌发生的可能,需进一步检查[7]。
血清GGT是谷胱甘肽催化的关键酶,参与生物转化、核酸代谢及肿瘤发生过程,研究表明GGT可作为包括肝癌、卵巢癌及肾细胞癌等肿瘤的诊断指标[8-9]。叶恒山[10]报道HCC患者血清中GGT 检测的阳性检出率达86.9%;姚登福、蒋道荣[11]对肝癌患者GGT及其同工酶的研究中发现GGT的阳性率可达到86.2%;本研究表明血清GGT能够作为肝细胞癌的诊断指标,同时可弥补AFP在诊断肝癌时阳性率不足的问题,提高了肝癌的检出率。比较不同乙肝相关肝病血清GGT表明HBV-HCC组GGT值最高,HBV-HCC组GGT值次之,CHB组GGT值最低,三组间差异有统计学意义(P<0.05)。血清GGT联合AFP检测时,HBV-HCC组中联合指标阳性率在提高到76.7%,相比AFP 57.9%的阳性率有显着提高。恶性肿瘤早发现、早诊断、早治疗,可以明显延长患者生存时间。然而,由于肿瘤异质性,同一肿瘤标记物在不同癌症人群的水平存在较大差异,如部分HCC患者中AFP并不升高,容易造成漏诊,故单一肿瘤标记物诊断肝癌存在着一定的缺陷,不利于肿瘤早期诊断[12]。目前AFP仍然是原发性肝癌诊断的最主要指标,同时联合其它血清指标可以提高肝癌诊断的灵敏度[13],本研究结果表明血清GGT联合AFP可以显着提高肝癌的诊断效率。
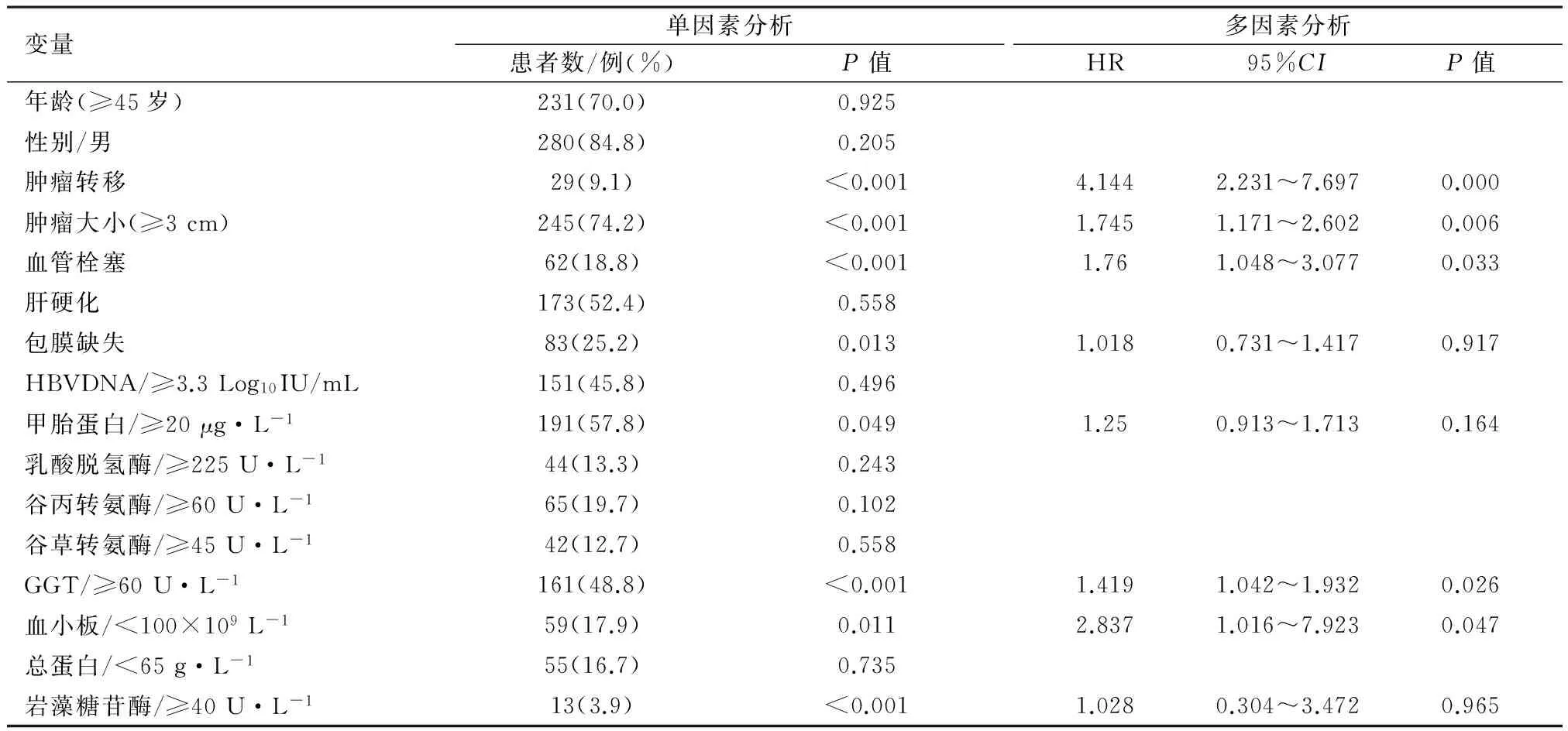
表3 HBV-HCC肿瘤复发的危险因素分析
此外,通过对330例HBV-HCC患者的随访,我们重点分析了术前GGT水平与HBV-HCC患者术后肿瘤复发的关系,结果显示血清GGT较高的肝癌患者术后肿瘤复发率更高,与王进等的研究结果类似[14-16]。同时相关研究表明,食管鳞癌及子宫内膜癌患者血清GGT水平升高表示预后不良[17-18]。由此可以推测GGT可能参与了多种肿瘤的发生与再生过程。血清GGT与肝癌复发的相关机制研究仍然较少,机制仍未明确。有学者认为,肝内阻塞及肝癌细胞增殖造成的血清GGT中度或高度增加,释放入血的GGT反过来也可促进肝癌的恶性发展过程,同时有研究表明GGT也参与体内氧化应激过程[19],共同导致肿瘤复发。
综上所述,血清GGT检测可明显提高肝癌的诊断效率,同时对于预后也有较高的预测价值,GGT较高的患者术后复发的可能性更大,需要进一步关注。
[1] BRUIX J,SHERMAN M. Management of hepatocellular carcinoma: An update[J]. Hepatology,2011,53(3): 1020-1022.
[2] YUEN MF,HOU JL,CHUTAPUTTI A.Hepatocellular carcinoma in the Asia pacific region[J].Journal of Gastroenterology and Hepatology,2009,24(3):346-353.
[3] ZHU WJ,HUANG CY,LI C,et al. Risk factors for early recurrence of HBV-related hepatocellular carcinoma meeting Milan criteria after curative resection[J].Asian Pac J Cancer Prev,2013,14(12):7101-7106.
[4] ZHOU L,RUI JA,WANG SB,et al.Clinicopathological predictors of poor survival and recurrence after curative resection in hepatocellular carcinoma without portal vein tumor thrombosis[J].Pathol Oncol Res,2015,21(1):131-138.
[5] 曹博,王龙胜,郑穗生,等.弥散加权成像联合甲胎蛋白对原发性肝癌早期诊断价值[J].安徽医学,2014,35(12):1673-1676.
[6] 程晓光,张振华,王长泰,等.乙型肝炎表面抗原定量与原发性肝癌的相关性研究[J].安徽医学,2015,36(9):1058-1060.
[7] 谢启贤.γ-谷氨酰转肽酶在临床诊断上的应用[J].检验医学与临床,2008,5(18):1147-1148.
[8] HOFBAUER SL,STANGL KI,DE MARTINO M,et al.Pretherapeutic gamma-glutamyltransferase is an independent prognostic factor for patients with renal cell carcinoma[J].Br J Cancer,2014,111(8):1526-1531.
[9] GRIMM C,HOFSTETTER G,AUST S,et al.Association of gamma-glutamyltransferase with severity of disease at diagnosis and prognosis of ovarian cancer[J].Br J Cancer,2013,109(3):610-614.
[10] 叶恒山.血清GGT的测定对肝癌的诊断价值[J].现代养生,2014(4):40-41.
[11] 姚登福,蒋道荣.γ-谷氨酰转移酶及同工酶对肝细胞癌变的监测作用[J].中华肝脏病杂志,2000,8(1):30-32.
[12] 郑飞,周文平.四种肿瘤标记物联合检测诊断原发性肝癌的临床观察[J].中国肿瘤临床与康复,2013,20(9):941-943.
[13] 殷翠红,蒋龙凤,严友德,等.AFP、AFU、β_2-MG、CA199联合检测对原发性肝癌的早期诊断价值[J].现代生物医学进展,2012,12(36):7124-7127.
[14] 王进,夏国兵,樊慧.肝癌预后与血清α-藻糖苷酶、γ-谷氨酰转肽酶水平的关系[J].中华实验外科杂志,2013,30(12):2745.
[15] FU SJ,ZHAO Q,JI F,et al.Elevated preoperative serum gamma-glutamyltranspeptidase predicts poor prognosis for hepatocellular carcinoma after liver transplantation[J].Sci Rep,2016,6:28835.
[16] ZHANG TT,ZHAO XQ,LIU Z,et al.Factors affecting the recurrence and survival of hepatocellular carcinoma after hepatectomy:a retrospective study of 601 Chinese patients[J].Clin Transl Oncol,2016,18(8):831-840.
[17] YANG F,ZHANG S,YANG H,et al. Prognostic significance of gamma-glutamyltransferase in patients with resectable esophageal squamous cell carcinoma[J].Disease of The Esophagus,2015,28(5):496-504.
[18] SEEBACHER V,POLTERAUER S,GRIMM C,et al.Prognostic significance of gamma-glutamyltransferase in patients with endometrial cancer:a multi-centre trial[J].Br J Cancer,2012,106(9):1551-1555.
[19] REUTER S,GUPTA SC,CHATURVEDI MM,et al.Oxidative stress,inflammation,and cancer:How are they linked?[J].Free Radical Biology and Medicine,2010,49(11):1603-1616.



