董丽涛
(周口市妇幼保健院妇产科,河南 周口 466000)
子宫内膜癌是临床上较为常见的妇科生殖系统恶性肿瘤,相关研究显示子宫内膜癌的发病率可达0.006%以上,且近年来呈现出了明显的上升趋势[1]。临床上疾病的长期发生发展,可以导致患者病死率的上升,临床预后较差[2]。
通过对于子宫内膜癌发生过程中相关生物学机制的研究,可以为揭示子宫内膜癌的发生机制、病情预后评估等提供可靠的参考指标。蛋白水平的相关生物学分子的改变,可以在影响肿瘤细胞增殖、细胞分化等病理过程中发挥重要作用,进而影响到肿瘤的发生。热休克转录因子-1(heat shock transcription factor -1,HSF-1)是近年来研究较多的生物学分子,在甲状腺癌、乳腺癌等疾病的发生发展中均发挥了重要的作用,但在子宫内膜癌中的研究不足[3-5]。本研究收集了术后或活检经病理学证实为子宫内膜癌标本67例,探讨了HSF-1在子宫内膜癌病灶组织中的异常表达,并分析了其与患者临床病理特征间的关系。
1 资料与方法
1.1 一般资料
选取2014年1月至2016年5月在周口市妇幼保健院收集的术后或活检经病理学证实为子宫内膜癌标本67例,年龄36~72岁,平均年龄(56.7±11.8)岁,国际妇产联盟分期标准(FIGO):Ⅰ期16例、Ⅱ期23例、Ⅲ期19例、Ⅳ期9例,病理学分化程度:高分化44例、中分化15例、低分化8例。正常子宫内膜组织35例,年龄33~69岁,平均年龄(55.0±10.3)岁,两组研究对象的年龄差异无统计学意义(P>0.05)。
1.2 纳入排除标准
1.2.1纳入标准 (1)子宫内膜癌的诊断标准参考中华医学会制定的标准[6];(2)患者接受手术的术后标本或病理活检标本,经病理学证实为子宫内膜癌;(3)正常子宫内膜组织来源于妇科门诊刮诊或因其他原因手术收集的正常标本;(4)标本所属研究对象的一般资料、临床病理学资料完整。
1.2.2排除标准 (1)接受过放化疗、免疫治疗的子宫内膜癌患者;(2)近半年内接受过激素治疗的患者;(3)合并子宫肌瘤等其他肿瘤疾病;(4)基础资料不完整。
1.3标本采集及检测方法 采用石蜡切片脱蜡至水,切片厚度3 mm,3%H2O2室温孵育 5 min,采用去离子水水冲洗3次,每次3 min,采用浓度为10% 牛奶蛋白(1 g蛋白加入100 mL纯水)封闭,室温孵育 5 min,加入HSF-1抗体(鼠来源,南京碧云天生物科技有限公司), 37 ℃ 孵育 2 h,PBS缓冲液冲洗3次,每次5 min,滴加HRP标记的二抗(兔来源,购自罗氏检测公司),37 ℃ 孵育 30 min,PBS 冲洗3次,每次5 min,加入 NBT/BCIP色剂显色 5 min,复染,脱水,透明,封片,镜下观察。OLIPICS电子显微镜购自上海精密仪器有限公司,配套试剂购自南京泰康生物科技有限公司。
1.4 结果判断
免疫组化结果判定HSF-1蛋白的阳性着色表达于细胞核,呈黄色、棕黄色、褐色表达,(1)根据着色强度:0分为无色、1分为淡黄色、2分为棕黄色、3分为褐色、黑色;(2)根据阳性细胞比例:阳性细胞数目所占比例<5%为1分、阳性细胞所占比例5%~25%为2分、阳性细胞数26%~50%为3分、阳性细胞数所占比例>50%为4分,两种积分相乘总分<3分为阴性、≥3分为阳性。(-)为总分<3分,阴性表达;(+)为3~5分,弱阳性表达;(++)为6~9分,中阳性表达;(+++)为>9分,强阳性表达。
1.5 统计学方法
2 结果
2.1 两组子宫内膜组织标本中HSF-1蛋白的阳性表达情况
子宫内膜癌组织标本中HSF-1蛋白阳性表达率71.64%(48/67),正常子宫内膜组织中HSF-1蛋白阳性表达率31.43%(11/35),两组阳性表达率比较差异有统计学意义(P<0.05)。见表1,图1。
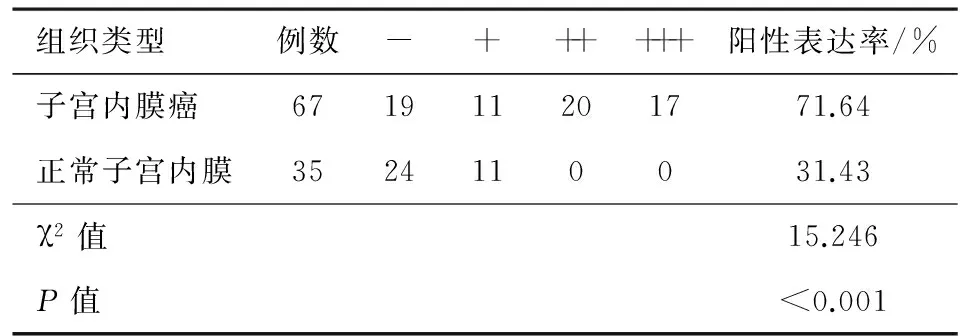
表1 两组子宫内膜组织标本中HSF-1蛋白的阳性表达情况
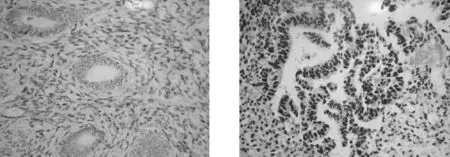
A.正常子宫内膜组织 B.子宫内膜癌组织
图1两组子宫内膜组织标本中HSF-1蛋白的阳性表达情况(SP×40)
2.2 子宫内膜癌组织标本中HSF-1蛋白的阳性表达与患者临床病理学特征的关系
子宫内膜癌组织标本中HSF-1蛋白在高分化组织中阳性表达率86.96%高于中低分化组织的63.64%、浸润深度≤1/2肌层的阳性表达率87.50%高于≥1/2肌层的62.79%、淋巴结转移阴性组织中的阳性表达率为80.49%高于阳性组织的57.69%,均差异有统计学意义(P<0.05);子宫内膜癌组织标本中HSF-1蛋白阳性表达与患者的年龄、绝经情况、病理学分期、ER及PR的阳性表达无关(P>0.05)。见表2。
3 讨论
遗传易感基因、射线及化学毒物等均可以促进子宫内膜上皮来源恶性肿瘤的异常增殖和病变,促进子宫内膜癌的发生。近年来相关流行病学研究表明,子宫内膜癌在年龄介于35~50岁的人群中发病率可达0.09%以上[7]。有效的静脉化疗方案可以提高5%左右的5年生存率,并延长3~4个月的术后生存时间。但一项汇集118例子宫内膜癌患者的术后化疗的随访研究表明,35%的子宫内膜癌患者对于静脉化疗不敏感,同时化疗的总体治疗有效率不足55%,停药后6个月内的复发率可接近25%,临床预后较差[8-9]。而对于子宫内膜癌发病过程中相关生物学机制的研究,可以为子宫内膜癌的综合性放化疗提供新的作用靶点,并为子宫内膜癌的治疗预后评估提供参考。
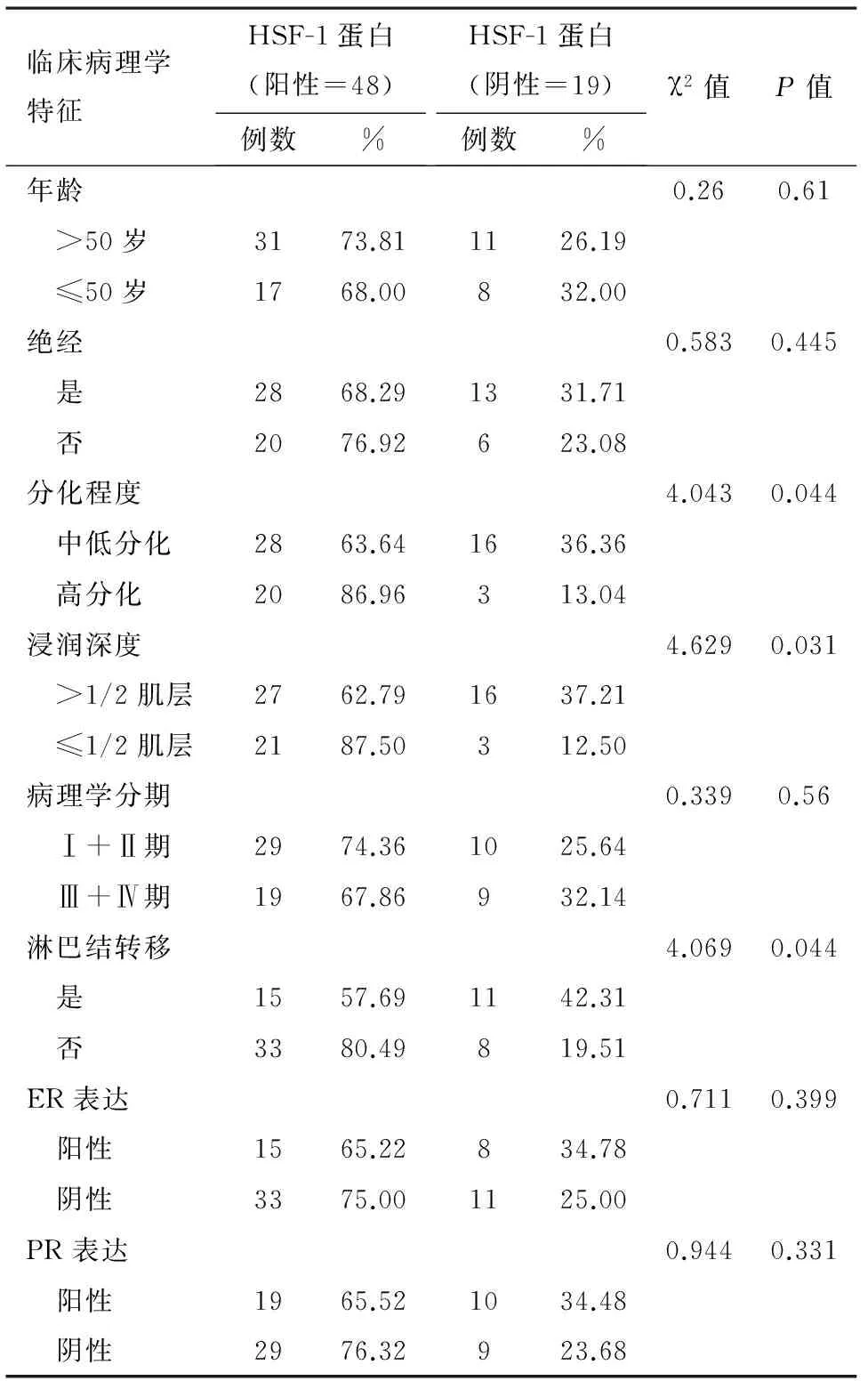
表2 HSF-1蛋白的阳性表达与患者临床病理学特征的关系
HSF-1热休克蛋白家族的重要成员,HSF-1的上升可以通过影响到子宫内膜上皮细胞的自身性修复机制,进而影响到内膜上皮细胞的异常增殖或者分化。HSF-1分子结构中含有的磷酸化的氨基酸序列,在肿瘤细胞的异常分化等病理过程中,HSF-1合成的拮抗因素增多,并随着子宫内膜癌细胞的侵袭或者转移而逐渐下降[10-12]。相关研究显示,HSF-1是一个广谱性肿瘤标志物,可以通过激活下游HIPPO信号通路,进而促进乳腺癌、肺癌和卵巢癌等恶性肿瘤的病情发展[13-14],虽然有研究探讨了HSF-1蛋白等在子宫内膜癌中的异常表达,但相关研究的样本量较少,临床资料的收集偏倚较为严重,可信性不高。
本研究发现,子宫内膜癌组织中的HSF-1表达阳性率明显高于健康对照组,差异有统计学意义,提示HSF-1的异常表达可能参与到了子宫内膜癌的发生发展过程中。HSF-1的表达波动可以通过影响到肿瘤细胞周期调控因子-9及金属基质蛋白-6的转录,进而导致子宫内膜上皮细胞周期调控异常,促进子宫内膜癌的发生。Versluis等[15]研究者通过回顾性分析了92例样本量的临床资料,发现在子宫内膜癌患者术后切除病灶组织中,HSF-1蛋白的表达阳性率可较普通对照人群上升25%以上,且患者的病情越为严重,HSF-1的表达波动越为明显,这与本研究的结论较为一致。在不同的临床病理特征中,分化较好的高分化患者,HSF-1蛋白表达阳性率明显高于低分化组,提示HSF-1在保护子宫内膜细胞分化的过程中具有一定的积极意义,HSF-1可能通过保护子宫内膜上皮细胞的氧化应激损伤,避免过度的癌基因刺激导致的细胞分化不良的发生。但需要注意的是,Versluis等的研究中并未发现不同分化水平组织中的HSF-1表达差异,这与本研究的结论存在一定的差别,考虑到临床病例的纳入排除标准的不统一、检测方法的不一致等,均可能导致的了结论的差别。同时,本研究发现在浸润深度较深及发生淋巴结转移的患者中,HSF-1的表达阳性率明显下降,提示HSF-1蛋白表达的缺失可能对于影响子宫内膜的发生具有重要的促进作用,其机制考虑可能与HSF-1的表达下降失去了对于CYCLIN蛋白等周期调控因子的保护作用有关。而在不同的病理学分期或者ER及PR受体阳性表达的内膜癌组织中,HSF-1的表达并无差异,提示HSF-1的表达并不会显着影响到雌孕激素受体的分布。
综上所述,在子宫内膜癌患者组织中,HSF-1存在明显的异常表达,同时HSF-1与患者的细胞分化程度、淋巴结转移等病理特征密切相关。但本研究对于HSF-1与子宫内膜癌患者远期生存指标的分析不足,存在一定的局限性。
[1] ROTHMUND R,HARTKOPF A,JOACHIM C,et al.Clinical characteristics,pathological reevaluation,surgical management and adjuvant therapy of patients with endometrial stromal tumors[J].Arch Gynecol Obstet,2014,290(6):1195-1200.
[2] CHEN CD,CHEN SU,CHOU CH,et al.High estradiol concentrations induce heat shock Protein 70 expression and suppress nuclear factor kappa B activation in human endometrial epithelial cells[J].Biol Reprod,2016,95(4):87.
[3] 段律芳,李瑞珍,胡艳.热休克蛋白10在子宫内膜癌中的表达及意义[J].广东医学,2013,34(6):928-930.
[4] 李弘夏,谢智钦,杜立阳.基于HSP27的乳腺癌干细胞靶向治疗研究进展[J].中国老年学杂志,2014,34(2):561-563.
[5] 梁声茹,陈必良,李佳,等.HSF1在子宫内膜癌细胞中的表达及其与抗氧化的相关性研究[J].现代生物医学进展,2014,14(16):3038-3041,3059.
[6] 贺红英,阳志军,张洁清,等.腹腔镜与开腹手术治疗早期子宫内膜癌近远期疗效的比较[J].中华妇产科杂志,2015,50(12):902-909.
[7] 李永康,银铎.子宫内膜癌淋巴转移的危险因素分析[J].中华肿瘤防治杂志,2016,23(5):326-330.
[8] SHIH IL,YEN RF,CHEN CA,et al.Standardized uptake value and apparent diffusion coefficient of endometrial cancer evaluated with integrated whole-body PET/MR:Correlation with pathological prognostic factors[J].J Magn Reson Imaging,2015,42(6):1723-1732.
[9] PRASAD S,SINGHAL M,NEGI SS,et al.Targeted detection of 65 kDa heat shock protein gene in endometrial biopsies for reliable diagnosis of genital tuberculosis[J].Eur J Obstet Gynecol Reprod Biol,2012,160(2):215-218.
[10] 刘海霞,陈必良,张建芳,等.热休克转录因子1与雌激素受体在子宫内膜癌中的表达及意义[J].现代生物医学进展,2014,14(19):3676-3679.
[11] 沈爱群,初磊,李莉,等.热休克蛋白70在异位子宫内膜细胞上皮间质化中的作用研究[J].同济大学学报(医学版),2016,37(3):45-49.
[12] 宋媛媛,韩晓红,郑翠玲,等.ELISA检测肿瘤患者热休克蛋白90α的影响因素分析[J].中华检验医学杂志,2013,36(12):1100-1103.
[13] 王清,王艳林.肿瘤细胞免疫原性死亡相关分子的研究进展[J].细胞与分子免疫学杂志,2013,29(1):109-111.
[14] 周卓,李佳,张千锋,等.HSF1与XAF1基因在子宫内膜癌组织中的表达及其相关性分析[J].西安交通大学学报(医学版),2015,32(2):231-234.
[15] VERSLUIS MA,DE JONG RA,PLAT A,et al.Prediction model for regional or distant recurrence in endometrial cancer based on classical pathological and immunological parameters[J].Br J Cancer,2015,113(5):786-793.



