曹少红,李敏
(安徽医科大学附属安庆医院消化内科,安徽 安庆 246003)
由胃炎、胃黏膜萎缩、肠化生、不典型增生到肠型胃癌是目前公认的发展模式,该发展模式的机制尚不明确,可能与幽门螺杆菌(HP)感染有关[1]。有证据表明[2-3]HP阳性患者发生胃癌的风险是HP阴性患者的3~6倍,HP阳性患者发生肠化生及萎缩的概率是普通人群的4.5~9倍,胃黏膜肠化生患者发生胃癌的概率是普通人群的6倍。国内外共识[4-5]均将胃黏膜萎缩和(或)肠化生列为HP根除适应证。目前国内HP处于感染率高、耐药率高、不良反应大及根除率低的状态,探索HP根除新方法迫在眉睫。近些年微生态制剂为根除HP带来了福音,一些益生菌菌株对HP能表现出抑制活性、降低HP负荷、减少抗生素相关不良反应及提高根除率,益生菌能否产生影响取决于菌株、剂量及其使用时机。Sheu等[6]首次临床实验证实益生菌预处理能降低HP负荷量及提高其根除率。笔者就益生菌预处理联合四联疗法对根除HP的影响及其能否减少抗生素的使用疗程作一探讨,报道如下。
1 资料与方法
1.1 一般资料
收集2016年12月1日至2017年7月1日安徽医科大学附属安庆医院门诊及住院患者127例,入选标准:(1)初次经14C-尿素呼气试验(14C-UBT)诊断为HP阳性者;(2)经胃镜和(或)病理证实胃黏膜萎缩和(或)肠化生;(3)入组前对研究方案知情并同意配合治疗和随访者。排除标准:(1)严重的心、脑、肺、肝、肾功能不全,自身免疫情况低下者;(2)对研究过程中所服用药物有过敏史者;(3)既往有HP根除史;(4)妊娠或哺乳期妇女;(5)治疗前4周内使用过抗生素或铋剂者,治疗前2周内用过质子泵抑制剂、H2受体拮抗剂、胃黏膜保护剂者。经伦理委员会审查并同意。
1.2 方法
1.2.1治疗药物 艾司奥美拉唑镁肠溶片(每粒20 mg,阿斯利康制药有限公司,批号:161125),枸橼酸铋钾胶囊(每粒110 mg,丽珠集团丽珠制药厂,批号:161014),克拉霉素缓释片(每粒0.5 g,海南普利制药有限公司,批号:161003),呋喃唑酮片(每粒0.1 g,山西云鹏制药有限公司,批号:161019),双歧杆菌三联活菌胶囊(每粒210 mg,上海信谊药业有限公司,,批号:161112,主要成分为双歧杆菌、嗜酸乳杆菌、肠球菌),尿素[14C]胶囊(上海欣科医药有限公司)。
1.2.2服药方法 采用随机数字表法将患者分为A、B、C三组,A组42例予以标准四联疗法:艾司奥美拉唑镁肠溶片(每次20 mg,饭前口服,每天2次),枸橼酸铋钾胶囊(每次220 mg,饭前口服,每天2次),克拉霉素缓释片(每次0.5 g,饭后口服,每天2次),呋喃唑酮片(每次0.1 g,饭后口服,每天2次),疗程2周;B组43例先予以双歧杆菌三联活菌胶囊(每次420 mg,饭前口服,每天2次)预处理2周,后予以标准四联疗法治疗2周;C组42例先予以双歧杆菌三联活菌胶囊(每次420 mg,饭前口服,每天2次)预处理2周,后予以标准四联疗法1周。
1.2.3疗效评价 疗程结束4周后复查14C-UBT,若检测值<150 dpm,则HP阴性,可判定根除成功,反之,则根除失败。密切随访各组患者不良反应事件发生情况。
1.3 统计学方法
应用SPSS 16.0统计软件进行资料分析。观测资料中的计量数据,多组间整体分析为单因素方差分析,两两比较为LSD-t检验。计数资料则行整体+分割χ2检验。检验水准α=0.05。
2 结果
2.1 各组患者基本资料比较
三组年龄、性别及14C初始值比较,均差异无统计学意义(P>0.05),具有可比性,见表1。
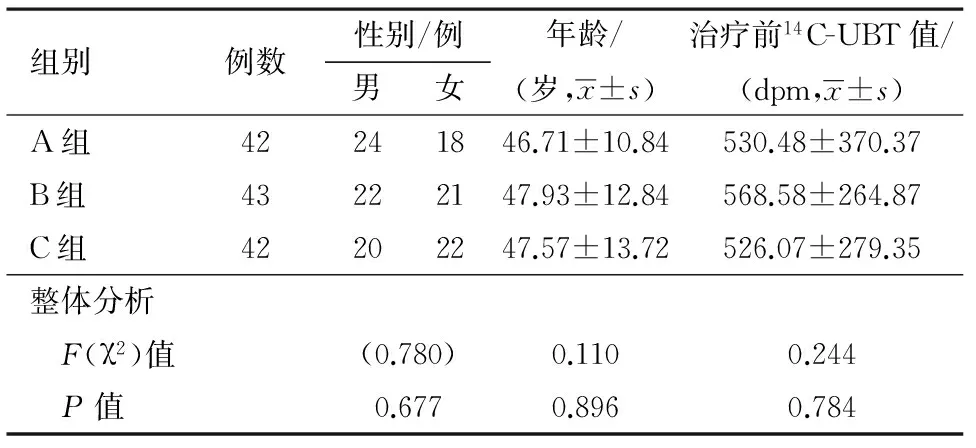
表1 各组基本资料比较
2.2 各组HP根除率比较
B组与A组比较(χ2=1.321,P=0.250),A组与C组比较(χ2=0.730,P=0.393),均差异无统计学意义;B组根除率明显高于C组,差异有统计学意义(χ2=5.308,P=0.021),见表2。

表2 各组HP根除率比较
2.3 各组药物不良反应的发生率比较
B、C组不良反应事件发生率明显低于A组(χ2=6.224,P=0.013,χ2=9.820,P=0.002),C组与A组不良反应事件发生率比较,差异无统计学意义(χ2=0.155,P=0.694)。见表3。
3 讨论
近些年报道,我国HP对抗生素耐药呈上升趋势,第5次感染共识指出:国内HP原发耐药率克拉霉素占20%~50%,甲硝唑占40%~70%,左氧氟沙星占20%~50%,阿莫西林占0~5%,四环素占0~5%,呋喃唑酮占0~1%,随着克拉霉素三联疗法根除率下降,以及非铋剂四联疗法未获得高根除率,目前国内推荐铋剂四联作为主要的经验性根除方案,且推荐疗程为10~14 d。抗生素耐药及抗生素相关不良反应,使得HP根除面临挑战,胃肠道微生态的兴起为其指引了方向。
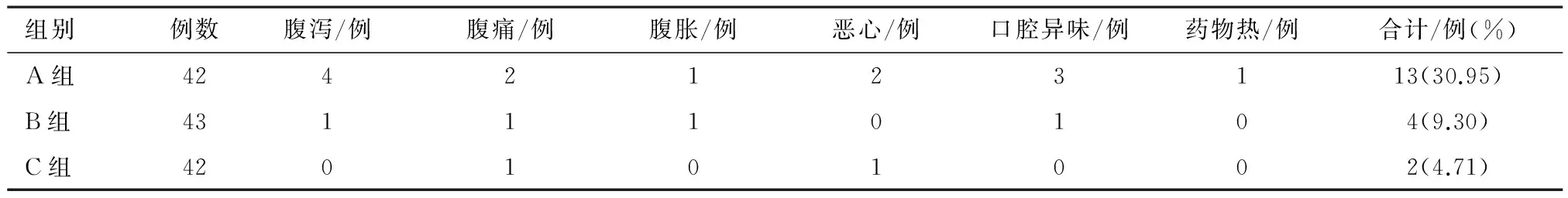
表3 各组药物不良反应的发生率
1989年Bhatia等[7]首次证明益生菌能抑制体外HP。之后Michetti等[8]第一次提出单用益生菌能降低人体内HP的负荷却不能完全根除HP的观点。Johnson-Henry等[9]的小鼠实验揭示益生菌预处理能将HP负荷量由100%下降到50%,并能减轻其胃腔内炎症。 Dajani等[10]实验提示益生菌预处理较同步治疗更能提高HP根除率及降低不良反应。国内彭昕等[11]实验研究显示益生菌预处理较后处理根除率高。以上实验提示益生菌预处理对根除HP可能更有积极作用。在该实验中,虽然B组根除率在数值上高于A组,但差异无统计学意义(P>0.05)。
1998年有报道[12]外源性益生菌的摄入能减少抗生素相关性副作用,其功能变化可能与减少肠道刺激和维持细菌多样性有关。近年来,Bumjo等[13]利用16S rRNA基因的高通量测序方法进行的一项随机临床试验研究表明,益生菌减少肠道菌群组成的不平衡并限制了HP根除过程中耐药菌的生长,McFarland等[14-15]单株益生菌及多株益生菌混合物的荟萃分析,益生菌能减少抗生素相关不良反应,该实验中A组与B组,A组与C组比较,差异有统计学意义(P<0.05),证明益生菌联合四联疗法能减少不良反应事件的发生。
该实验中,益生菌预处理联合四联疗法虽能降低不良反应,但在根除率上差异无统计学意义,可能因为样本量偏小,其能否在临床推广需临床进一步验证。目前,国内外对益生菌的使用时机尚无统一定论,有学者认为[16]益生菌后处理可能比预处理临床效果更显着,该实验仅对预处理展开了实验,未来仍需更大规模的临床实验探索其最适当的用药时机。另外,本实验(B、C组)在益生菌使用基础上对抗生素的使用疗程亦进行了比较,虽差异无统计学意义,但就减少抗生素大量使用以降低抗生素耐药从而提高HP根除率的远期愿景,值得临床更多实验方案加以探索。
[1] GOMEZ JM,WANG AY.Gastric intestinal metaplasia and early gastric cancer in the west:a changing paradigm[J].Gastroenterol Hepatol,2014,10(6):369-378.
[2] ROKKAS T,ROKKA A,PORTINCASA P.A systematic review and meta-analysis of the role ofHelicobacter pylorieradication in preventing gastric cancer[J].Ann Gastroenterol,2017,30(4):414-423.
[3] 聂爱英,雷超,时永全.胃黏膜肠化生的防治研究进展[J].现代医药卫生,2017,33(7):965-968.
[4] SUGANO K,TACK J,KUIPERS E J,et al.Kyoto global consensus report on Helicobacter pylori gastritis[J].Gut,2015,64(9):1353-67.
[5] 中华医学会消化病学分会幽门螺杆菌学组.幽门螺杆菌胃炎京都全球共识研讨会纪要[J].中华消化杂志,2016(1):53-57.
[6] SHEU BS,CHENG HC,KAO AW,et al.Pretreatment with Lactobacillus- and Bifidobacterium-containing yogurt can improve the efficacy of quadruple therapy in eradicating residual Helicobacter pylori infection after failed triple therapy[J].Am J Clin Nutr,2006,83(4):864-869.
[7] BHATIA SJ,KOCHAR N,ABRAHAM P,et al.Lactobacillus acidophilus inhibits growth of Campylobacter pylori in vitro[J].J Clin Microbiol,1989,27(10):2328-2330.
[8] MICHETTI P,DORTA G,WIESEL PH,et al.Effect of whey-based culture supernatant of Lactobacillus acidophilus (johnsonii) La1 on Helicobacter pylori infection in humans[J].Digestion,1999,60(3):203-209.
[9] JOHNSON-HENRY KC,MITCHELL DJ,AVITZUR Y,et al.Probiotics reduce bacterial colonization and gastric inflammation in H.pylori-infected mice[J].Dig Dis Sci,2004,49(7/8):1095-1102.
[10] DAJANI A,ABU HAMMOUR A,CHUNG P,et al.Do probiotics improve eradication response to Helicobacter pylori on standard triple or sequential therapy?[J].Saudi Journal of Gastroenterology,2013,19(3):113.
[11] 彭昕,宋丽秀,陈卫刚,等.标准三联疗法与益生菌联合三联疗法根除幽门螺杆菌的效果比较[J].广东医学,2016,37(5):758-761.
[12] LEWIS SJ,FREEDMAN AR.Review article:the use of biotherapeutic agents in the prevention and treatment of gastrointestinal disease[J].Aliment Pharmacol Ther,1998,12(9):807-822.
[13] BUMJO B,KIM JW,KIM BS.Changes in the functional potential of the gut microbiome following Pprobiotic supplementation during helicobacter pylori treatment[J].Helicobacter,2016,21(6):493-503.
[14] MCFARLAND LV.Meta-analysis of single strain probiotics for the eradication of Helicobacter pyloriand prevention of adverse events[J].World Journal of Meta-Analysis,2015,3(2):97.
[15] MCFARLAND LV,HUANG Y,WANG L,et al.Systematic review and meta-analysis:Multi-strain probiotics as adjunct therapy for Helicobacter pylori eradication and prevention of adverse events[J].United European Gastroenterol J,2016,4(4):546-561.
[16] DU YQ,SU T,FAN JG,et al.Adjuvant probiotics improve the eradication effect of triple therapy for Helicobacter pylori infection[J].World J Gastroenterol,2012,18(43):6302-6307.



