杨会杰,任少达,郭瑞娜, 魏民,李修顺,李鸿超,李莹
(1.濮阳市油田总医院病理科,河南 濮阳 457001;2.聊城市人民医院呼吸科,山东 聊城 252002)
肺癌早期可经血液、淋巴结、直接扩散等方式转移,肿瘤细胞的快速生长和转移是导致患者预后不良的主要危险因素[1-2]。据报道仅2012年全球范围就有1 820 000新发的肺癌患者,其中1 590 000例死亡,肺癌患者5年生存率仅有2%~30%[3]。最常见的肺癌类型为非小细胞肺癌,与小细胞肺癌相比,其分裂和扩散较慢,但由于确诊时患者往往处于中晚期,因此5年生存率非常低[4-5]。目前研究已证实肺癌细胞的快速生长和转移与免疫抑制有关[6-7]。Li等[8]研究表明调节性T细胞与非小细胞肺癌有关,其水平升高可能与免疫的耐受有关,降低其水平或许可改善非小细胞肺癌患者预后。树突状细胞是机体的一种抗原呈递细胞,其功能最大,在肿瘤患者中,主要将肿瘤细胞表面分子标志物和代谢产物等呈递给细胞毒性T细胞等,进而杀伤肿瘤细胞[9-10]。血管内皮生长因子(vascular endothelial growth factor,VEGF)在肿瘤细胞中的高表达同样可以促进肿瘤的转移。然而目前关于肿瘤浸润性树突状细胞(tumor infiltrating dendritic cells,TIDC)和VEGF在非小细胞肺癌组织中的表达水平尚不清楚。本研究对非小细胞肺癌组织和健康组织中TIDC和VEGF表达水平进行检测,探讨其与非小细胞肺癌的关系。
1 资料与方法
1.1一般资料自2014年1月至2016年12月,连续性收集濮阳市油田总医院收治的非小细胞肺癌患者106例,纳入标准:(1)非小细胞肺癌(均有病理确诊);(2)行手术切除可以获得肿瘤标本;(3)年龄18~75岁;(4)同意参与本研究。排除标准:(1)合并其他恶性肿瘤;(2)肺癌复发;(3)小细胞肺癌;(4)术前曾接受放疗、化疗或分子生物治疗;(5)6个月内曾接受免疫调节剂;(6)溃疡性结肠炎等免疫系统疾病;(7)急性或慢性感染期;(8)肝肾等脏器功能不全;(9)既往心肌梗死、脑出血等重大心血管疾病。所有患者对本研究均知情同意并签署知情同意书,本研究通过濮阳市油田总医院伦理委员会批准。
1.2研究方法入院后完善相关检验检查,择期行“肺癌切除术”,术中取肿瘤组织,检测肿瘤组织中(据肿瘤边缘1 cm以上的肿瘤组织)和周围健康组织中TIDC(距肿瘤边缘3 cm以上的正常组织)和VEGF水平。并收集患者性别、年龄、临床TNM分期、肿瘤细胞分化程度、病理类型等临床特征,分析TIDC和VEGF与非小细胞肺癌患者临床特征的相关性。
1.3检测方法
1.3.1VEGF和TIDC检测方法 均为免疫组织化学染色,其中TIDC采用S-100兔抗人多克隆抗体标记,VEGF采用VEGF兔抗人多克隆抗体标记(试剂均购买自北京中杉生物技术有限公司),采用SABC法检测,具体操作步骤见说明书。结果判读(1)TIDC:行免疫组织化学染色,400倍镜下对TIDC细胞计数,随机抽取5个视野,其均值作为该患者的TIDC数密度;(2)染色结果为淡黄色或棕黄色为VEGF阳性,否则为阴性。本研究中非小细胞肺癌组织中TIDC和VEGF表达图片资料见图1。
1.3.2TIDC细胞的MHC-Ⅱ和CD54表型测定 取检测的组织脱蜡、水化后,使用胰蛋白酶在37 ℃下消化30 min,过滤后离心(800 r·min-1),去除细胞碎片,沉淀细胞PBS重悬,取106个细胞,离心后去掉上清液,分别加入MHC-Ⅱ和CD54APC抗体(试剂均购买自北京中杉生物技术有限公司),加入固定液进行流式细胞仪检测(BD FACSAriaⅡ分选型流式细胞仪)。
1.4统计学方法采用SPSS 22.0软件完成数据分析。两组患者TIDC数密度等计量资料之间差异采用两独立样本的t检验进行统计分析;两组患者VEGF阳性率差异采用χ2检验进行统计分析。P<0.05表示差异有统计学意义。
2 结果
2.1非小细胞肺癌患者肿瘤组织中和健康组织TIDC和VEGF表达比较与健康组织比较,肿瘤组织中TIDC数密度显着降低[(10.58±3.18)比(18.93±3.26),P=0.000];VEGF阳性率显着增高(43.45%比11.32%,P=0.000);MHC-Ⅱ阳性DC显着降低[(6.48±1.04)%比(12.57±2.57)%,P=0.000];CD54阳性DC显着降低[(7.12±1.59)比(12.81±2.81) %,P=0.000]。见表1。
2.2非小细胞肺癌患者年龄与肿瘤组织中TIDC和VEGF关系年龄≥65岁的患者与其他患者相比,TIDC数密度、VEGF阳性率、MHC-Ⅱ阳性DC和CD54阳性DC比均差异无统计学意义(P>0.05)。见表2。
2.3非小细胞肺癌患者性别与肿瘤组织中TIDC和VEGF关系男性与女性患者TIDC数密度、VEGF阳性率、MHC-Ⅱ阳性DC和CD54阳性DC比均差异无统计学意义(P>0.05)。见表3。
2.4非小细胞肺癌患者临床TNM分期与肿瘤组织中TIDC和VEGF关系与TNM分期为Ⅰ或Ⅱ期的患者相比,Ⅲ或Ⅳ期患者TIDC数密度显着降低[(9.51±2.88)比(11.82±3.58),P=0.000];VEGF阳性率显着增加(61.40%比20.41%,P=0.000);MHC-Ⅱ阳性DC显着降低[(7.83±1.05)%比(5.32±0.91) %,P=0.000];CD54阳性DC显着降低[(6.26±1.01)%比(8.12±1.72)%,P=0.000]。见表4。
2.5非小细胞肺癌患者肿瘤细胞分化程度与肿瘤组织中TIDC和VEGF关系与肿瘤细胞为高分化的患者相比,中低分化的患者TIDC数密度显着降低[(9.58±2.58)比(12.37±3.13),P=0.000];MHC-Ⅱ阳性DC显着降低[(6.01±1.09)%比(7.32±0.93)%,P=0.000);CD54阳性DC显着降低[(6.66±1.68)%比(7.94±1.58)%,P=0.000]。见表5。
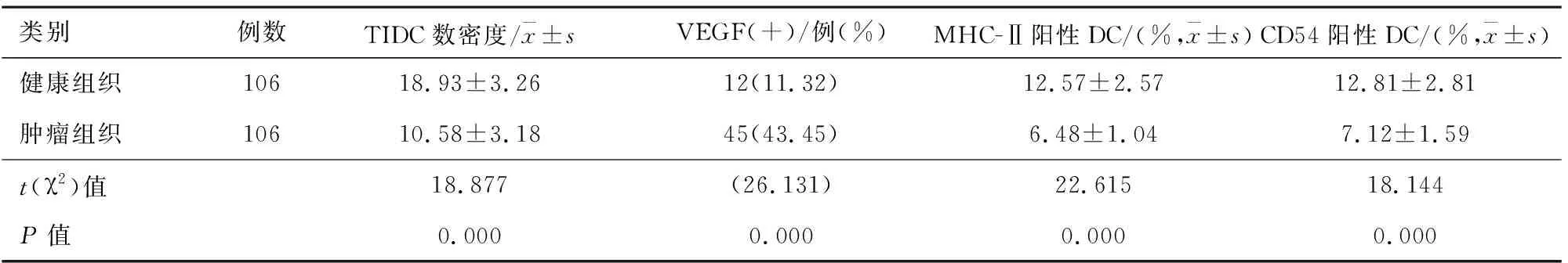
表1 非小细胞肺癌患者肿瘤组织中和VEGF表达比较
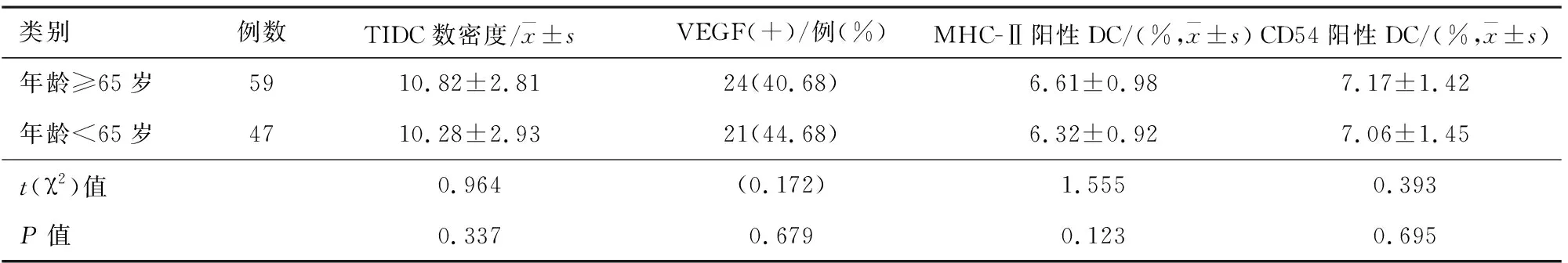
表2 非小细胞肺癌患者年龄与肿瘤组织中TIDC和VEGF关系
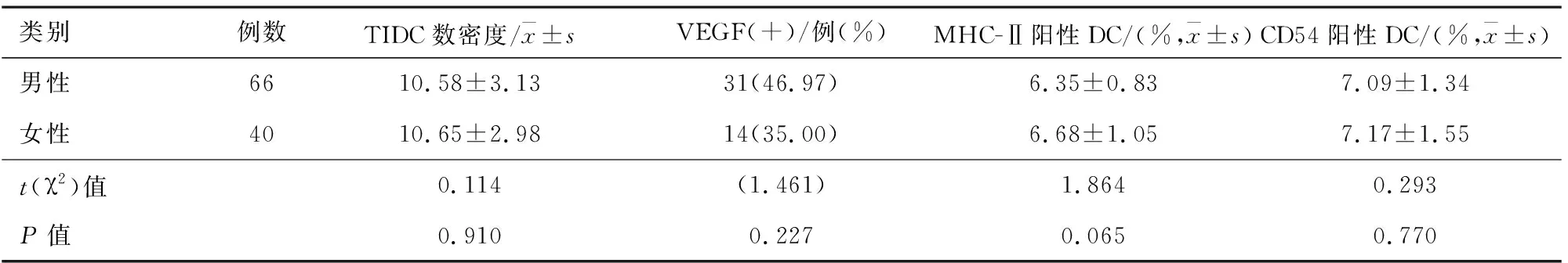
表3 非小细胞肺癌患者性别与肿瘤组织中TIDC和VEGF关系
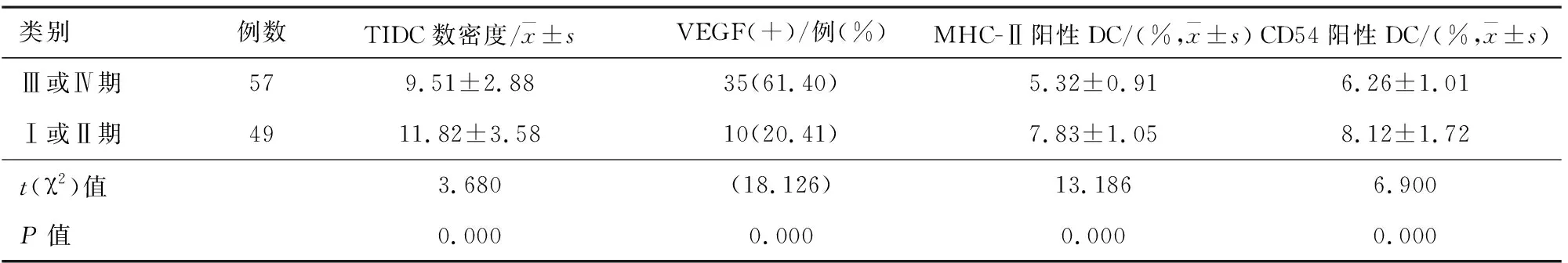
表4 非小细胞肺癌患者临床TNM分期与肿瘤组织中TIDC和VEGF关系
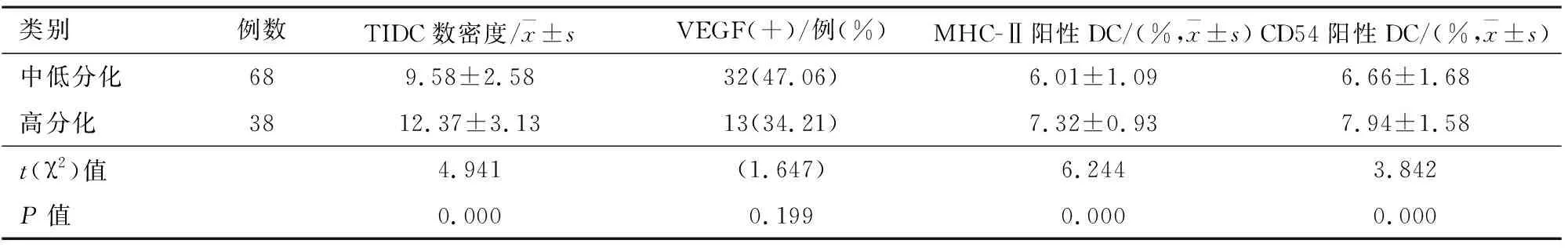
表5 非小细胞肺癌患者肿瘤细胞分化程度与肿瘤组织中TIDC和VEGF关系
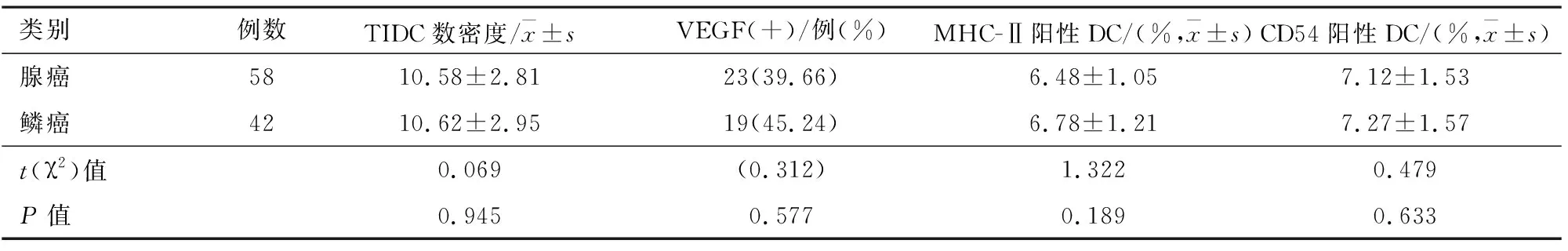
表6 非小细胞肺癌患者肿瘤病理类型与肿瘤组织中TIDC和VEGF关系
2.6非小细胞肺癌患者肿瘤病理类型与肿瘤组织中TIDC和VEGF关系腺癌与鳞癌患者TIDC数密度、VEGF阳性率、MHC-Ⅱ阳性DC和CD54阳性DC比较均差异无统计学意义(P>0.05)。见表6。
3 讨论
非小细胞肺癌是肺癌的主要类型,是导致中老年患者死亡的重要原因之一[11]。肺癌的发生、发展与机体免疫相关,近些年肿瘤免疫学的发展为肿瘤的治疗提供了新方向。树突状细胞在肿瘤患者可以作为一种抗原呈递细胞,刺激细胞毒性T细胞等的增殖,进而对肿瘤细胞进行杀伤。而DC细胞在特定环境下可以表现为免疫抑制作用,这部分DC细胞是不成熟或分化异常的DC细胞组成,主要表现为MHC-Ⅱ和CD54阳性率低下[12-14]。然而目前关于DC细胞及其表型在非小细胞肺癌患者中的表达尚不清楚。为此我们设计了本研究,结果显示肿瘤组织中TIDC数密度、CD54阳性和MHC-Ⅱ阳性率均显着低于正常组织(P<0.05),表明非小细胞肺癌患者肿瘤组织中DC细胞低表达,且以不成熟的DC细胞为主,由于DC细胞是人体最强大的抗原呈递细胞,肿瘤环境中DC水平的降低,可导致机体对肿瘤特异性细胞毒性T细胞的增生促进作用下降,最终导致机体对肿瘤细胞的杀伤作用降低[15-16]。另外,不成熟或分化异常的DC细胞,具有免疫抑制作用,可以分泌不同的细胞因子促进T细胞免疫由Th1免疫向Th2免疫漂移,介导肿瘤细胞对机体的免疫耐受[17-18]。因此肿瘤组织中DC细胞数量降低与不成熟或异常分化,可能会导致患者预后不良,可惜目前相关研究缺乏。本研究显示TNM分期为Ⅲ或Ⅳ期、肿瘤细胞分化程度为低分化的患者肿瘤组织中TIDC数密度、CD54阳性和MHC-Ⅱ阳性率也同样低于其余非小细胞肺癌患者(P<0.05)。DC细胞疗法可能有助于改善非小细胞肺癌患者临床预后。Zhou等[19]研究显示化疗联合DC细胞可以增强对非小细胞肺癌患者肿瘤细胞的杀伤作用。Liu等[20]研究则显示钙网织蛋白可以通过促进DC细胞的成熟和增殖,进而促进抗原特异性细胞毒性T细胞对非小细胞肺癌的杀伤作用。Zhu等[21]研究则显示DC联合放疗可以明显改善ⅢB期非小细胞肺癌患者的临床治疗有效率。但是目前相关研究较为缺乏,尚不能作为依据指导临床治疗,急需大样本量的多中心随机对照研究证实。另外,本研究显示非小细胞肺癌患者肿瘤组织中VEGF阳性率增高,且TNM分期为Ⅲ或Ⅳ期的患者VEGF阳性率高于Ⅰ或Ⅱ期患者(P<0.05),VEGF是肿瘤血管生成的重要促成因子,肿瘤组织中VEGF高表达可以促进肿瘤血管的生成,进而促进肿瘤细胞的生长和转移[22-24]。
综上所述,TIDC在肿瘤组织中低表达,且多为不成熟的调节性DC细胞,VEGF在肿瘤组织中高表达,均与患者临床预后恶化有关。
(本文图1见插图9-2)



