孙海涛,郝铁,杨卫红,陈士林,高徽
(鞍山市中心医院检验科,辽宁 鞍山 114001)
重症急性胰腺炎、重症肺炎等均可导致脓毒症,脓毒症是一个致死性的常见病,是导致住院患者死亡的主要病因之一[1]。随着医疗技术的进展,持续性肾脏替代治疗、机械通气等脏器功能支持手段使得脓毒症患者死亡率已有下降趋势,但是整体死亡率仍较高。但脓毒症患者死亡率仍可高达20%左右[2-3],尤其是在重症患者中。因此早期识别脓毒症患者病情严重度,具有十分重要的临床意义[4-5]。为此,国内外学者进行了大量的临床研究。目前较为常用的指标为降钙素原、C反应蛋白、APPACHEⅡ评分、SOFA评分、乳酸等,这些指标与脓毒症患者病情严重度均有一定的关联性[6-7]。然而上述指标均有一定的局限性,如APPACHEⅡ评分和序贯器官衰竭(SOFA)评分等耗时较长、过程复杂,且对于脓毒症患者而言缺乏特异性。C反应蛋白、乳酸等在非感染性疾病中也可明显升高。因此尚有必要探讨新的生物学指标,联合检测这些指标可能更有助于早期识别危重患者。作为转化生长因子-β亚家族的一个重要成员,激活素-α通过与Smads及丝裂原活化蛋白激酶信号通路的激活,参与了感染性疾病的反应过程[8-9]。2016年国外的一项研究显示激活素-α随着脓毒症患者病情严重度的增加而增加,其水平升高是脓毒症患者死亡的危险因素[10]。然而,目前国内尚无相关研究。本研究旨在探讨激活素-α在脓毒症患者中的表达水平及临床意义。
1 资料与方法
1.1一般资料自2015年1月至2016年12月,前瞻性收集鞍山市中心医院收治的脓毒症患者127例,纳入标准:(1)脓毒症(诊断标准:同时合并感染和系统性炎症;(2)年龄18~65岁;(3)同意参与本研究。排除标准:(1)原发性肝肾等脏器功能不全;(2)既往心肌梗死等重大心血管疾病;(3)合并恶性肿瘤;(4)入院时间离发病超过24 h;(5)意识不清,不能配合本研究;(6)入组前已行液体复苏等特殊治疗;(7)免疫系统疾病;(8)甲状腺功能不全;(9)放弃治疗或转院。研究期间,根据纳入标准和排除标准,共纳入脓毒症患者127例,根据患者病情严重程度,将患者分为脓毒症组(n=21)、严重脓毒症组(n=68)和脓毒性休克组(n=38)。所有患者均知情同意并签署知情同意书,通过鞍山市中心医院伦理委员会批准。
1.2诊断标准(1)脓毒症:感染引起的全身系统性炎性反应;(2)严重脓毒症:在脓毒症基础上出现灌注不足,包括:神志变化、低氧血症、少尿、高乳酸血症和脏器功能损伤等;(3)脓毒性休克:在脓毒症基础上,液体复苏后平均动脉压≤65 mmHg[11]。
1.3治疗方法根据国际脓毒症治疗指南[11],所有患者入院后均给予早期抗感染、控制原发疾病、重症监护、液体复苏、维持水电解质酸碱平衡等对症支持治疗,必要时给予持续性血液滤过和机械通气等脏器功能支持。
1.4观察指标主要观察指标包括激活素-α、降钙素原、C反应蛋白、APPACHEⅡ评分、SOFA评分、乳酸、住院时间、死亡率和脏器功能损伤情况。
1.5统计学方法采用SPSS22.0软件完成本研究数据分析。三组患者激活素-α等计量资料之间的差异采用方差分析;三组患者死亡率等计数资料之间的差异采用χ2检验;此外采用多因素logistic回归分析探讨脓毒症患者死亡的危险因素。P<0.05表示差异有统计学意义。
2 结果
2.1三组患者基础临床指标三组患者年龄、性别、合并症等发生率均差异无统计学意义(P>0.05)。见表1。
2.2三组患者病情严重度指标脓毒症组、严重脓毒症组和脓毒性休克组患者激活素-α分别为(365.57±86.57)、(553.85±108.58)和(974.77±178.54) μg·L-1;降钙素原分别为(2.46±0.52)、(3.12±0.75)和(3.54±0.78) pg·L-1;APPACHEⅡ评分分别为(13.57±4.38)、(18.48±5.22)和(24.89±7.12)分;SOFA评分分别为(4.12±1.28)、(7.88±2.09)和(11.83±4.25)分;乳酸分别为(2.45±0.54)、(3.98±0.78)和(5.12±1.53)mmol·L-1;以上均差异有统计学意义(P<0.05)。见表2。
2.3三组患者临床预后指标三组患者住院时间分别为(37.58±8.39)、(55.48±9.12)、(51.38±10.38)d;死亡率分别为0.00%、22.06%和52.63%;多脏器功能损伤率分别为0.00%、30.88%和81.58%;以上均差异有统计学意义(P=0.000)。见表3。
2.4脓毒症患者死亡的危险因素分析以脓毒症患者127例为样本,以死亡状态为应变量(1=死亡,0=生存),进行多因素logistic回归分析。自变量为前述单因素分析(表2)中P<0.05的指标/因素,共5个。采用后退法(P>0.05为退出标准)进行变量筛选和剔除。结果见表4。显示:激活素-α、APPACHEⅡ评分、SOFA评分和乳酸升高是脓毒症患者死亡的危险因素(P<0.05),其OR值均在1.1以上。
3 讨论
作为一种常见的致死性疾病,脓毒症具有病情复杂、严重等一系列特征。2016年Fleischmann等研究显示脓毒症和严重脓毒症患者死亡率分别为17%和26%,全球范围内每年月530万人死于脓毒症[12]。为更好地区分重症患者,脓毒症治疗指南将脓毒症患者分为脓毒症、严重脓毒症和脓毒性休克,可以较好地区分患者病情严重程度。早期识别危重患者,可以对这类患者加强干预,或许可进一步降低脓毒症患者死亡率。激活素-α具有促炎作用,可以通过促进肿瘤坏死因子-α、白细胞介素-6等炎性因子,诱导一氧化氮合酶,最终促进炎性反应的产生[9,13]。脓毒症是由于感染引起的一个全身性炎性反应性疾病,过度扩大的炎性反应可导致患者脏器功能损伤、血容量不足、休克等,甚至死亡。因此脓毒症患者激活素-α水平可显着升高。为探讨激活素-α在脓毒症患者中的表达水平和临床意义,2016年Lee等纳入了130例脓毒症患者,结果显示脓毒症、重度脓毒症和脓毒性休克患者激活素-α水平分别为251、319和432 μg·L-1差异有统计学意义(P=0.000),激活素-α升高是脓毒症患者死亡的危险因素[10]。本研究同样显示激活素-α随着脓毒症患者病情严重程度升高而升高,多因素logistic回归分析显示激活素-α、APPACHEⅡ评分、SOFA评分和乳酸升高是脓毒症患者死亡的危险因素(P<0.05)。C反应蛋白是一种急性相蛋白,在感染或非感染性炎性反应时均可明显升高,临床中被广泛使用。既往学者认为炎性反应程度越严重,C反应蛋白越高,但本研究显示脓毒症、严重脓毒症和脓毒性休克患者C反应蛋白水平差异无统计学意义。
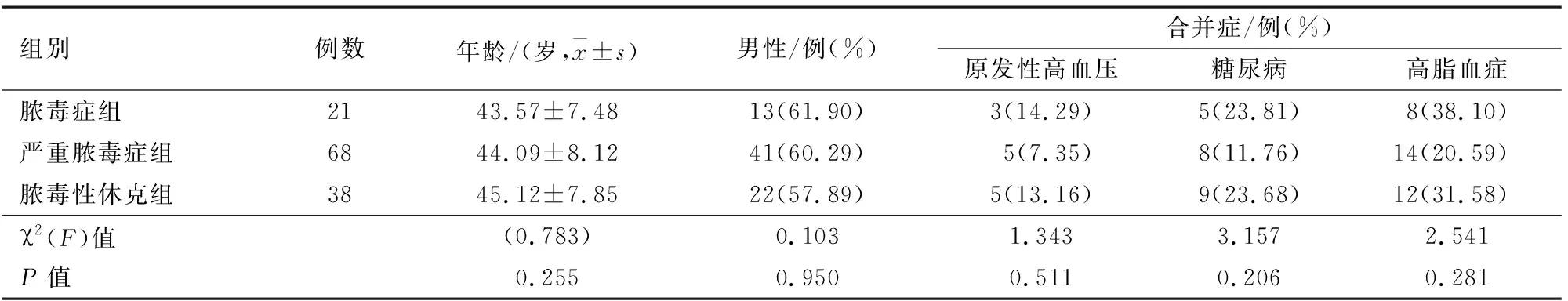
表1 三组患者基础临床指标
表2 三组患者病情严重度指标

表3 三组患者临床预后指标
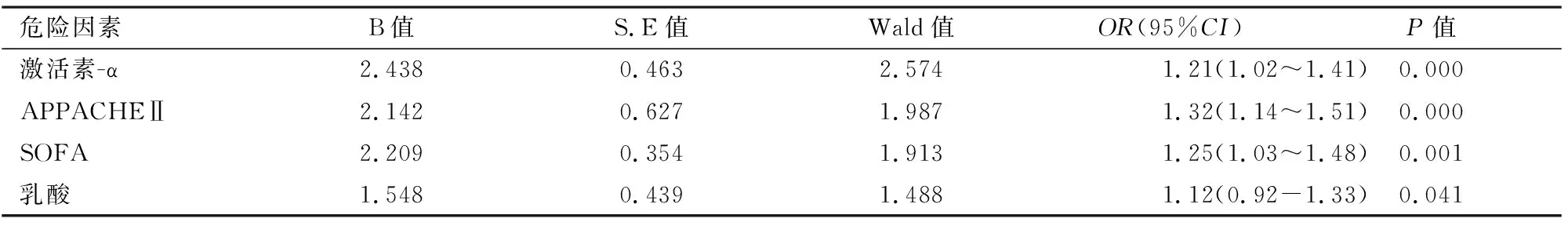
表4 脓毒症患者死亡的危险因素分析
激活素-α升高导致脓毒症患者预后不良的机制尚不完全清楚。可能与激活素-α的炎性刺激作用有关。脓毒症的发病主要是由原发疾病引起的一个全身性感染,感染的刺激导致全身系统性的炎性反应,炎性反应形成级联反应,降低患者体内炎性反应有助于改善患者临床预后。Honore等研究显示使用持续性血液滤过降低脓毒症炎性反应水平,进而改善患者临床预后[14]。肿瘤坏死因子-α、白介素-6等是炎性因子,其水平升高是脓毒症患者预后不良的因素[15-16]。而激活素-α可以诱导一氧化氮合酶、肿瘤坏死因子-α、白细胞介素-6等,进一步扩大患者炎性反应,进而导致脓毒症患者临床预后恶化。



