马斌,王艺璇,冉婕,鲁琰,李天刚,杨磊
剖宫产瘢痕妊娠(cesarean scar pregnancy,CSP)在以往产科收治的病例中发生率较低,是一种剖宫产产妇再次妊娠时发生的并发症[1]。近年来随着剖宫产率的增加,CSP的发生频率也越来越高,但CSP早期症状并不明显,诊断难度较大[2]。CSP经常侵入子宫肌层并变成病态黏附胎盘,胎盘的进行性深侵可能导致严重的产科并发症,如大量出血及子宫裂开等[3]。如未及时发现并进行手术治疗,严重时可能会威胁到产妇生命安全[4]。手术治疗方案的选择需要对术中出血情况进行预估,但目前仍缺乏对病人术中出血情况准确评估的方法[5]。研究表明[3],超声造影(contrast-enhanced ultrasound,CEUS)在诊断CSP时能提供更多的影像学参数,与经阴道超声(transvaginal ultrasound,TVS)结合对CSP的诊断评估具有更高的价值。因此,该研究回顾性收集了104例CSP病人的临床资料及TVS、CEUS等影像学资料。通过多因素分析筛选出合适指标,旨在构建能对CSP病人术中出血情况准确预估的模型,为临床制定CSP病人个体化手术治疗方案提供一定参考。
1 资料与方法
1.1一般资料以甘肃省妇幼保健院产科2018年2月至2020年2月收治CSP病人为研究对象进行回顾性研究。按照下文纳入标准及排除标准筛选后,共收集到104例病例资料。病人年龄(35.1±6.4)岁,停经天数(48.2±8.3)d。将术中出血≥400 mL的26例病人作为观察组,出血<400 mL的78例病人作为对照组。纳入标准:(1)剖宫产再次妊娠;(2)行TVS和CEUS检查;(3)CEUS后3 d进行手术并取得病理结果;(4)手术方式为宫腔镜下清宫术,手术均由主任医师完成。排除标准:(1)孕周>12周;(2)临床病理及超声资料缺失或合并其他出血性疾病者;(3)行清宫术前服用甲氨蝶呤治疗者。CSP超声诊断标准参照剖宫产术后子宫瘢痕妊娠诊治专家共识(2016)[6]。病人或其近亲属对治疗方案签署知情同意书,该研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2仪器与方法采用GEVOLUSON E8型号彩超仪,探头频率5.0~7.5 MHz。造影探头为RIC5-9-D,频率5.0~9.0 MHz,机械指数(MI)为0.06。造影剂选用意大利Bracco公司生产的Sonovue(声诺维)。先经阴道行常规妇科超声检查,发现可疑病灶后行多切面扫查,明确病灶与切口的位置关系。然后行CEUS检查,选取典型切面固定探头,抽取1.2 mL造影剂,肘部团注,开始推注造影剂时计时,记录并储存造影后病灶的动态图,测量造影后病灶绒毛距浆膜层的最近距离,丛密绒毛膜厚度,病灶的前后径、上下径,病灶突入切口的前后径、上下径。
纵切及横切时经测量所得绒毛膜距浆膜层最近距离,二者取其小。造影后病灶长径取病灶前后径、左右径、上下径三者中的最大值。突入切口的平均径取突入切口的前后径、左右径、上下径三者的平均值。上述需收集的数据均2次测量,取平均值。
1.3统计学方法数据分析采用SPSS 19.0软件。计量资料满足正态分布用±s表示,两组间比较采用两独立样本t检验,不满足正态分布用中位数(下四分位数,上四分位数)[M(P25,P75)]表示,用秩和检验分析组间差异。计数资料用例(%)进行表示,用χ2检验分析组间差异。用logistic回归分析进行多因素分析,变量筛选用Forward:LR法。用ROC曲线验证预测模型的准确性。检验水准α=0.05。
2 结果
2.1术中大出血单因素分析与对照组病人比较,观察组病人剖宫次数≥2次者比例、丛密绒毛膜厚度、病灶长径、病灶突入切口的平均径升高(均P<0.05);观察组病人病灶绒毛膜距浆膜层最近距离降低(均P<0.05)。见表1。CSP病人TVS和CEUS图像特征见图1。
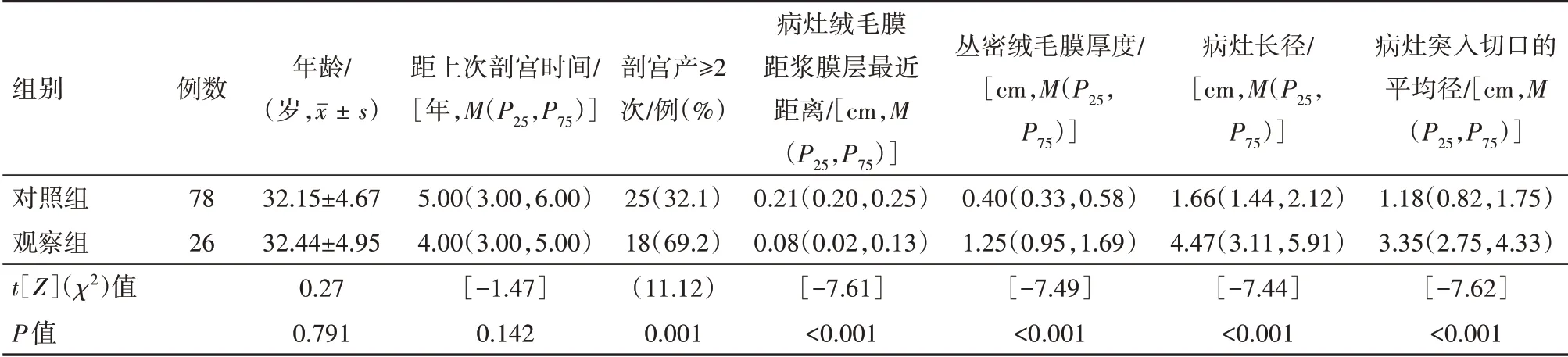
表1 剖宫产瘢痕妊娠(CSP)104例病人术中大出血单因素分析
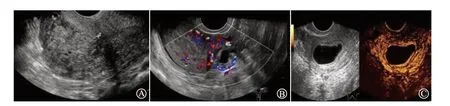
图1 CSP病人超声图像特征:A为病灶突向包膜外;B为病灶周边血流丰富;C为造影呈典型“面包圈”征
2.2多因素logistic回归分析logistic回归分析结果示,病灶绒毛膜距浆膜层最近距离(X1)、丛密绒毛膜厚度(X2)、病灶突入切口的平均径(X3)、剖宫次数(X4)是CSP病人术中大出血的独立预测因子。建立的logistic预测模型为Logit(P)=−13.435X1+2.684X2+0.916X3+2.583X4−6.854。见表2。
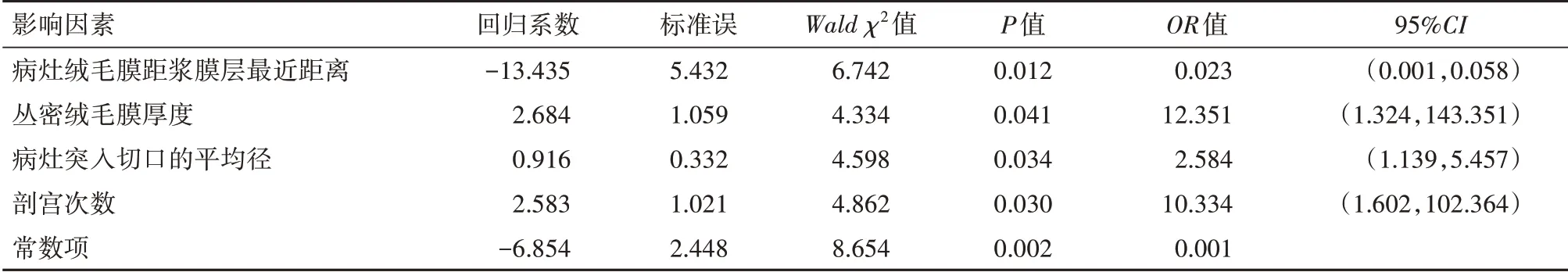
表2 剖宫产瘢痕妊娠(CSP)104例病人术中大出血多因素logistic回归分析
2.3术中大出血的预测分析根据logistic预测模型可计算得到CSP病人术中大出血预测概率。并将预测概率作为变量值进行ROC曲线验证分析,得到曲线下面积为0.834[P<0.001,95%CI为(0.769,0.886)],见图2。当概率值取最佳截断值0.650时,模型预测的准确度、灵敏度、特异度分别为84.62%、85.92%、81.82%。
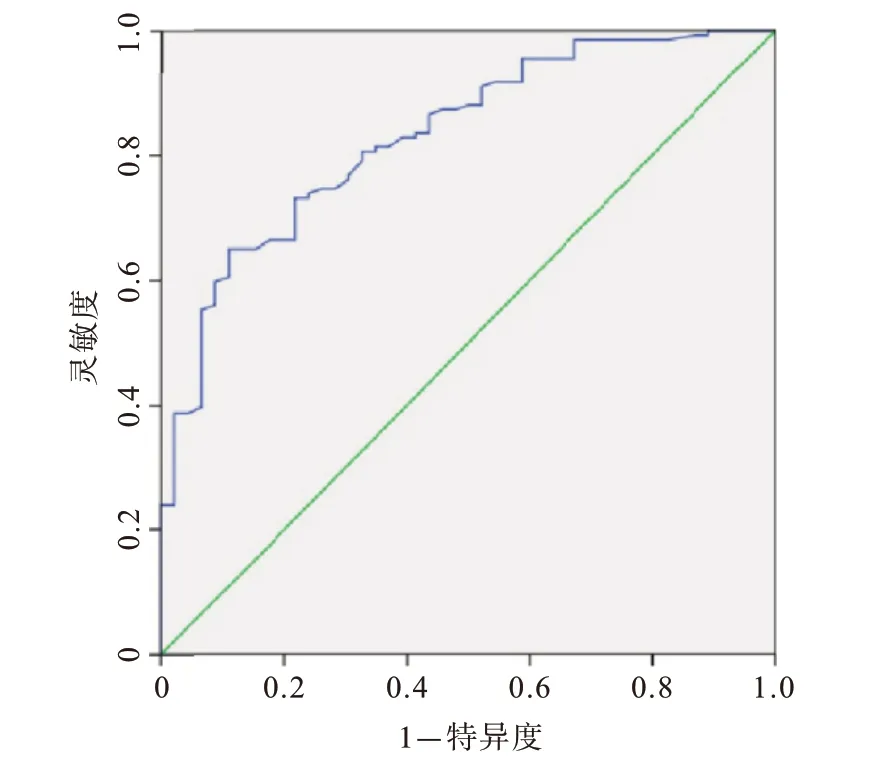
图2 剖宫产瘢痕妊娠(CSP)104例病人术中大出血logistic回归模型的ROC曲线图
3 讨论
近年来,随着剖宫产率的增加,CSP的发生率也不断攀升[7]。CSP远期并发症较多,如术中大出血、再次妊娠子宫破裂等[8]。对于CSP治疗的关键是要尽早发现,及时终止妊娠。但CSP早期症状并不明显,诊断难度较大,严重威胁产妇的生命安全[9]。研究表明,对于术前没有并发症的CSP,可以通过甲氨蝶呤进行药物治疗,疗效高达80%,同时保留了病人再次生育能力[10]。对于有并发症的CSP,宫腔镜或腹腔镜等微创手术可以作为首选方法[11]。但当病人生命体征不稳,或微创手术无法操作时还需进行剖腹手术[12]。此外,对于符合子宫动脉栓塞术适应证的病人,在清宫术前行子宫动脉栓塞术预处理能有效降低术中的出血风险[13]。
研究表明,CSP病人的CEUS有典型的增强模式,病灶在剖宫切口处的部分组织会早于正常子宫肌层增强,然后逐渐形成典型的“面包圈”征,通过这种典型的增强表现,不仅可以重新测量病灶的大小、病灶绒毛膜的厚度、切口处残余肌层的最薄处厚度,还可以判断病灶与子宫浆膜层的关系[14]。该研究发现,病灶绒毛膜距浆膜层最近距离、丛密绒毛膜厚度、病灶突入切口的平均径、剖宫次数是CSP病人术中大出血的独立预测因子。有研究报道,CSP不同分型的病人术中出血风险不一,两分法的外生型CSP病人的出血风险远高于内生型[15]。可能是因为这种类型的CSP病人妊娠囊在瘢痕肌层处向膀胱方向外突,导致两者之间的肌层变薄甚至缺失,出血风险显着增加。剖宫产≥2次的CSP病人再次妊娠发生术中大出血甚至子宫破裂的风险是1次剖宫产史病人的十几倍[16]。血流信号也是CSP病人术中出血的重要预测因子,丰富的低阻血流信号表明绒毛组织在肌层的植入更多[17]。通过预测模型对CSP病人术中出血风险的准确预估可能对临床上治疗方式的选择提供一定指导。如果术中出血风险的预测概率值过大,可以考虑用甲氨蝶呤药物或者子宫动脉栓塞术预处理后,再进行清宫或妊娠物清除手术,以降低术中大出血的风险[18-19]。该研究发现,通过ROC曲线对模型进行验证时得到的曲线下面积为0.834。当概率值取最佳截断值0.650时,模型预测的准确度、灵敏度、特异度分别为84.62%、85.92%、81.82%。
综上,术前进行TVS及CEUS检查,综合CSP病灶绒毛膜距浆膜层最近距离、丛密绒毛膜厚度、病灶突入切口的平均径、剖宫次数等因子构建的预测模型,在CSP病人术中大出血的风险评估中具有较高的预测价值,对临床中个体化手术治疗方案的制定具有重要的借鉴价值。



