李华,徐鹏,赵艳,雷艳青
作者单位:湖北医药学院附属襄阳市第一人民医院急诊科,湖北 襄阳 441000
乌头碱是存在于川乌、草乌、附子等植物中的主要成分,民间常用于治疗风湿麻痹等疾病[1],但也因炮制不当食用出现中毒甚至死亡。乌头碱目前还未发现特效解药[2]。柴胡皂苷A是由伞形科植物柴胡的根茎提取、提纯制成的粉末,具有抗炎、抗病毒的作用,此外还有镇静和抗惊厥等诸多药理学作用[3]。动物研究显示柴胡皂苷A具有抑制海马炎症反应以及提高大鼠认知功能相关蛋白水平的作用[4],但柴胡皂苷A是否对乌头碱引起的脑组织损伤有保护作用,尚未有研究报道。本研究旨在探索柴胡皂苷A对乌头碱中毒大鼠脑组织的影响及其可能存在的作用机制。
1 材料与方法
1.1 主要试剂及仪器Saikosaponin A(中国上海源叶生物科技有限公司),Aconitine、ECL 试剂盒(中国上海经科化学科技有限公司),兔抗鼠Bcl 相关X 蛋白(Bax)抗体(中国上海优予生物科技有限公司),兔抗鼠B细胞淋巴瘤2(Bcl-2)、半胱氨酸蛋白酶3(Cas‑pase-3)、CCAAT/增强子结合蛋白同源蛋白(CHOP)、葡萄糖调节蛋白78(GRP78)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(中国上海恒斐生物科技有限公司),TUNEL 试剂盒(中国江苏凯基生物技术股份有限公司),丙二醛(MDA)、超氧化物歧化酶(SOD)酶联免疫吸附测定(ELISA)试剂盒(上海远慕生物科技有限公司),肿瘤坏死因子-α(TNF-α)elisa 试剂盒(中国上海信帆生物科技有限公司),白细胞介素-6(IL-6)elisa 试剂盒(中国上海歌凡生物科技有限公司),冷冻离心机3K15(美国Sigma 公司),正置荧光显微镜FM-51D(中国上海绘统光学仪器有限公司),全自动轮盘式切片机(LEICA)。
1.2 实验动物及分组本研究自2018 年10 月至2019 年7 月,选取购自武汉大学中南医院动物实验中心SPF 级健康雄性16~20 周龄SD 大鼠100 只[武汉大学中南医院动物实验中心,许可证号SYXK(鄂)2015-0025],体质量范围为250~300 g。购回饲养1 周,温度20~25 ℃,空气湿度50%~55%,人工光照,光照12 h、黑暗12 h,所有大鼠全天饮水自由。将100 只SD 大鼠随机均分为对照组、模型组、干预组1、干预组2、干预组3,每组各20 只。本研究符合一般动物实验伦理学原则。
1.3 模型制备及给药处理参考文献[5]中的染毒方法进行乌头碱中毒大鼠模型制备,模型组与干预组大鼠均进行乌头碱(20µg/kg)尾静脉注射,观察各组大鼠心电图情况,待大鼠心律失常3 min后进行药物干预,干预组1、干预组2、干预组3 分别注射不同剂量的柴胡皂苷A(5 mg/kg、10 mg/kg、20 mg/kg),模型组与对照组注射等剂量生理盐水。各组分别于干预后12 h、24 h时随机选取10只大鼠进行麻醉处死,分离脑组织。
1.4 HE 组织染色与TUNEL 法检测组织凋亡分别于药物干预后12 h、24 h,采用1%戊巴比妥钠麻醉处死大鼠,分离脑组织,一部分固定于4%多聚甲醛,常规石蜡包埋、切片、染色详细步骤参考文献[6]。一部分脑组织用于TUNEL 细胞凋亡情况,组织固定、包埋、切片方法与HE 组织染色相同。各组所有片子在400 倍视野下选取海马区不重叠视野4 个进行观察。阳性判定标准:细胞核呈现出棕黄色或棕褐色颗粒为阳性细胞,记为凋亡的海马神经细胞,经Image-Pro Plus 6.0软件对高倍镜下的阳性细胞数目进行统计,神经细胞凋亡率=(阳性细胞个数/有核细胞总数)×100%。
1.5 氧化应激指标及炎症反应指标检测将各组织大鼠完整脑组织取出,加入组织细胞裂解液、蛋白酶抑制剂,研磨成组织匀浆,3 000 r/min,离心20 min,取上清液,采用联免疫法检测各组大鼠脑组织中MDA、TNF-α、IL-6水平,SOD 活性,实验操作严格按照试剂盒说明书进行。
1.6 蛋白质印迹法(Western blotting)检测参照蛋白质提取试剂盒说明对各组大鼠脑组织蛋白进行提取,Bradford 调整蛋白浓度,依次经过SDS-PAGE电泳、电转膜,密封2 h,加入兔抗鼠Caspase-3、Bax、Bcl-2、CHOP、GRP78、GAPDH 一抗(1∶500)4 ℃孵育过夜再用TBST 漂洗40 min,加入HRP 标记的二抗(1∶500)孵育1 h,参照ECL 试剂盒操作说明进行观察膜上蛋白条带,收集影像。
1.7 统计学方法采用SPSS 22.0 软件,文中数据以±s表示,符合正态分布且方差齐的数据组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t检验,反之采用非参数Mann-WhitneyU检验,检验水准α=0.05;文中剂量效应分析时,除去对照组,把模型组(药物干预剂量为0)与3个不同干预剂量处理的干预组进行单因素方差分析,然后再进行LSD-t检验,当方差分析和两两比较LSD-t均P<0.05后,说明有剂量反应性。
2 结果
2.1 柴胡皂苷A 对乌头碱中毒大鼠脑组织的影响将各组大鼠麻醉后,取完整的脑组织进行HE染色观察脑组织情况,结果显示对照组大鼠脑组织神经元细胞形态的正常,呈现出圆形或者椭圆形,核膜完整,无病变细胞。模型组大鼠脑组织神经元细胞呈现出胞核固缩、细胞肿胀、神经元变性及坏死症状,且排列稀疏。干预组1、干预组2、干预组3大鼠神经细胞的病变情况逐渐减轻,见图1。
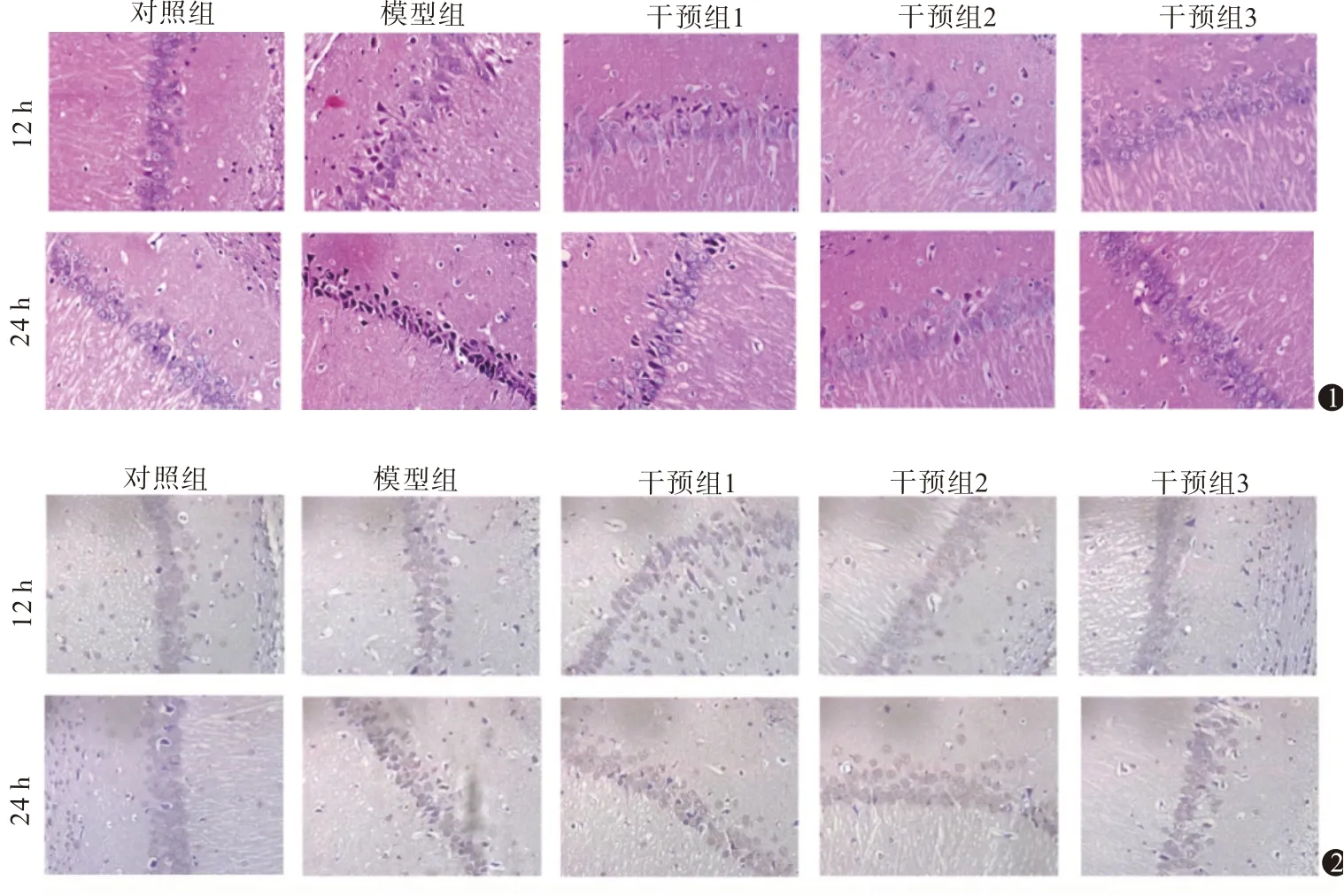
图1 各组大鼠脑组织情况(HE染色×400) 图2 乌头碱中毒大鼠脑组织凋亡情况(TUNEL检测×400)
2.2 柴胡皂苷A对乌头碱中毒大鼠脑组织氧化应激的影响将各组大鼠的脑组织取出并匀浆离心,留取上清液用于检测脑组织SOD 活性及MDA 含量。结果显示,与对照组相比,模型组、干预组大鼠12 h、24 h SOD活性降低,MDA含量升高(P<0.05);与模型组相比,干预组大鼠12 h、24 h SOD 活性升高,MDA含量降低,均差异有统计学意义(P<0.05),见表1。
表1 各组大鼠脑组织SOD、MDA含量比较/±s
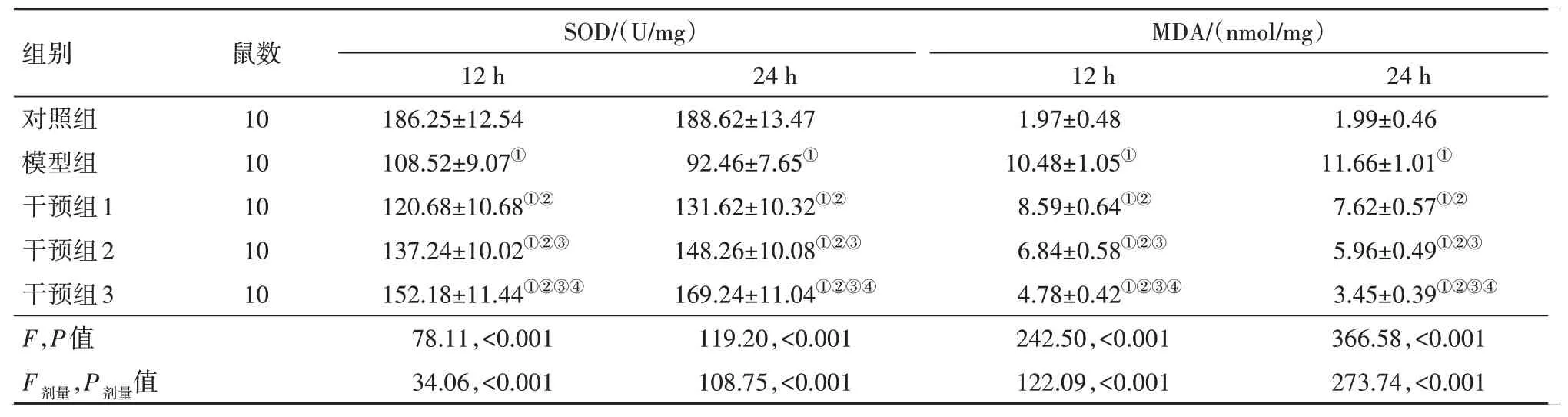
表1 各组大鼠脑组织SOD、MDA含量比较/±s
注:MDA为丙二醛,SOD为超氧化物歧化酶。①与对照组同时点比较,P<0.05。②与模型组同时点比较,P<0.05。③与干预组1同时点比较,P<0.05。④与干预组2同时点比较,P<0.05。
?
2.3 柴胡皂苷A 对促乌头碱中毒大鼠脑组织炎症反应的影响将各组大鼠的脑组织取出并匀浆离心,留取上清液用于检测脑组织TNF-α、IL-6 含量。结果显示,与对照组相比,模型组、干预组大鼠12 h、24 h 的TNF-α、IL-6 含量均升高(P<0.05);与模型组相比,干预组大鼠12 h、24 h的TNF-α、IL-6含量均降低(P<0.05),见表2。
表2 各组大鼠脑组织TNF-α、IL-6含量比较/(ng/L,/±s)
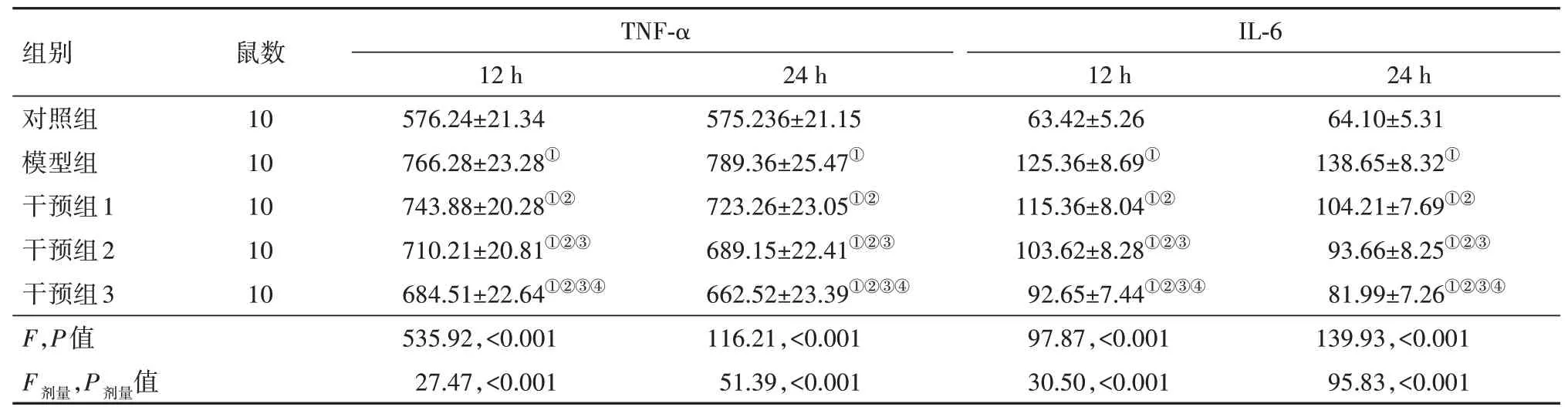
表2 各组大鼠脑组织TNF-α、IL-6含量比较/(ng/L,/±s)
注:TNF-α为肿瘤坏死因子-α,IL-6为白细胞介素-6。①与对照组同时点比较,P<0.05。②与模型组同时点比较,P<0.05。③与干预组1同时点比较,P<0.05。④与干预组2同时点比较,P<0.05。
?
2.4 柴胡皂苷A 对促乌头碱中毒大鼠脑组织凋亡的影响TUNEL 检测结果显示,与对照组相比,模型组、干预组大鼠12 h、24 h的脑组织细胞凋亡率均升高,均差异有统计学意义(P<0.05);与模型组相比,干预组大鼠12 h、24 h的脑组织细胞凋亡率均降低(P<0.05)。Western blotting 检测结果显示,与对照组相比,模型组、干预组大鼠12 h、24 h 的脑组织Bcl-2 蛋白水平均降低,Bax 蛋白水平均升高(P<0.05);与模型组相比,干预组大鼠12 h、24 h 的脑组织Bcl-2 蛋白水平均升高,Bax 蛋白水平均降低(P<0.05)。见图2,3;表3。
表3 各组大鼠脑组织细胞凋亡率和Bax、Bcl-2蛋白水平比较/±s
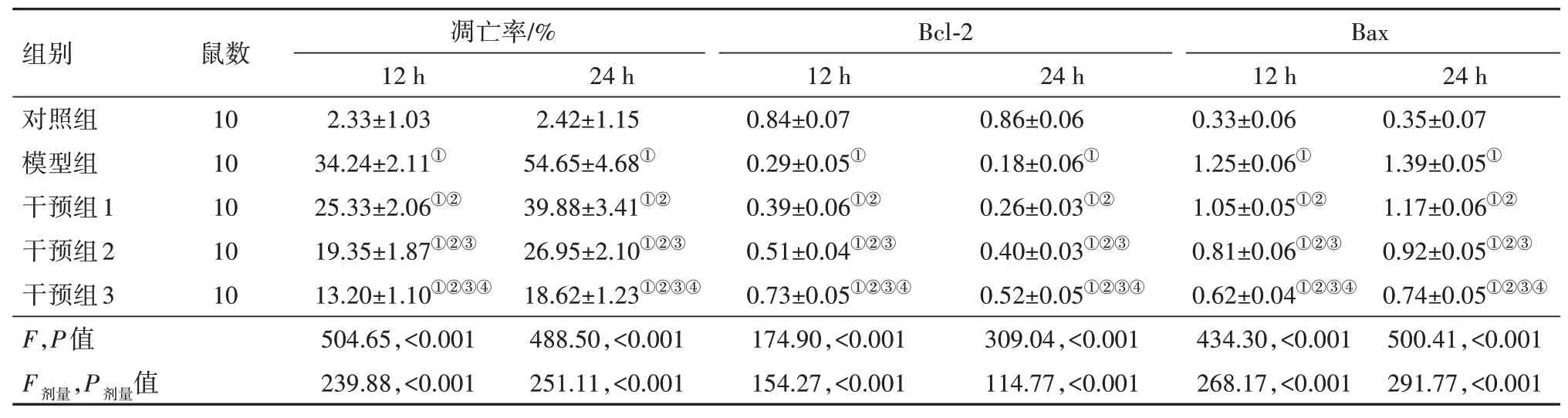
表3 各组大鼠脑组织细胞凋亡率和Bax、Bcl-2蛋白水平比较/±s
注:Bcl-2为B细胞淋巴瘤/白血病-2,Bax为Bcl相关X蛋白。①与对照组同时点比较,P<0.05。②与模型组同时点比较,P<0.05。③与干预组1同时点比较,P<0.05。④与干预组2同时点比较,P<0.05。
?
2.5 柴胡皂苷A 对乌头碱中毒大鼠脑组织内质网应激信号通路的影响Western blotting 检测结果显示,与对照组相比,模型组、干预组大鼠12 h、24 h的脑组织CHOP、GRP78蛋白水平均升高(P<0.05);与模型组相比,干预组大鼠12 h、24 h 的脑组织CHOP、GRP78蛋白水平均降低(P<0.05)。见图4,表4。
表4 各组大鼠脑组织CHOP、GRP78蛋白水平比较/±s
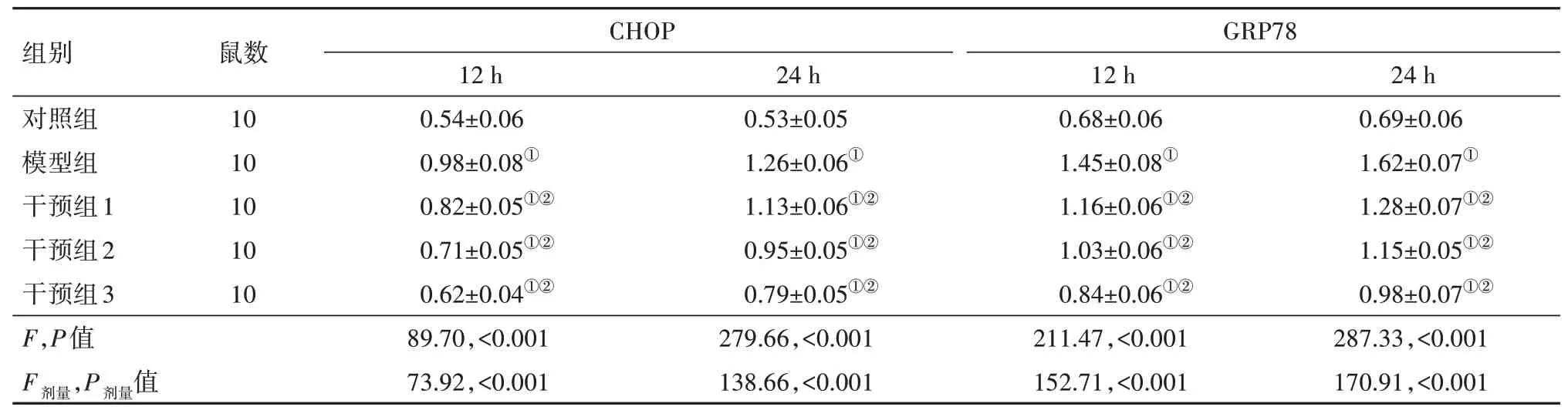
表4 各组大鼠脑组织CHOP、GRP78蛋白水平比较/±s
注:CHOP为CCAAT/增强子结合蛋白同源蛋白,GRP78为葡萄糖调节蛋白78。①与对照组同时点比较,P<0.05。②与模型组同时点比较,P<0.05。
?
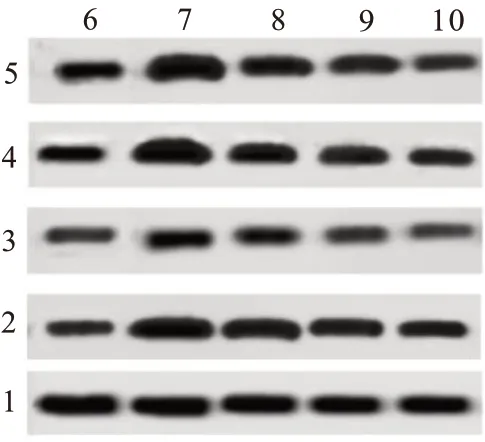
图4 各组大鼠脑组织CHOP、GRP78蛋白凝胶成像结果
3 讨论
乌头碱对机体各个器官均有一定的毒性作用,其中以神经系统与心血管系统受损最严重。2%乌头碱溶液处理大鼠脑片皮质20 min,可使神经细胞全部死亡[7]。柴胡皂苷A 具有较好的抗炎、调节免疫[8]、抵抗肝纤维化[9]以及镇静、抗惊厥作用,同时还能够改善脑损伤大鼠认知功能与神经功能[10]。本研究发现柴胡皂苷A可以改善乌头碱中毒大鼠脑组织病理情况,延缓中毒大鼠脑组织细胞凋亡,表明柴胡皂苷A对乌头碱中毒大鼠也有脑组织保护作用。
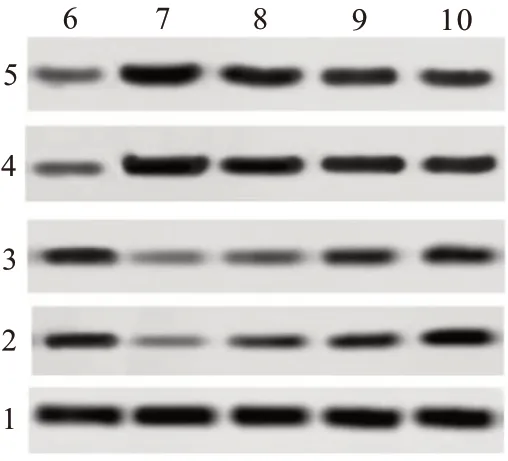
图3 各组大鼠脑组织Bax、Bcl-2蛋白凝胶成像结果
细胞凋亡也叫作细胞程序性死亡,引起细胞凋亡的因素众多,包括创伤、缺血缺氧、毒物刺激、感染等。凋亡也是多种基因共同作用结果,主要涉及两条途径,一条是细胞膜上的死亡受体激活半胱氨酸蛋白激酶,引起细胞凋亡途径活化;另一条是通过细胞质线粒体途径释放各种细胞凋亡因子,激活半胱氨酸蛋白激酶活性,经过系列的信号传导,使胞内蛋白质降解,促使细胞凋亡[11]。本研究结果显示,柴胡皂苷A 可以升高Bcl 蛋白水平,降低Bax 蛋白水平。Bcl-2 是线粒体途径凋亡通路中的重要成员,其含量增加可以抑制细胞凋亡,Bax 有促进细胞凋亡的作用,两者比值变化可直接反映组织凋亡情况[12-13]。由此表明,柴胡皂苷A 可以通过调节乌头碱中毒大鼠脑组织中Bax、Bcl 蛋白水平,来降低脑组织细胞凋亡率。
乌头碱中毒大鼠脑组织出现凋亡,暗示脑组织出现损伤,氧化应激、炎症反应也参与脑组织损伤进程[14]。本研究结果显示,柴胡皂苷A 可以降低乌头碱中毒大鼠脑组织中MDA、TNF-α、IL-6 水平,增加SOD活性。MDA 是脂质过氧化的终端产物,其水平变化可以直接显示组织损伤严重程度,SOD 是机体清除自由基的主要物质[15-16]。TNF-α、IL-6 属于促炎因子之一,机体内部的TNF-α、IL-6 主要是由单核细胞、巨噬细胞产生,脑内小胶质细胞、星形胶质细胞、神经细胞以及血管内皮细胞也可以分泌。朱双龙等[17]研究显示柴胡皂苷A可以通过调节急性脊髓损伤早期炎性因子水平来减轻继发性免疫炎症反应,Chen 等[18]研究也表明柴胡皂苷A 可以抑制香烟诱导的氧化应激及炎症反应。而本研究表明,柴胡皂苷A可以通过降低乌头碱中毒大鼠脑组织氧化应激与炎症反应。
内质网应激是指由多种因素导致错误折叠蛋白、未折叠蛋白于内质网腔累积,最终引起内质网功能行使受阻。在内质网应激早期,细胞通过启动未折叠蛋白反应特异性信号系统,促进GRP78 上调,与内质网中错误折叠蛋白、未折叠蛋白结合,纠正蛋白正确构象[19]。但在内质网应激过久时,CHOP 会大量表达,启动CHOP 介导的细胞凋亡。减轻或抑制内质网应激,可能预防细胞凋亡。本研究结果显示,柴胡皂苷A 可以降低乌头碱中毒大鼠CHOP、GRP78 蛋白水平,有研究显示右美托咪定可以通过抑制内质网氧化应激来减轻大鼠脑损伤[20],本研究结果与其有相似之处,表明柴胡皂苷A 可以通过降低乌头碱中毒大鼠脑组织内质网应激反应,从而降低细胞凋亡。
综上所述,柴胡皂苷A 可以降低乌头碱中毒大鼠脑组织氧化应激、炎症反应以及内质网应激反应,降低脑组织细胞凋亡率,实现对脑组织的保护作用。本研究通过大鼠模型进行探讨,而在临床上是否存在相似变化以及柴胡皂苷A 的临床使用剂量,还需要进一步研究。



