宋德顺,程华
作者单位:青岛市第八人民医院内镜诊疗科,山东 青岛 266100
结肠癌发病率、死亡率分别在全球癌症排名中位列第三和第四位[1]。由于生活方式、饮食习惯、生活条件的改变,结肠癌发病率、死亡率呈逐年上升趋势。早期结肠癌缺乏特征性症状,不易发现,且手术治疗效果不佳和化疗耐药,复发转移率较高,已成为威胁人类健康的重要公共卫生问题[2]。因此,探讨结肠癌发生发展的分子机制、寻找新的治疗策略迫在眉睫,对提高结肠癌的诊断、治疗和预后意义重大。环状RNA(circRNA,circular RNA)由单个具有基因调控潜能的mRNA 前体反向剪接而成。越来越多的证据表明,circRNA 与人类疾病尤其是癌症关系密切,由于其性质稳定,circRNA 具有潜在生物标志物作用[3-4]。研究显示,circRNA 肌球蛋白轻链激酶(myosin light chain kinase,MYLK)在前列腺癌中显着上调并促进癌细胞的增殖、迁移和侵袭,提示肌球蛋白轻链激酶(circMYLK)可能是一种致癌基因[5]。序列分析发现,微小RNA-497-5p(miR-497-5p)与circMYLK 存在理论互补结合位点。miR-497-5p 已被证实在结肠癌中表达下调,上调miR-497-5p 表达抑制结肠癌进展[6]。然而,circ‑MYLK能否靶向miR-497-5p参与结肠癌进展尚未可知。因此,于2019 年3 月至2020 年1 月本研究旨在通过体外细胞实验揭示circMYLK 在结肠癌中的作用和可能机制。
1 材料与方法
1.1 实验材料结肠癌细胞SW480、SW620、Caco-2以及正常结肠上皮细胞NCM460购于中国典型培养物保藏中心;RPMI-1640 培养基、DMEM 培养基购于美国Gibco 公司;胎牛血清、青链霉素双抗溶液购于北京索莱宝生物科技公司;Taqman miRNA 逆转录试剂盒、TRIzol 试剂购于美国Invitrogen 公司;Prime‑Script RT reagent Kit、SYBR Green Master Mix 购于大连TaKaRa 生物公司;细胞计数试剂盒(CCK-8)、放射免疫沉淀试验(RIPA)缓冲液、二喹啉甲酸(BCA)蛋白分析试剂盒、购于南京凯基生物公司;Transwell小室和基质胶购于美国BD 公司;兔源细胞周期蛋白D1(cyclinD1)单克隆抗体、兔源P21 单克隆抗体、兔源基质金属蛋白酶2(MMP-2)单克隆抗体、兔源MMP-9 单克隆抗体、兔源磷酸甘油醛脱氢酶(GAP‑DH)单克隆抗体、山羊抗兔IgG 购于上海艾博抗公司。
1.2 方法
1.2.1细胞培养 SW480、SW620、Caco-2 细胞均采用RPMI-1640 培养基进行培养,NCM460 细胞采用DMEM 培养基进行培养所有培养基中均补充10%的胎牛血清、100 U/mL 的青霉素和100 µg/mL 的链霉素。当细胞生长至汇合度80%时,按照1∶4 比例进行消化传代。
1.2.2实时荧光定量PCR(RT-qPCR)检测circ‑MYLK 和miR-497-5p 表达 采用TRIzol 试剂分别提 取NCM460、SW480、SW620、Caco-2 细 胞 中 总RNA。用Taqman miRNA 逆转录试剂盒将miRNA转化为cDNA。用3 U/mg RNase R 于37 ℃条件下孵育总RNA 15 min,利用PrimeScript RT reagent Kit 将mRNA 转化为cDNA。以cDNA 为扩增模板,利用SYBR Green Master Mix 进行RT-qPCR 扩增。以GAPDH、U6为内参照基因,2-ΔΔCt法分析circMYLK和miR-497-5p 的相对表达水平。circMYLK 正向引物序列5’-CAATCTTCTTATGCGGCGG-3’,反向引物序 列5’-GTACCGGCGCAGTCAGG-3’;miR-497-5p正向引物序列5’-AGCGAAGTTTTGAGCCGATC‑GGGC-3’,反向引物序列5’-GCCGTGAGTCAGAG‑GTGGT-3’;GAPDH 正 向 引 物 序 列5’-ATCCAC‑GGGAGAGCGACAT-3’,反向引物序列5’-CAGCT‑GCTTGTAAAGTGGAC-3’;U6 正 向 引 物 序 列5’-ACAGATCTGTCGGTGTGGCAC-3’,反向引物序列5’-GGCCCCGGATTATCCGACATTC-3’。
1.2.3细胞转染、细胞分组 按照2×105个/孔的密度将对数期SW480 细胞接种6 孔板,当细胞50%汇合时更换不含血清培养基进行细胞转染。首先,取50 pmol 的待转染物阴性对照(si-NC)、干扰circ‑MYLK(si-circMYLK)、过表达对照(miR-NC)、miR-497-5p 模 拟 物(miR-497-5p mimics)、干 扰circ‑MYLK+抑制物对照(si-circMYLK+anti-miR-NC)、干扰circMYLK+ miR-497-5p 抑制物(si-circMYLK+an‑ti-miR-497-5p)与适量无血清培养基混合,使其总体积 为25 µL,记 为 混 合 物A。取1 µL 的Lipo‑fectamine 3000 与24µL 无血清培养基混合,记为混合物B。室温静置5 min 后,将混合物A 和缓和物B混合均匀,记为混合物C。将混合物C 加入到细胞汇合度为50%的培养基中,6 h 后更换为含血清培养基,转染48 h 时收集细胞,RT-qPCR 测定转染效果,合格后进行后续实验。
1.2.4CCK-8法检测细胞活力 按照5×103个/孔的密度将各转染组细胞接种96 孔板,在培养24 h、48 h、72 h 时各取出一板细胞,按照10µL/孔加入CCK-8 试剂,暗室孵育1 h 后,采用酶标仪测定细胞在450 nm 处的光密度(optical density,OD)值以反映细胞的增殖活性。
1.2.5Transwell 实验检测细胞迁移和侵袭能力迁移实验时取200 µL 无血清培养液稀释的各组细胞悬液(2×105个/毫升)加入到Transwell 上腔室,取600µL 含10%胎牛血清的培养液加入到24 孔下室作为趋化剂。37 ℃孵育24 h 后,用棉签擦去上室未迁移细胞,用1%多聚甲醛固定至下室膜,0.5%结晶紫染色,然后在光学显微镜下随机选择五个视野计数和拍照,以其均数表示细胞迁移细胞数。侵袭实验时采用涂有基质胶的Transwell 小室,其余步骤同迁移实验。
1.2.6蛋白质印迹法(Western blotting)检测Cy‑clinD1、P21、MMP-2和MMP-9蛋白表达水平 采用放射免疫沉淀试验缓冲液提取总蛋白,BCA 蛋白分析试剂盒测定蛋白浓度。取适量蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,转移到PVDF 膜上。用5%牛血清白蛋白室温封闭膜1 h后,将膜至于稀释的一抗溶液中4 ℃孵育过夜,再用稀释的二抗室温孵育膜1 h。用电化学发光显色试剂盒进行显影、曝光。以GAPDH 为内参,用Bio-Rad Quantity One 软件分析对单个蛋白条带进行灰度分析。
1.2.7双荧光素酶报告基因实验 Starbase 数据库在线分析显示circMYLK 与miR-497-5p 存在连续互补结合位点。将含有miR-497-5p 预测结合位点或预测结合位点突变序列的circMYLK 克隆到pGL3-REPORT 双荧光素酶载体中,获得荧光素酶报告基因载体WT-circMYLK 和MUT-circMYLK。以Lipo‑fectamine 3000 作为转染试剂,将WT-circMYLK 和MUT-circMYLK 分别与miR-497-5p mimics 或miRNC 转染到SW480 细胞中。培养48 h 后收集细胞,使用双荧光素酶报告基因系统测定荧光素酶活性。为确定circMYLK 对miR-497-5p 表达的调控作用,将pcDNA、pcDNA-circMYLK、si-NC、si-circMYLK 分别转染SW480 细胞,转染48 h 时,检测各组细胞miR-497-5p的相对表达水平。
1.3 统计学方法采用SPSS 19.0 进行统计分析。每组设置3 个平行实验,重复3 次。计量资料满足正态性和方差齐性用±s形式表示。采用t检验比较两组间差异;采用单因素方差分析比较多组间差异,进一步多重比较采用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 circMYLK 和miR-497-5p 在结肠癌细胞中的表达结肠癌细胞SW480、SW620、Caco-2 中circ‑MYLK 表达较正常结肠上皮细胞NCM460 显着升高(P<0.05),miR-497-5p 表达较NCM460 细胞显着降低(P<0.05)。见表1。选择SW480 细胞进行后续研究。
表1 circMYLK和miR-497-5p在结直肠癌细胞中的表达/±s
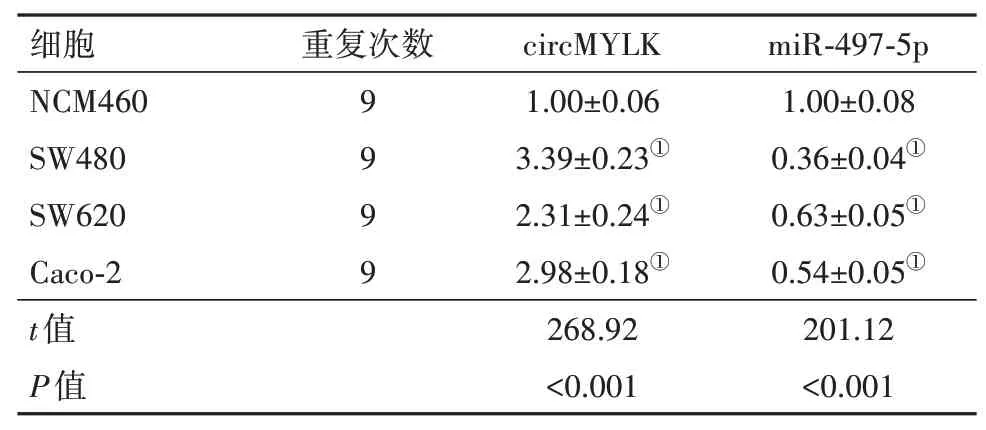
表1 circMYLK和miR-497-5p在结直肠癌细胞中的表达/±s
注:circMYLK 为肌球蛋白轻链激酶,miR-497-5p 为微小RNA-497-5p。①与NCM460细胞比较,P<0.05。
?
2.2 干扰circMYLK 表达对SW480 细胞增殖、迁移和侵袭的影响si-circMYLK 组SW480 细胞circ‑MYLK 的表达水平较si-NC 组显着降低(t=18.44,P<0.05),表明转染si-circMYLK 后SW480 细胞中circ‑MYLK 表达受到抑制。干扰circMYLK 表达后SW480 细胞OD450值、迁移和侵袭细胞数、CyclinD1、MMP-2 和MMP-9 蛋 白 表 达 显 着 降 低(t=18.97,13.76,15.02,17.73,21.73,31.62,P<0.05),P21 蛋白表达显着升高(t=24.15,P<0.05)。见表2。
表2 干扰circMYLK表达对SW480细胞增殖、迁移和侵袭的影响/±s
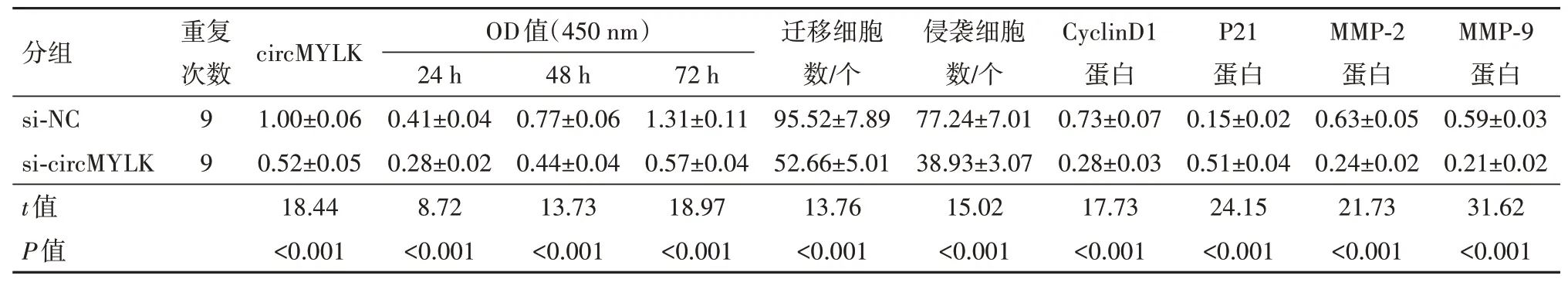
表2 干扰circMYLK表达对SW480细胞增殖、迁移和侵袭的影响/±s
注:circMYLK 为肌球蛋白轻链激酶,CyclinD1 为细胞周期蛋白D1,P21 为周期素依赖激酶抑制剂,MMP-2 为基质金属蛋白酶-2,MMP-9 为基质金属蛋白酶-9。
?
2.3 miR-497-5p 过表达对SW480 细胞增殖、迁移和侵袭的影响miR-497-5p 组SW480 细胞中miR-497-5p表达水平较miR-NC组显着升高(P<0.05),说明转染miR-497-5p mimics 后SW480 细胞中miR-497-5p 表达得到上调。过表达miR-497-5p 后SW480 细胞OD450值、迁移和侵袭细胞数、CyclinD1、MMP-2 和MMP-9 蛋白表达显着降低(t=17.54,8.78,13.17,18.34,17.49,18.60,P<0.05),P21 蛋白表达显着升高(t=22.14,P<0.05)。见图1,表3。
表3 miR-497-5p过表达对SW480细胞增殖、迁移和侵袭的影响/±s
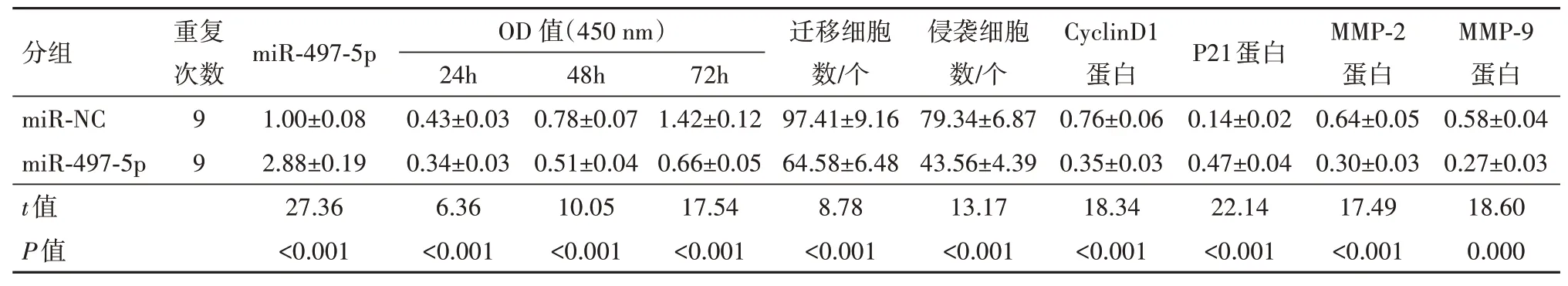
表3 miR-497-5p过表达对SW480细胞增殖、迁移和侵袭的影响/±s
注:miR-497-5p为微小RNA-497-5p,CyclinD1为细胞周期蛋白D1,P21为细胞周期蛋白依赖性激酶抑制剂1,MMP-2为基质金属蛋白酶-2,MMP-9为基质金属蛋白酶-9。
?
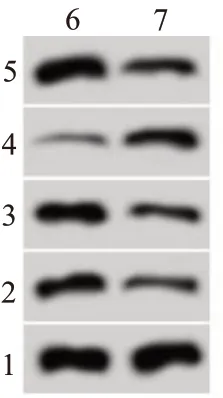
图1 miR-497-5p过表达对SW480细胞增殖、迁移和侵袭相关蛋白表达的影响
2.4 circMYLK 靶向调控miR-497-5p 的表达StarBase 数据库在线分析显示,circMYLK 与miR-497-5p 存在理论互补结合位点,见图2。双荧光素酶报告实验显示,miR-497-5p mimics 和WT-circ‑MYLK共转染组SW480细胞的相对荧光素酶活性较miR-NC 和WT-circMYLK 共转染组显着降低(t=26.71,P<0.05);而miR-497-5p mimics 和MUT-circ‑MYLK共转染组SW480细胞的相对荧光素酶活性与miR-NC 和MUT-circMYLK 共转染组比较无变化(t=0.98,P>0.05),见表4。pcDNA-circMYLK 组SW480 细 胞miR-497-5p表达0.54±0.05 较pcDNA 组1.00±0.05 显着降低(t=19.52,P<0.05);si-circMYLK 组SW480 细 胞miR-497-5p 表达3.07±0.22 较si-NC 组0.98±0.09 显着升高(t=26.38,P<0.05);四组总体SW480 细胞miR-497-5p表达比较F=754.12,P<0.001。
表4 双荧光素酶报告实验/±s
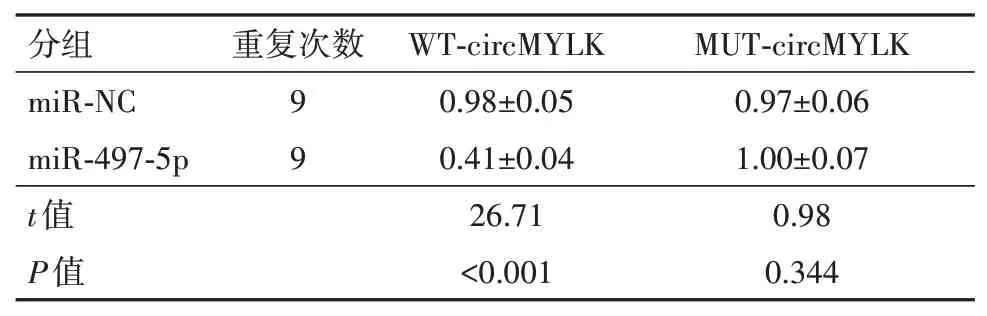
表4 双荧光素酶报告实验/±s
注:miR-NC为过表达对照,miR-497-5p为微小RNA-497-5p。
?
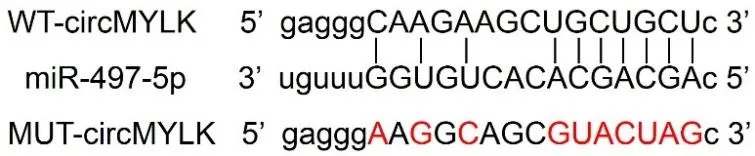
图2 circMYLK的序列中含有与miR-497-5p互补的核苷酸序列
2.5 抑制miR-497-5p 表达逆转了干扰circMYLK表达对SW480 细胞增殖、迁移和侵袭的作用sicircMYLK+anti-miR-497-5p 组SW480 细 胞miR-497-5p 的表达较si-circMYLK+ anti-miR-NC 组显着降低(t=9.99,P<0.05),细胞OD450值、迁移和侵袭细胞数、CyclinD1、MMP-2 和MMP-9 蛋 白 表 达 较si-circ‑MYLK+anti-miR-NC 组 显 着 升 高(t=15.38,16.02,14.32,18.01,20.80,23.30,P<0.05),P21 蛋白表达较si-circMYLK+anti-miR-NC 组显着降低(t=9.01,P<0.05)。见图3,表5。
表5 抑制miR-497-5p表达逆转了干扰circMYLK表达对SW480细胞增殖、迁移和侵袭的作用/±s
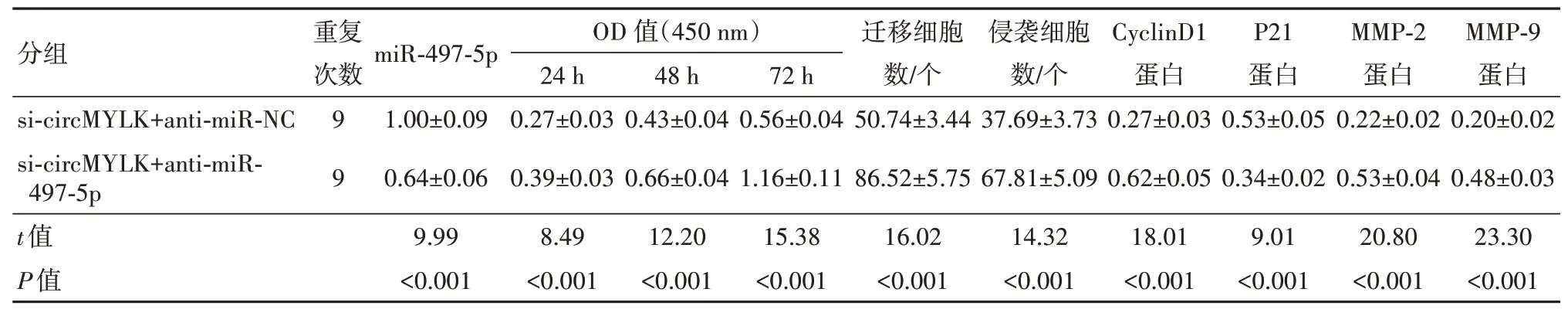
表5 抑制miR-497-5p表达逆转了干扰circMYLK表达对SW480细胞增殖、迁移和侵袭的作用/±s
注:si-circMYLK+anti-miR-NC 为干扰circMYLK+抑制物对照,si-circMYLK+anti-miR-497-5p 为干扰circMYLK+抑制物miR-497-5p。Cy‑clinD1为细胞周期蛋白D1,P21为细胞周期蛋白依赖性激酶抑制剂1,MMP-2为基质金属蛋白酶-2,MMP-9为基质金属蛋白酶-9。
?

图3 抑制miR-497-5p表达逆转了干扰circMYLK表达对SW480细胞增殖、迁移和侵袭相关蛋白表达的作用
3 讨论
circRNA 是一种内源性RNA,主要在真核转录组中表达,参与调控基因表达,在肿瘤发生发展中发挥重要作用[7]。本研究通过探讨circMYLK 在结肠癌中调节机制,以期为未来肿瘤的预防和治疗提供新思路。
circMYLK 是调节肌球蛋白功能的重要分子,对细胞骨架、细胞增殖和肌肉收缩均有影响。近年研究发现,circMYLK 在多种肿瘤进展中发挥致癌因子作用。例如,circMYLK 在肾细胞癌中表达上调,cir‑cMYLK 高表达与肿瘤体积增加、远端转移和较差的预后相关,沉默circMYLK能够抑制肿瘤的生长和转移[8]。circMYLK 在喉鳞癌中亦呈表达增加,circ‑MYLK 高表达促进喉鳞癌细胞增殖和G1/S 细胞周期过渡,而敲除circMYLK 则有相反的效果[9]。此外,敲除circMYLK对肝细胞进展也具有显着的抑制作用[10]。与前任研究类似,本研究发现结肠癌细胞中circMYLK 表达较正常结肠上皮细胞NCM460 显着升高,提示circMYLK高表达可能与结肠癌细胞的异常生物学行为有关。采用结肠癌细胞SW480 进行功能分析发现,转染si-circMYLK 干扰circMYLK可显着降低SW480 细胞活力、迁移和侵袭能力。P21 是细胞增殖的负性调控因子,其通过抑制细胞周期依赖性激酶活性具有阻止G1/S 期转换作用,而CyclinD1 则参与G1/S 期转换进而发挥胞增殖正性调控作用[11]。MMP-2 和MMP-9 是一类依赖锌的蛋白酶,其通过降解细胞外基质和基底膜胶原蛋白在促进肿瘤浸润、转移中发挥重要作用[12]。本研究发现,干扰circMYLK可降低CyclinD1、MMP-2和MMP-9表达水平,提高P21 表达,与功能分析相吻合,这进一步说明circMYLK 在结肠癌中的致癌作用,干扰circ‑MYLK可有效抑制SW480细胞的恶性生物学行为。
目前,多项研究研究证实circRNA 通过与miR‑NA 相互作用,使miRNA 失去自身功能,调控下游靶基因,从而影响肿瘤的生物学行为[13-14]。例如cir‑cRNA_103809 通过抑制miR-532-3p 表达减轻miR-532-3p 对 叉 头 样 转 录 因 子O4(Forkhead Box O4,FOXO4)的抑制作用进而影响结直肠癌细胞的增殖、迁移和凋亡[15]。为探索circMYLK在结肠中的作用机制,本研究通过序列分析发现miR-497-5p 可能含有circMYLK 的结合位点。miR-497-5p 属于miR-15/107 簇,已有报道显示肝细胞癌、黑色素瘤、非小细胞肺癌中miR-497-5p 表达下调,过表达miR-497-5p 可降低肿瘤细胞的增殖、迁移和侵袭能力[16-18]。本研究发现,结肠癌细胞中miR-497-5p 表达降低,过表达miR-497-5p 可降低SW480 细胞活力,抑制其迁移和侵袭能力,表明miR-497-5p 在结肠癌中具有抑癌作用,与Gharib E 等[19]研究结论相一致。进一步研究发现,过表达miR-497-5p 可降低SW480 细胞中circMYLK-WT 的相对荧光素酶活性,且circ‑MYLK 对miR-497-5p 具有负调控作用。此外,本研究发现抑制miR-497-5p 表达还可逆转干扰circ‑MYLK 对SW480 细胞活力、迁移侵袭和相关蛋白表达的影响,恢复细胞的增殖、迁移和侵袭能力,这进一步说明circMYLK 在结肠癌中的致癌作用与负调控miR-497-5p表达有关。
综上所述,结肠癌细胞中circMYLK 呈高表达,干扰circMYLK 通过靶向miR-497-5p 能够抑制结肠癌细胞增殖、迁移和侵袭。因此,circMYLK/miR-497-5p 分子轴是结肠癌的潜在治疗靶点,为未来结肠癌的防治提供了新的方向。



