付超,胡延伟,张婉琼,赵晓天
作者单位:邢台市中心医院,a手术室麻醉科,b胃肠外科,c门诊手术室,河北 邢台 054000
胃癌(gastric cancer,GC)是全球范围内最常见的消化道恶性肿瘤之一,每年有超过75万的死亡病例,使其位列肿瘤相关死因的第三位[1]。据统计,在2020 年中国拥有全球约44%的新发胃癌病例[2],严重危害国民健康。肿瘤复发是导致胃癌病人死亡的最主要原因,即使在接受标准的根治性手术后仍有超过30%的病人发生术后复发[3]。其中,腹膜复发是最常见的复发模式之一[4-5],一旦发生则病人生存期多不超过1 年。另外,由于血浆-腹膜屏障的存在,单独的全身系统化疗难以杀灭腹腔内残存的癌细胞或微转移灶,因此在预防术后腹膜复发方面疗效有限[4]。早期识别腹膜复发的高风险人群并施以针对性治疗对改善胃癌病人术后远期预后尤为重要。本研究旨在探讨影响胃癌根治术后腹膜复发的危险因素,并在此基础上构建列线图预测模型,从而对病人进行个体化风险分层。
1 资料与方法
1.1 一般资料选取2010 年1 月至2018 年12 月在邢台市中心医院接受胃癌根治术的861例胃癌病人作为研究对象。纳入标准:(1)年龄>18 岁;(2)病理确诊为原发性胃腺癌;(3)术前或术中检查未发现远处转移;(4)病人及近亲属知情同意。排除标准:(1)合并其他脏器的恶性肿瘤;(2)T4b 者;(3)手术切缘阳性者;(4)术前接受过化疗、放疗等抗肿瘤治疗;(5)既往有胃手术史;(6)临床资料或随访数据不全者。全部病人中,男性626 例,女性235 例,年龄(59±10)岁,年龄范围为23~75 岁。根据肿瘤部位,胃上部癌190 例,胃中部癌195 例,胃下部癌388例,混合型88例。根据手术方式,412例病人接受全胃切除术,406例病人接受远端胃切除术,43例病人接受近端胃切除术。总共560例病人接受术后辅助化疗。在301例未接受术后辅助化疗的病人中,201例无化疗指征,72 例一般状况差无法耐受化疗,28例因经济原因拒绝化疗。根据计算机生成的随机数,将861 例病人7∶3 随机分配至训练集(603 例)和测试集(258 例)。两组病人的基线特征相近,差异无统计学意义(P>0.05),见表1。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 治疗方案全组病人均行开腹或腹腔镜胃癌根治术,手术均在全麻气管插管下进行。根据《日本胃癌治疗指南(第3 版)》[6]确定手术切除范围。根据美国癌症联合委员会(American joint committee on cancer,AJCC)癌症分期系统(第8 版)[7]对病人进行pTNM 分期。Ⅱ~Ⅲ期病人在体力状况良好的情况下均被推荐接受以氟类药物为基础的静脉化疗,包括奥沙利铂联合替吉奥(SOX)方案或奥沙利铂联合卡培他滨(XELOX)方案。
1.3 随访计划所有病人术后通过电话或门诊进行规律随访,通常术后2年内每3个月复查1次,3~5 年每6 个月复查1 次,5 年后每年复查1 次。末次随访时间为2022 年5 月5 日至5 月28 日,中位随访时间为47个月,范围为4~132个月。
1.4 观察指标(1)病人的临床病理资料,包括:年龄、性别、组织学分级、Lauren 分型、肿瘤部位、病理分期、脉管与神经侵犯、术前癌胚抗原(CEA)水平、术前糖类抗原(CA)19-9 水平与辅助化疗。(2)本研究的主要终点为腹膜复发,根据Lee等[3]的研究将其定义为影像学检查或手术探查发现明显的腹膜增厚或结节、术后复查过程中发现腹水并且腹水细胞学检查阳性。女性卵巢的库肯勃瘤同样被认为是腹膜复发。(3)生存指标:复发时间定义为手术时间至术后肿瘤复发时间,复发后生存时间定义为术后肿瘤复发时间至死亡时间或末次随访时间。
1.5 统计学方法所有数据应用SPSS 22.0 软件与R软件(4.1.3版本)进行统计学分析。计数资料以例(%)表示,应用χ2检验或Mann-WhitneyU检验。应用logistic 回归模型进行影响术后腹膜复发的单因素分析,P<0.05 者纳入多因素分析模型,并应用基于Wald 标准的向后逐步回归法,纳入标准为0.05,剔除标准为0.1,最终确定影响术后腹膜复发的独立预测因素,并依此建立列线图预测模型。应用受试者操作特征(receiver operating characteristic,ROC)曲线并计算曲线下面积(area under the curve,AUC)来评估列线图模型的预测能力。应用校准曲线与Hosmer-Lemeshow 检验评估模型的预测一致性,当Hosmer-LemeshowP>0.05 时代表一致性良好[8]。所有检验均为双侧,显着性水平设为P<0.05。
2 结果
2.1 胃癌术后的复发模式861 例胃癌病人中,总共286例(33.2%)在随访期间发生了术后复发,其中99例为腹膜复发(34.6%)。99例腹膜复发者的中位复发时间为17 个月,复发后的中位生存时间为6 个月;其余187 例非腹膜复发者的中位复发时间为15个月,复发后的中位生存时间为10个月。
2.2 腹膜复发与临床病理特征间的相关性训练集的603例病人中,与非腹膜复发组相比,腹膜复发组的年龄较小(<60岁:64%比47%)、多为女性(43%比25%)、肿瘤多为G3(79%比51%)或弥漫型(78%比47%)、病理分期较晚(Ⅲ:92%比43%)、多合并脉管(50%比30%)或神经侵犯(58%比27%),均差异有统计学意义(P<0.05)。见表2。
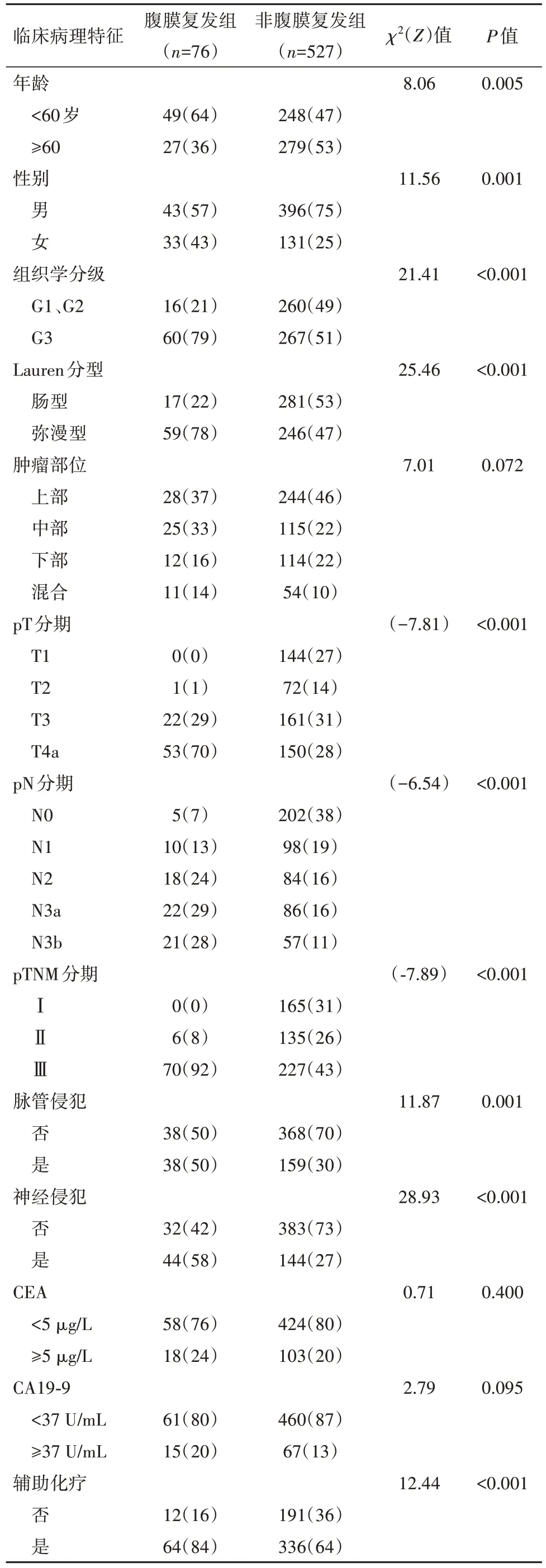
表2 训练集中腹膜复发组与非腹膜复发组之间的临床病理特征差异/例(%)
2.3 腹膜复发的危险因素分析训练集的603 例病人中,单因素分析表明,年龄、性别、组织学分级、Lauren 分型、pT 分期、pN 分期、脉管与神经侵犯、辅助化疗与术后腹膜复发显着相关(P<0.05),见表3。将上述特征纳入多因素分析,并赋值如下:年龄(<60岁为1,≥60岁为2)、性别(男为1,女为2)、组织学分级(G1、G2 为1,G3 为2)、Lauren 分型(肠型为1,弥漫型为2)、pT 分期(T1-2 为1,T3-4 为2)、pN 分期(N0 为1,N1-3 为2)、脉管与神经侵犯(否为1,是为2)、辅助化疗(否为1,是为2)。
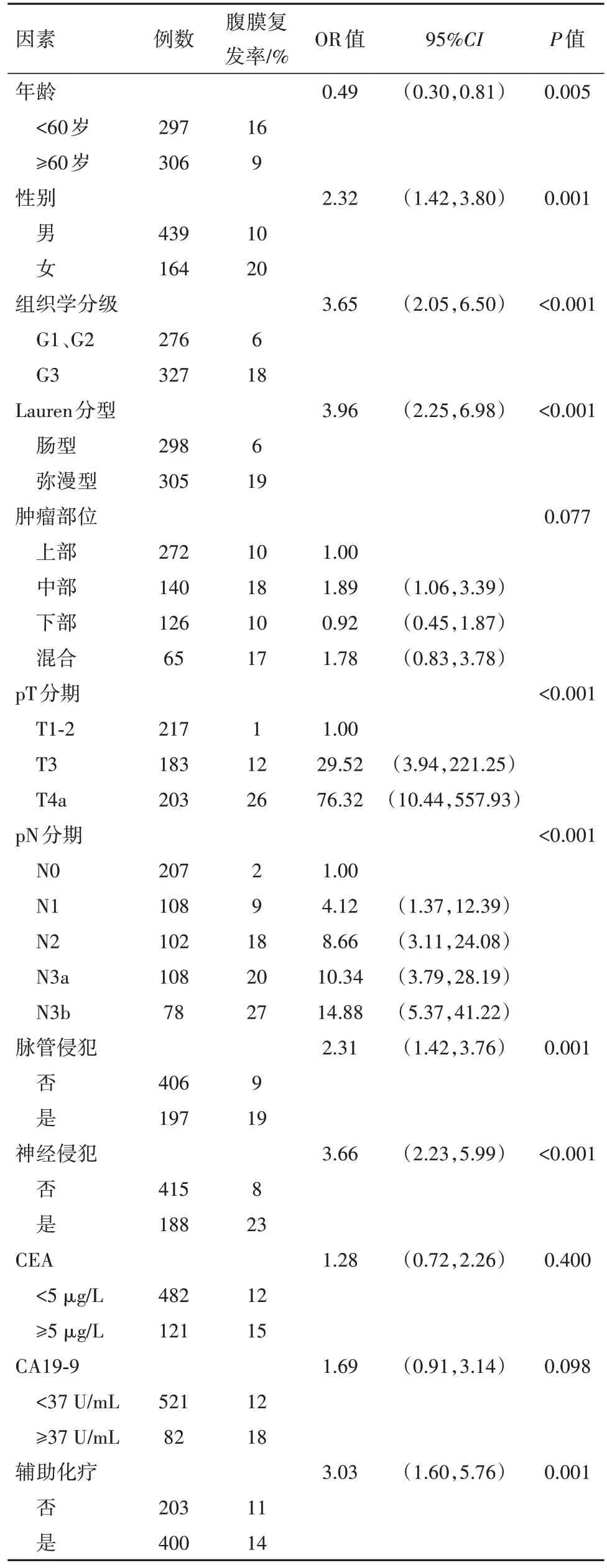
表3 训练集中影响胃癌病人术后腹膜复发的单因素分析
基于向后逐步回归法的多因素分析表明,年龄[OR=0.55,95%CI:(0.31,0.95)]、性别[OR=1.95,95%CI:(1.11,3.41)]、Lauren 分型[OR=2.27,95%CI:(1.24,4.17)]、pT 分期[OR=3.11,95%CI:(1.59,6.08)]与pN 分期[OR=3.29,95%CI:(1.24,8.77)]是术后腹膜复发的独立影响因素(P<0.05),而组织学分级、脉管或神经侵犯、辅助化疗不是术后腹膜复发的独立影响因素(P>0.05)。见表4。
2.4 预测腹膜复发的列线图模型构建根据多因素分析结果,结合年龄、性别、Lauren 分型、pT 分期、pN 分期以上5个指标在训练集的603例病人中构建列线图预测模型。其中,年龄<60 岁记4 分、女性记4 分、弥漫型记4 分、T2 期记7 分、T3 期记13 分、T4a期记20分、N1期记1分,N2期记2分、N3a期记4分、N3b 期记5 分。累加各指标的分数得到总分,根据总分即可个体化预测病人术后发生腹膜复发的概率。见图1。

图1 基于临床病理特征预测胃癌术后腹膜复发的列线图模型
2.5 预测腹膜复发的列线图模型验证在训练集与测试集中,列线图预测模型的AUC 值分别为0.83,95%CI:(0.78,0.87);0.83,95%CI:(0.75,0.90),检验能效性差异有统计学意义(P<0.001)。该模型预测训练集与测试集的腹膜复发率与实际腹膜复发率基本一致(Hosmer-LemeshowP=0.809、0.989)。根据模型分数将全组病人分为3 个风险组:低风险组(0~20 分)462 例,腹膜复发率为1.9%(9/462);中风险组(21~32 分)335 例,腹膜复发率为17.3%(58/335);高风险组(33~37 分)64 例,腹膜复发率为50.0%(32/64);差异有统计学意义(χ2=145.77,P<0.001)。不同风险组病人接受辅助化疗均未能显着降低术后腹膜复发率(低风险组:χ2=5.74,P=0.017;中风险组:χ2=0.46,P=0.499;高风险组:χ2=0.57,P=0.450)。
3 讨论
尽管胃癌的发病率与病死率在中国和世界范围内均呈现出逐渐下降的趋势,但其新发病例数与死亡例数仍存在逐年上升的趋势[9-11]。肿瘤复发是导致病人行胃癌根治术后死亡的主要原因,其中腹膜复发可引起肠梗阻、大量癌性腹水、恶液质等严重并发症,在明显降低病人生活质量同时显着缩短了生存期。本研究中的286例复发性胃癌病人中99例出现腹膜复发(34.6%),同时复发后的中位生存时间明显较短(6 个月),这与既往研究相当。如何准确识别术后腹膜复发的高危人群并制定合适的治疗与随访策略是改善胃癌预后的一大关键。
本研究通过多因素分析发现,年龄、性别、Lauren分型与病理分期是术后腹膜复发的独立影响因素。与既往研究一致[3-5],本研究分析结果表明肿瘤浸润深度是影响术后腹膜复发的最重要因素。当肿瘤病灶浸润甚至浸出浆膜层时,癌细胞可从胃表面脱落,种植于腹膜表面,并可形成肉眼不可见的游离肿瘤细胞或微转移灶,从而增加了术后腹膜复发的风险。而淋巴结转移是否与腹膜复发风险相关尚存在争议:Lee等[3]的研究认为淋巴结转移不是术后腹膜复发的独立危险因素,而郭卫平等[12]的研究表明淋巴结转移可独立于T分期从而预测腹膜复发风险。本研究发现高淋巴结分期是腹膜复发的独立预测因素,这可能是由于这部分病人在进行术中清扫时更容易发生转移淋巴结或淋巴脉管瘤栓的破裂,从而使癌细胞脱落于腹腔内[13]。
与Lee等[3]的研究相似的是,Lauren分型同样与腹膜复发风险密切相关。Lauren分型通常将胃癌分为肠型与弥漫型,其中肠型肿瘤发生于肠化生黏膜,一般有明显的腺样结构;而弥漫型肿瘤发生于胃固有黏膜,癌细胞呈弥漫性生长。既往研究表明[14],弥漫型肿瘤恶性程度高、侵袭性强,缺乏细胞连接,因此相对于肠型肿瘤更容易在腹腔内扩散、形成种植灶。另外,年龄、性别同样是影响术后腹膜复发的重要因素,这在既往的研究中也多有报道[4-5,15-16]。出现该现象的原因仍不明确,可能是由于年龄<60 岁的女性病人肿瘤为弥漫型的比例较高,同时首次确诊时的分期通常较晚期,从而使得术后腹膜复发的风险较高。
目前,术后辅助化疗在胃癌综合治疗中的价值已得到广泛肯定[17-18],然而静脉化疗在预防腹膜复发方面的疗效并不确切[19-20]。本研究结果同样表明,即使在术后腹膜复发高风险的人群中,辅助化疗仍未能显着降低其腹膜复发率。近年来,腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)因其能够突破血浆-腹膜屏障的限制、从而在腹腔局部达到有效的癌细胞杀伤浓度[21],已逐渐成为进展期胃癌病人的重要治疗手段之一。Zhang 等[22]在一项meta 分析中证实,预防性HIPEC可有效延长胃癌病人术后的远期生存并降低腹膜复发率。因此,针对腹膜复发高风险的人群,笔者认为有必要在术后辅助化疗的基础上进一步联合HIPEC。
综上所述,年龄、性别、Lauren 分型与病理分期是胃癌病人接受根治性手术后发生腹膜复发的独立相关因素。基于上述指标建立的列线图预测模型能够准确预测腹膜复发发生的风险,有利于制定个体化的治疗与随访策略。另外,鉴于目前静脉化疗在预防术后腹膜复发方面的疗效并不理想,笔者将在未来的前瞻性研究中进一步探讨HIPEC 这一技术在预防胃癌病人特别是高危病人腹膜复发方面的价值。



